
Лекция 2
.pdf
vk.com/club152685050 | vk.com/id446425943 |
|
Электрохимический ряд |
содержание |
|
напряжений металлов
Электрохимический ряд напряжений металлов
Li, K, Ca, Na, Mg, Al, Zn, Cr, Fe, Pb, H2, Cu, Ag, Hg, Au
Gо = - ∆ЕоnF
где F - число Фарадея (96485 Кл);
n - число электронов на один перенесенный ион. ∆Ео - разность стандартных потенциалов системы, В
Eoок ля Eoв ля
vk.com/club152685050 | vk.com/id446425943 |
|
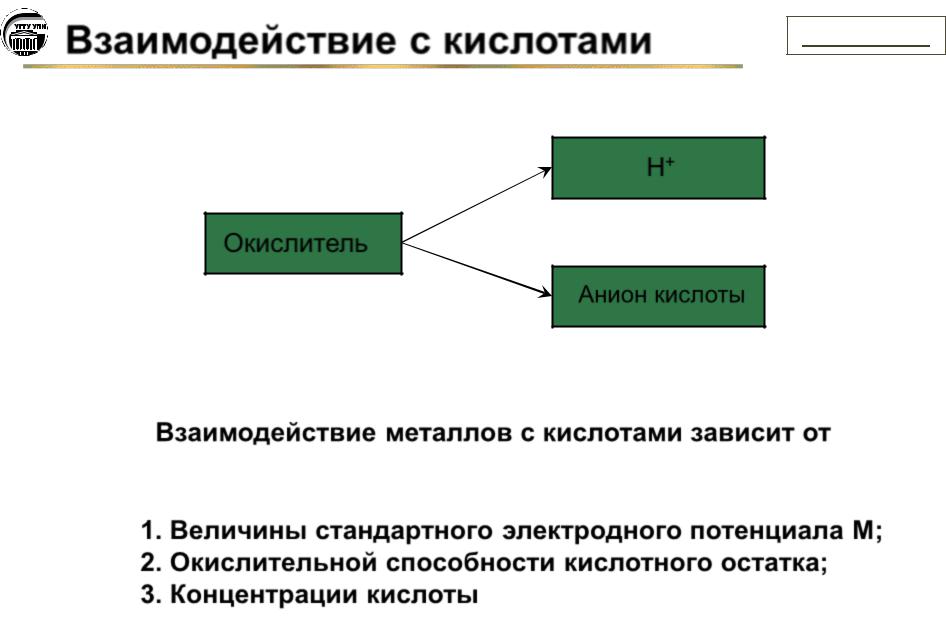
Взаимодействие с кислотами |
содержание |
|
Н+
Окислитель
Анион кислоты
Взаимодействие металлов с кислотами зависит от
1.Величины стандартного электродного потенциала М;
2.Окислительной способности кислотного остатка;
3.Концентрации кислоты
vk.com/club152685050 | vk.com/id446425943
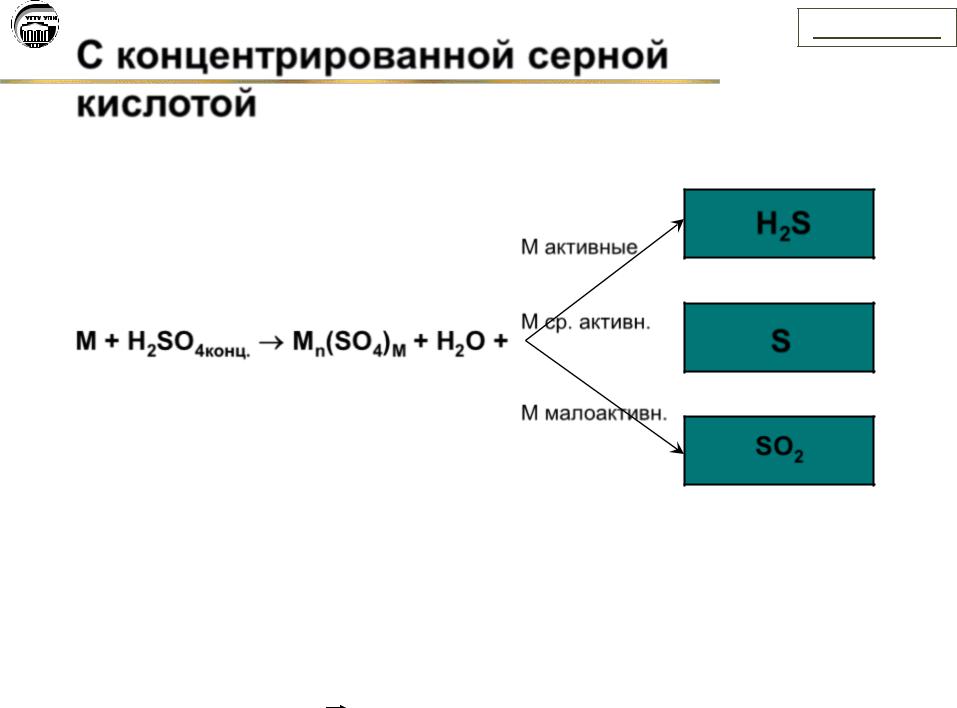
С концентрированной серной
кислотой
М активные
Мср. активн.
М+ H2SO4конц. Мn(SO4)M + H2O + 
Ммалоактивн.
содержание
H2S
S
SO2

vk.com/club152685050 | vk.com/id446425943 |
|
С концентрированной азотной |
содержание |
|
кислотой
М + HNO3конц. М(NO3)M + H2O + NO2
3Re + 7HNO3 = 3HReO4 + 7NO + 2H2O
Au + HNO3 + 4HCl = H[AuCl4 ] + NO + 2H2O
«царская водка»
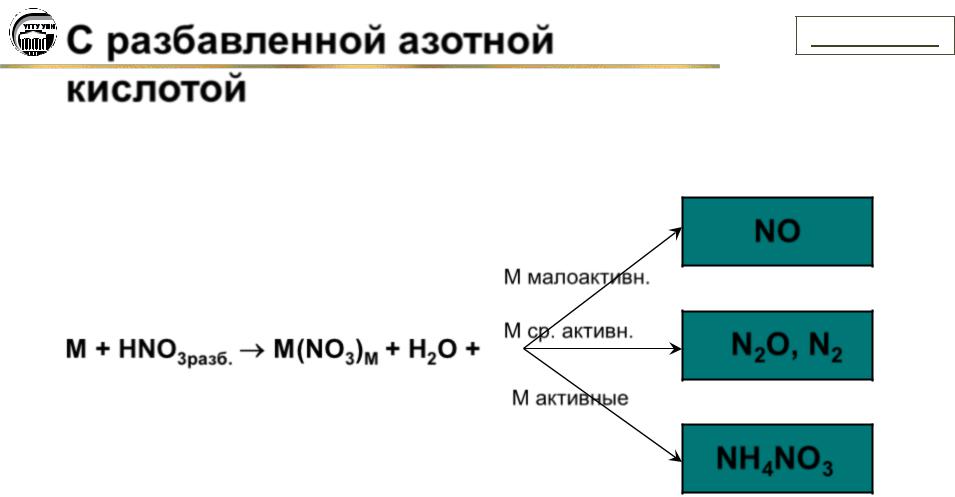
vk.com/club152685050С разбавленной| vk.com/id446425943азотной
кислотой
М малоактивн.
М ср. активн.
М + HNO3разб. М(NO3)M + H2O +
М активные
содержание
NO
N2O, N2
NH4NO3
vk.com/club152685050 | vk.com/id446425943 |
|
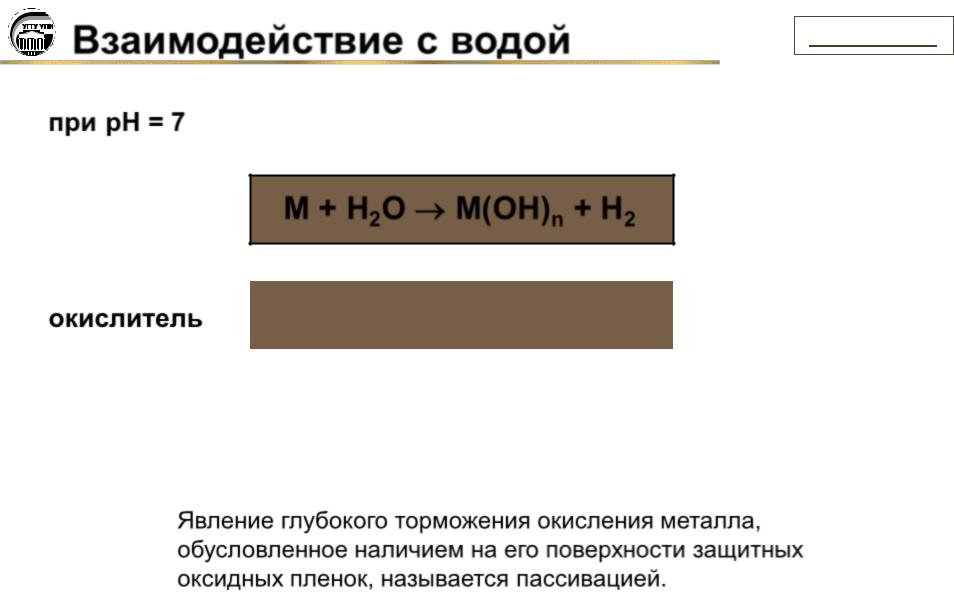
Взаимодействие с водой |
содержание |
|
при pH = 7
M + H2O M(OH)n + H2
окислитель |
2H |
2 |
O 2e H |
2 |
2OH |
|
|
|
|
||
|
|
|
|
|
|
E |
ок ля |
E |
2H |
2 |
O/H |
2 |
|
|
|||||
|
|
|
|
|
0,41 B,
Явление глубокого торможения окисления металла, обусловленное наличием на его поверхности защитных оксидных пленок, называется пассивацией.

vk.com/club152685050 | vk.com/id446425943 |
|
Взаимодействие с водными |
содержание |
|
растворами щелочей
при pH = 14
E |
0 |
|
|
0,83 B |
|
|
|
|
|
|
2H |
2 |
O/H |
|
|
|
2 |
|
окислитель
2H |
|
O 2e H |
|
2OH |
|
2 |
2 |
|
|||
|
|
|
|
||
|
|
|
|
|
|
в растворах щелочей растворяются металлы, потенциалы которых меньше -0,83В, склонные к образованию гидроксокомплексов типа [Me(OH)4 ]n-
то есть металлы, чьи гидроксиды являются амфотерными: Ве(OH)2, (Al(OH)3, Zn(OH)2, Sn(OH)2, Рb(OH)2, Cr(OH)3 и др.

vk.com/club152685050 | vk.com/id446425943 |
содержание |
|
Выводы и заключения |
||
|
||
|
Химия металлов является важнейшей является частью неорганической химии.
Знание законов Фарадея, а также понятие электродного потенциала позволяет охарактеризовать электрохимические процессы, проходящие с участием свободных металлов.

vk.com/club152685050 | vk.com/id446425943 |
|
Список литературы |
содержание |
|
1. Ахметов Н.С. Общая и неорганическая химия. М.: Высшая школа.
2002.
2. О.М. Полторак, Л.М. Ковба. «Физико-химические основы неорганической химии». М.: МГУ, 1994.
3. В.И. Горшков, И.А. Кузнецов. «Физическая химия». М.: МГУ,
1993.
4. А. Джонсон. Термодинамические аспекты в курсе неорганической химии. М.: Мир. 1985.
5. Анорганикум. Под ред. Л. Кольдица. М. Мир. 1984. Т.1. 6.
Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность. М., Химия, 1987.
7. Фичини Ж., Ламброзо-Бадер Н., Депезе Ж.-К. Основы физической химии. М. Мир. 1972. стр.276-283.
8. Дж. Кемпбел. Современная общая химия. М.:Мир. 1975г. Т.2.
стр.90. гл.20., Т3.
9. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. М.:
Мир,1982. Т. 2.
10. Б.Б.Дамаскин, О.А.Петрий. Электрохимия. М: Высшая школа,
1987.
11. CRC Hand book of Chemistry and Physics. 82 издание. 2001-2002.

vk.com/club152685050 | vk.com/id446425943
Металлы платиновой
группы
