

vk.com/club152685050 | vk.com/id446425943
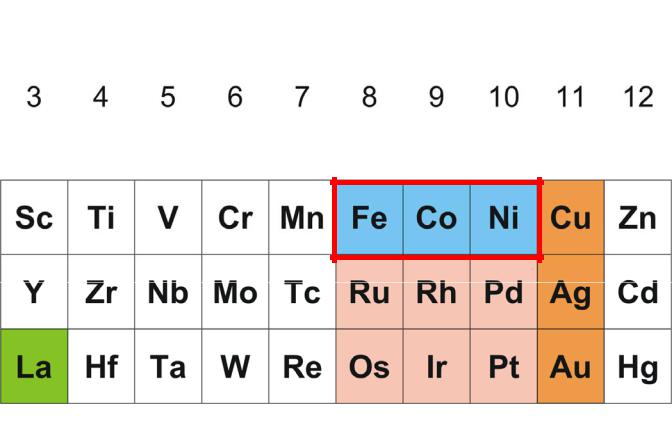
Триада железа
Железо, кобальт, никель
Лекция 11
vk.com/club152685050 | vk.com/id446425943
Триада железа
1ряд
2ряд
3ряд
Fe – железо, Co – кобальт, Ni – никель
vk.com/club152685050 | vk.com/id446425943
Триада железа
|
Fe |
Co |
Ni |
Ат. № |
26 |
27 |
28 |
Эл. Конф. |
3d64s2 |
3d74s2 |
3d84s2 |
R(ат.), пм |
126 |
125 |
125 |
I1, эВ |
7.87 |
7.86 |
7.64 |
I2, эВ |
16.18 |
17.06 |
18.17 |
I6, эВ |
99.5 |
102 |
108 |
χ(A-R) |
1.64 |
1.70 |
1.75 |
C.O. |
2,3,(4),6 |
2,3,(4) |
2,(3),(4) |
vk.com/club152685050 | vk.com/id446425943
Свойства элементов
|
Fe |
Co |
Ni |
Т.пл., оС |
1539 |
1490 |
1453 |
Т.кип., оС |
2861 |
3100 |
2900 |
aH0, кДж/моль |
418 |
428 |
430 |
d, г/см3 |
7.87 |
8.90 |
8.90 |
σ, См/м (·106) |
10 |
15 |
13 |
T , oC |
770 |
1130 |
358 |
C |
|
|
|
E0(M2+/M0), В |
–0.440 |
–0.277 |
–0.257 |
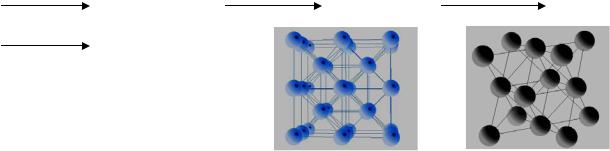
α-Fe(ОЦК) 769 оС |
β-Fe(ОЦК) 910 оС γ-Fe(ГЦК) |
1400 оС δ-Fe(ОЦК) |
|
α-Co(ГЦК) 417 оС |
β-Co(ГПУ) |
|
|
α-Ni(ГЦК)
vk.com/club152685050 | vk.com/id446425943
Химические свойства Fe, Co, Ni
1.Пассивируются концентрированными H2SO4, HNO3 и
царской водкой
2.Растворяются в кислотах-неокислителях
Co + 2HCl = CoCl2 + H2
10Fe + 36HNO3 (разб) = 10Fe(NO3)3 + 3N2 + 18H2O
5Ni + 12HNO3 (разб) = 5Ni(NO3)2 + N2 + 6H2O
3.Не растворяются в щелочах
4.Реагируют с кислородом при нагревании
мелкодисперсное чистое железо пирофорно!
4Fe + 3O = 2Fe O |
3 |
Fe3+ |
|||
3Co + O |
|
2 |
2 |
Co3+, Co2+ |
|
2 |
= Co O |
|
|||
|
3 |
4 |
|
Ni2+ |
|
2Ni + O = 2NiO |
|
|
|||
2 |
|
|
|
|
|
vk.com/club152685050 | vk.com/id446425943
Химические свойства Fe, Co, Ni
5. |
Железо ржавеет |
|
|
|
4Fe + 3O2 + 2H2O = 4FeO(OH) |
|
|
6. |
Реагируют с галогенами |
|
|
|
FeX3 (но FeI2), CoX2 (но CoF3), NiX2 |
FeO(OH) |
|
7. |
Реагируют с неметаллами при нагревании |
||
|
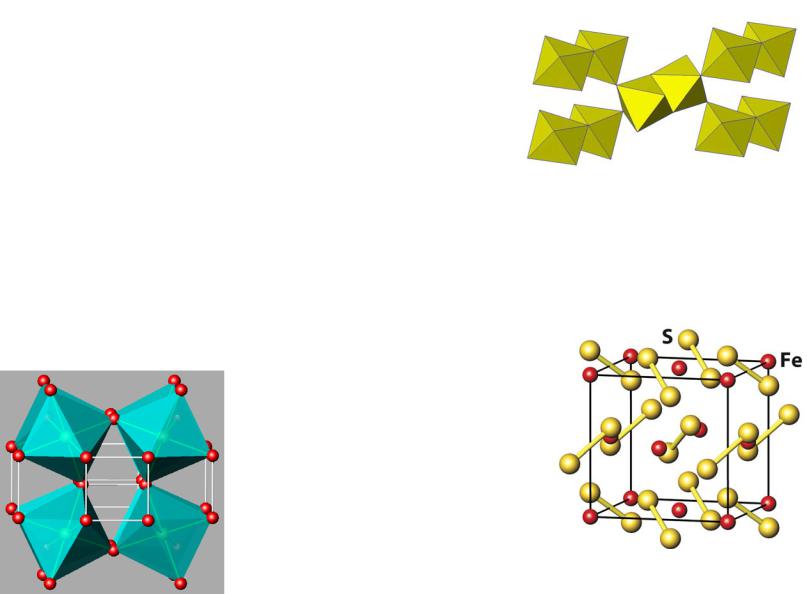
Fe + S2 = FeS2 |
3Ni + 2S = Ni3S2 |
|
|
Fe + P = FeP4 |
Co + P = CoP3 |
|
CoP3 ≡
(Co3+)4( P44–)3
FeS2 ≡ Fe2+S22–
vk.com/club152685050 | vk.com/id446425943
Химические свойства Fe, Co, Ni
8. Железо реагирует с углеродом
Fe + C = Fe3C (цементит)

vk.com/club152685050 | vk.com/id446425943
Получение Fe
Железо – самый распространенный d-металл (4.1%), 4й по распространенности элемент в земной коре
основные минералы: Fe2O3 красный железняк, гематит FeCO3 железный шпат, сидерит; Fe3O4 магнитный железняк, магнетит; FeTiO3 ильменит; FeOOH гётит; FeS2 железный колчедан, пирит
Доменный процесс: Fe2O3 + CO = Fe + CO2
(700-900 oC)
«Прямое» получение: Fe3O4 + CH4 = 3Fe + CO2 + 2H2O
(1000 oC)
Сверхчистое железо: Fe(CO)5 = Fe + 5CO (200 oC)

vk.com/club152685050 | vk.com/id446425943
Получение Co, Ni
Кобальт (0.002 %) и никель (0.02 %)
основные минералы: CoAs2 кобальтовый шпейс,
смальтит,CoAs3 скуттерудит; CoAsS кобальтовый блеск,
кобальтит;NiS желтый колчедан, миллерит; NiAsS белый колчедан, хлоантит; (Ni,Mg)6[Si4O10(OH)8]·4H2O гарниерит;
(Ni,Fe)9S8 пентландит
Обжиг сульфидов:
3CoS + 5O2 = Co3O4 + 3SO2 2Ni3S2 + 7O2 = 6NiO + 4SO2
Восстановление: Co3O4 + 4C = 3Co + 4CO NiO + C = Ni + CO
vk.com/club152685050 | vk.com/id446425943
Применение Fe, Co, Ni
1.Fe – стали, чугун. Чистое железо не применяется!
2.α-Fe2O3 – в ферритах
3.Оксиды Fe – пигменты
4.Co – коррозионно-стойкие сплавы
5.Co – производство витамина В12
6.Ni – монетные сплавы
7.Ni – тонкие покрытия
8.Ni, Ni(OH)2 – в аккумуляторах
vk.com/club152685050 | vk.com/id446425943
Диаграммы Фроста для Fe, Co, Ni
|
6 |
|
|
|
FeO 2– |
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
nE |
2 |
|
|
Fe3+ |
|
FeO42– |
3 |
|
|
|
MO2 |
|
|
|
|
|
|
|
|
||||||
|
0 |
Fe2+ |
|
2 |
|
|
|
|
||||
|
|
|
|
|
M = Co, Ni |
|
|
|||||
|
|
|
|
Fe2O3 |
|
|
|
M3+ |
|
|||
|
-2 |
Fe(OH) |
|
|
|
|
|
|
||||
|
2 |
|
|
6nE |
1 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||
|
0 |
1 |
2 |
3 |
4 |
5 |
0 |
|
|
|
MO2 |
|
|
|
|
|
n |
|
|
|
|
M2+ |
|
||
|
|
|
|
|
|
|
|
|
|
|||
Fe: достижима более |
|
|
-1 |
M(OH)2 |
|
MOOH |
||||||
высокая с.о. |
|
|
|
|
|
|
||||||
|
|
|
|
0 |
1 |
2 |
||||||
Co, Ni: похожие red/ox |
|
|
3 |
4 |
||||||||
|
|
|
|
n |
|
|
||||||
свойства |
|
|
|
|
|
|
|
|
|
|
||
vk.com/club152685050 | vk.com/id446425943
Соединения Fe(VI)
1.Только Fe образует производные в с.о. +6
2.Получение
2Fe(OH)3 + 10KOH + 3Br2 = 2K2FeO4 + 6KBr + 8H2O K2FeO4 + BaCl2 = BaFeO4↓ + 2KCl красный
3.Устойчивость: стабильны только в щелочном растворе
4Na2FeO4 + 6H2O = 4FeO(OH) + 8NaOH + 3O2 2Na2FeO4 = Na3FeO4 + NaFeO2 + O2 (700 oC)
4.Окислитель
FeO42–
2K2FeO4 + 16HCl = 2FeCl3 + 3Cl2 + 4KCl + 8H2O
4K2FeO4 + 10H2SO4 = 2Fe2(SO4)3 + 3O2 + 4K2SO4 + 10H2O 2K2FeO4 + 2NH3 = 2FeO(OH) + N2 + 4KOH
vk.com/club152685050 | vk.com/id446425943
Соединения Fe, Co, Ni (IV)
1. Получение оксопроизводных |
|
|
|
|
|
|
|||||||||||
8Na O + 2Fe O = 4Na FeO + 3O |
2 |
|
(800 oC) |
|
|||||||||||||
2 |
|
2 |
|
2 |
3 |
|
|
|
4 |
|
4 |
|
|
|
|
|
|
12KO + Co O = 3K CoO |
4 |
+ 8O |
|
|
(1100 oC) |
||||||||||||
|
2 |
3 |
4 |
|
|
|
4 |
|
2 |
|
|
|
|
|
|
||
2SrO + Fe O + ½O = 2SrFeO |
|
|
(900 oC) |
|
|||||||||||||
|
|
2 |
|
3 |
|
|
2 |
|
|
3 |
|
|
|
|
|
|
|
Co(OH)2 + O3 = CoO2 + O2 + H2O |
[CoO2·nH2O] |
|
|||||||||||||||
2. Получение фторопроизводных |
|
|
|
|
|
|
|||||||||||
NiF + 2KF + XeF |
2 |
= K [NiF ] + Xe |
|
|
d6: t |
2g |
6 |
|
|||||||||
2 |
|
|
|
|
|
|
|
2 |
|
6 |
|
|
|
|
|
||
CoCl |
2 |
+ 2CsCl + 3F |
= Cs [CoF ] + 2Cl |
2 |
d5: t |
2g |
3e |
2 |
|||||||||
|
|
|
|
|
|
2 |
|
2 |
6 |
|
|
g |
|||||
3. Неустойчивы в растворе
3Na4FeO4 + 5H2O = Na2FeO4 + Fe2O3 + 10NaOH
2K4CoO4 + 6H2SO4 = 2CoSO4 + 4K2SO4 + O2 + 6H2O

vk.com/club152685050 | vk.com/id446425943
Соединения Fe, Co, Ni (III)
1.Наиболее устойчивая с.о. Fe
2.Известны оксид Fe и гидроксиды Fe, Co, Ni
3.Fe2O3 – красное кристаллическое вещество, 5 кристаллических модификаций, основные:
α-Fe2O3 (гематит) γ-Fe2O3 (маггемит)
α-Fe2O3 – низкая реакционная способность
γ-Fe2O3 – высокая реакционная способность
γ-Fe |
O |
α-Fe O |
3 |
400 оС |
|
2 |
3 |
2 |
|
||
FeOOH |
γ-Fe |
O |
|
90 оС |
|
|
|
2 |
3 |
|
|
γ-Fe2O3 |
+ 6HCl = 2FeCl3 + 3H2O |
||||
γ-Fe2O3 |
+ 6KOH (конц) + 6H2O = 2K3[Fe(OH)6] |
||||
α-Fe2O3 + KOH ≠ |
|
|
α-Fe2O3 + HCl ≠ |
||
α-Fe2O3
γ-Fe2O3
vk.com/club152685050 | vk.com/id446425943
Соединения Fe, Co, Ni (III)
4. Гидроксиды
Fe2(SO4)3 + 6KOH = 2Fe(OH)3 + 3K2SO4
2CoSO4 + 4KOH + H2O2 = 2Co(OH)3 + 2K2SO4
2NiSO4 + 6KOH + Br2 = 2NiOOH + 2KBr + 2K2SO4
2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + 3H2O |
коричневый |
Fe(OH)3 + Ba(OH)2 (конц) = Ba[Fe(OH)5] |
белый |
Co(OH)3 + 2H2SO4 (конц) = H[Co(SO4)2] + 3H2O зеленый
2Co(OH)3 + 2H2SO4 (разб) = 2CoSO4 + 1/2O2 + 5H2O NiOOH + 4HCl = NiCl2 + Cl2 + 2H2O
vk.com/club152685050 | vk.com/id446425943
Соединения Fe, Co, Ni (III)
5. Галогениды
Известны FeF3, FeCl3, FeBr3, CoF3, NiF3
2Fe + 3Cl2 = 2FeCl3
2Co + 3F2 = 2CoF3
Fe2O3 + 3C + 3Cl2 = 2FeCl3 + 3CO FeCl3 + 6H2O = [FeCl2(H2O)4]Cl·2H2O
CoF3 |
FeCl3 |

vk.com/club152685050 | vk.com/id446425943
Гидролиз соединений Fe(III)
1. Акваион [Fe(H2O)6]3+ бесцветен E e
g
d5 высокоспиновый комплекс
ЭСКП = 0
t2g
2. Соли Fe(III) интенсивно окрашены (красные, коричневые)
[Fe(H O) ]3+ |
+ H O [Fe(OH)(H O) ]2+ |
|
|
pK = 2.7 |
||||
2 |
6 |
2 |
|
2 |
5 |
|
|
|
2[Fe(OH)(H O) ]2+ |
[(H O) FeOFe(H O) ]4+ |
+ H |
O pK = 3.0 |
|||||
|
2 |
5 |
2 |
5 |
2 |
5 |
2 |
|
[Fe(H2O)6]Cl3 [FeCl2(H2O)4]Cl·2H2O
3. Гидролиз под действием производных слабых кислот
Fe2(SO4)3 + 3Na2S + 4H2O = 2FeOOH + 3Na2SO4 + 3H2S
Fe2(SO4)3 + 3Na2CO3 + H2O = 2FeOOH + 3Na2SO4 + 3CO2
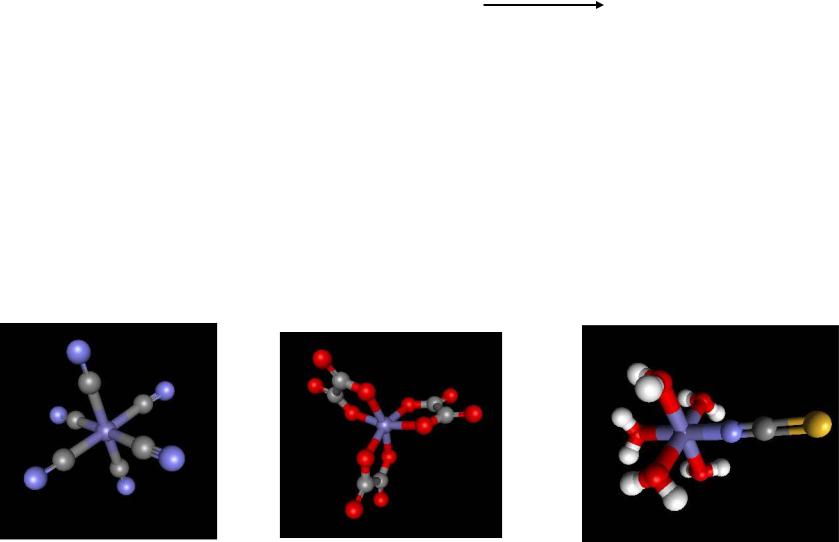
vk.com/club152685050 | vk.com/id446425943 |
|
|
|||
|
|
|
Комплексы Fe(III) |
|
|
1. |
Аммиакаты неустойчивы |
H2O |
|
||
|
FeBr3 + 6NH3 (газ) = [Fe(NH3)6]Br3 |
[Fe(H2O)6]Br3 |
|||
|
|
||||
2. |
Устойчивы комплексы с π-лигандами и хелатные |
||||
|
[Fe(H O) ]3+ |
+ SCN– = [FeSCN(H O) ]2+ |
красный |
||
|
2 |
6 |
2 |
5 |
|
Fe2(SO4)3 + 3K2C2O4 + 3BaC2O4 = 2K3[Fe(C2O4)3] + 3BaSO4
желтый
Fe2(SO4)3 + 3Ba(CN)2 + 6KCN = 2K3[Fe(CN)6] + 3BaSO4
красный
[FeSCN(H2O)5]2+
[Fe(CN)6]3– |
[Fe(ox) |
]3– |
|
3 |
|
vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
|
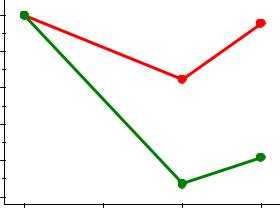
Восстановление соединений Fe(III) |
|
||||
1. Соединения Fe(III) – слабые окислители в кислой среде |
|||||
Fe2(SO4)3 + H2S = 2FeSO4 + H2SO4 + S |
|
|
|
||
Fe2(SO4)3 + SO2 + 2H2O = 2FeSO4 + 2H2SO4 |
|
|
|
||
2Fe2(SO4)3 + 2(NH3OH)HSO4 = 4FeSO4 + N2O + 4H2SO4 +H2O |
|||||
Fe2(SO4)3 + 2KI = 2FeSO4 + K2SO4 + I2 |
0.0 |
[Fe(H2O)6]n+ |
|
||
2. Влияние комплексообразования: |
|
||||
-0.5 |
|
|
|
||
E0(Fe3+/Fe2+) = 0.77 В |
|
-1.0 |
|
|
|
E0([Fe(CN) ]3–/[Fe(CN) ]2–) = 0.36 В nE |
-1.5 |
|
[Fe(CN)6]n– |
||
6 |
6 |
-2.0 |
|
|
|
E0([Fe(С2О4)3]3–/[Fe(С2О4)2]2–) = 0.02 В -2.5 |
1 |
2 |
3 |
||
K3[Fe(С2О4)3] + KI ≠ |
|
0 |
|||
|
|
|
n |
|
|
4K3[Fe(CN)6] + 4KOH (конц) = 4K4[Fe(CN)6] + 2H2O + O2 |
|
||||
vk.com/club152685050 | vk.com/id446425943
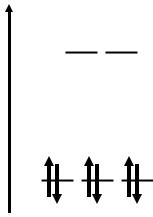
Комплексы Co(III)
1. Устойчивы низкоспиновые комплексы Co(III) с
лигандами сильного поля
исключение: [CoF6]3– высокоспиновый, t2g4eg2
4K3[CoF6] + 2H2O = 12KF + 4HF + 4CoF2 + O2
быстро
2. Аквакомплекс низкоспиновый [Co(H2O)6]3+ сине-зеленый
2Co2(SO4)3 + 2H2O = 4CoSO4 + 2H2SO4 + O2 медленно
E
eg
ЭСКП = 12/5 О
t2g |
μ = 0 |
vk.com/club152685050 | vk.com/id446425943
Комплексы Co(III)
3. Aммиакаты |
|
[Co(NH3)6]Cl3 |
желтый |
[CoCl(NH3)5]Cl2 |
красный |
[CoCl2(NH3)4]Cl |
2 изомера |
[CoCl3(NH3)3] |
2 изомера |
[Co(NH3)6]Cl3 + H2SO4 ≠
[Co(NH3)6]Cl3 + 3KI = [Co(NH3)6]I3↓ + 3KCl
[Co(NH3)6]Cl3 + 2SbF3 + 3KF = [Co(NH3)6](Sb2F9) + 3KCl
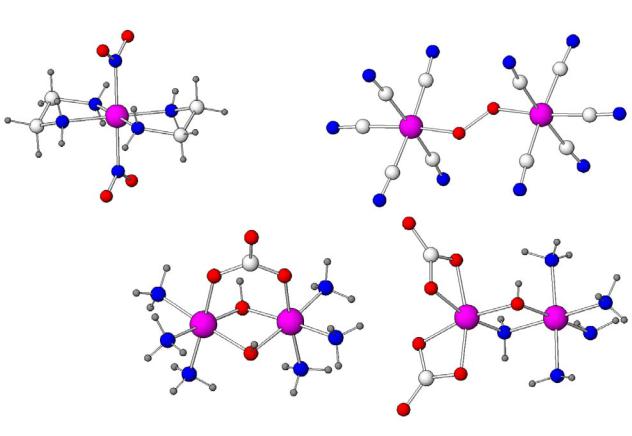
vk.com/club152685050 | vk.com/id446425943
Комплексы Co(III)
4. Хелатные и биядерные комплексы
CoCl2 + 3NaNO2 + 2HCl + 2en = [Co(NO2)2en2]Cl + 3NaCl + NO + H2O
2CoCl2 + O2 + 10KCN = K6[Co2(O2)(CN)10] + 4KCl
[Co(NO ) en ]+ |
[Co2(O2)(CN)10]6– |
|
2 2 |
2 |
|
[Co (OH) (CO )(NH ) ]2+ |
[Co2NH2OH(CO3)2(NH3)4] |
|||
2 |
2 |
3 |
3 6 |
|
|
|
|
|
|
vk.com/club152685050 | vk.com/id446425943
Галогениды Fe, Co, Ni (II)
FeF2 |
CoF2 |
NiF2 |
Т.пл. 1100 0С |
Т.пл. 1200 0С |
Т.пл. 1450 0С |
Белый |
Розовый |
Желто-зеленый |
TiO2 |
TiO2 |
TiO2 |
FeCl2 |
CoCl2 |
NiCl2 |
Т.пл. 674 0С |
Т.пл. 740 0С |
Т.возг. 970 0С |
Светло-желтый |
Синий |
Золотистый |
CdCl2 |
CdCl2 |
CdCl2 |
FeBr2 |
CoBr2 |
NiBr2 |
Т.пл. 688 0С |
Т.пл. 678 0С |
Т.возг. 919 0С |
Светло-зеленый |
Сине-зеленый |
Коричневый |
CdI2 |
CdI2 |
CdI2 |
FeI2 |
CoI2 |
NiI2 |
Т.пл. 594 0С |
Т.разл. 570 0С |
Т.пл. 797 0С |
Коричневый |
Черный |
Черный |
CdI2 |
CdI2 |
CdI2 |

vk.com/club152685050 | vk.com/id446425943
Оксиды Fe, Co, Ni (II)
|
|
FeO |
CoO |
NiO |
Цвет |
черный |
зеленый |
серо-зеленый |
|
Структура |
NaCl |
NaCl, ZnS |
NaCl |
|
Т.пл., оС |
1369 |
1805 |
1984 |
|
f |
H0 |
–265 |
–239 |
–240 |
298 |
|
|
|
|
кДж/моль |
|
|
|
|
Нестехиометрия: Fe1–xO |
0.05 < x < 0.16 |
|||
Только основные свойства |
FeO + 2HCl = FeCl2 + H2O |
|||||||
FeO, CoO окисляются при нагревании |
||||||||
6CoO + O |
2 |
= 2Co O |
4 |
(600 oC) |
||||
|
|
|
3 |
|
|
|
||
Получение: |
|
|
|
|
|
|
||
|
|
|
|
FeO |
|
|||
FeC O |
200 oC |
FeO + CO + CO |
|
|||||
|
|
|||||||
2 |
4 |
|
|
|
|
2 |
|
|
vk.com/club152685050 | vk.com/id446425943
Соединения Fe, Co, Ni (II)
1. Гидроксиды
преимущественно основные свойства Fe(OH)2 pKb = 3.9 Co(OH)2 pKb = 4.4 Ni(OH)2 pKb = 4.6
Ni(OH)2 + H2SO4 = NiSO4 + H2O Co(OH)2 + 2KOH (конц) = K2[Co(OH)4]
6Fe(OH)2 + O2 = 2Fe3O4 + 6H2O окисление |
||||
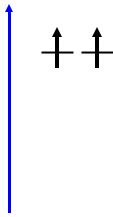
2. Оксиды Fe3O4, Co3O4 |
|
Co(OH)2 |
||
M3O4 ≡ M2O3·MO |
||||
обращенная (Fe3O4) и нормальная (Co3O4) шпинель |
||||
Fe O |
4 |
– ферромагнетик, T |
C |
= 630 oC |
3 |
|
|
||
Fe3O4 + 8HCl = FeCl2 + 2FeCl3 + 4H2O
Co3O4 + 8HCl = 3CoCl2 |
+ Cl2 + 4H2O |
||
6Co(NO3)3 |
to |
2Co3O4 |
+ 18NO2 + 5O2 Co3O4 |
|
|||
vk.com/club152685050 | vk.com/id446425943
Комплексы Fe, Co, Ni (II)
1. Стабильность аммиакатов увеличивается по ряду
Fe→Co→Ni FeCl2 (б/в) + 6NH3 = [Fe(NH3)6]Cl2
[Fe(NH3)6]Cl2 + 2H2O = Fe(OH)2 + 2NH4Cl + 4NH3
[Co(NH3)6]Cl2 + H2O ≠
Ni(OH)2 + 6NH3 = [Ni(NH3)6](OH)2
NiCl2 (р-р) + 6NH3 = [Ni(NH3)6]Cl2
E |
μ = 2.45 мБ |
eg |
Ni2+ ЭСКП = 6/5 О
 t2g
t2g
vk.com/club152685050 | vk.com/id446425943
Комплексы Fe, Co, Ni (II)
2. Тетраэдрические комплексы |
|
2CsCl + FeCl2 = Cs2[FeCl4] |
неустойчив |
NiBr2 + 2KBr = K2[NiBr4] |
устойчив |
3. Квадратные комплексы
NiCl2 + KCN = K2[Ni(CN)4] желтый
диамагнитный
(NH4)2Fe(SO4)2·6H2O
4. Октаэдрические комплексы
FeSO4 + (NH4)2SO4 = (NH4)2Fe(SO4)2·6H2O
5. Ферроцен
FeCl2 + 2Na(cp) = Fe(cp)2 + 2NaCl
Fe(cp)2
vk.com/club152685050 | vk.com/id446425943
Комплексы Fe, Co, Ni (II)
4. Комплексы с лигандами сильного поля
K4[Fe(CN)6] + O2 ≠
2K4[Fe(CN)6] + Cl2 = 2K3[Fe(CN)6] + 2KCl Co(CN)2 + 3KCN = K3[Co(CN)5] коричневый
2K3[Co(CN)5] hν K6[Co2(CN)10]
E
eg
Fe2+ |
d6 |
ЭСКП = 12/5 О |





 t2g μ = 0
t2g μ = 0
vk.com/club152685050 | vk.com/id446425943
Комплексы Fe, Co, Ni (II)
5. Окисление комплексов Co(II) |
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
[Co(H O) ]2+ |
+ O ≠ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
2 |
|
6 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[Co(NH ) ]2+ |
+ O |
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 6 |
2 |
|
|
||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[Co(NH ) ]3+ |
|
|
|
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t 5e 2 |
→ t |
|
|
|
|
3 6 |
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2g |
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
t |
6e |
1 → t |
6 |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2g |
g |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2g |
g |
|
2g |
||||
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
E |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
–e– |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
–e– |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Требуется |
Не требуется |
перестройка |
перестройка |
vk.com/club152685050 | vk.com/id446425943
Соединения Fe, Co, Ni (0)
1. Карбонилы
Ni + 4CO = Ni(CO) |
(35 oC) |
|
|
|
||||
|
4 |
|
(200 oC, 20 атм) |
|
|
|||
Fe + 5CO = Fe(CO) |
|
|
|
|||||
|
5 |
|
|
|
(150 oC, 35 атм) Правило 18 е– ! |
|||
2Co + 8CO = Co (CO) |
8 |
|
||||||
|
2 |
|
|
|
|
|
|
|
3Fe(CO)5 + 4NaOH = Na2[Fe3(CO)11] + Na2CO3 + 3CO + 2H2O |
||||||||
|
hν Fe (CO) |
|
Fe–2/3 |
|
|
|
||
Fe(CO) |
9 |
+ CO |
наиболее устойчив |
|
||||
5 |
2 |
|
|
|
|
|
|
|
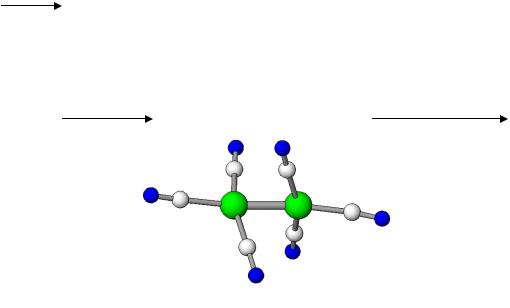
2. Цианиды |
K [Ni 1+(CN) ] K/NH3 (ж) |
|
|
|||||
K [Ni2+(CN) ] Na/Hg |
K [Ni0(CN) ] |
|||||||
2 |
4 |
|
4 |
2 |
6 |
4 |
4 |
|
[Ni2(CN)6]4–
vk.com/club152685050 | vk.com/id446425943
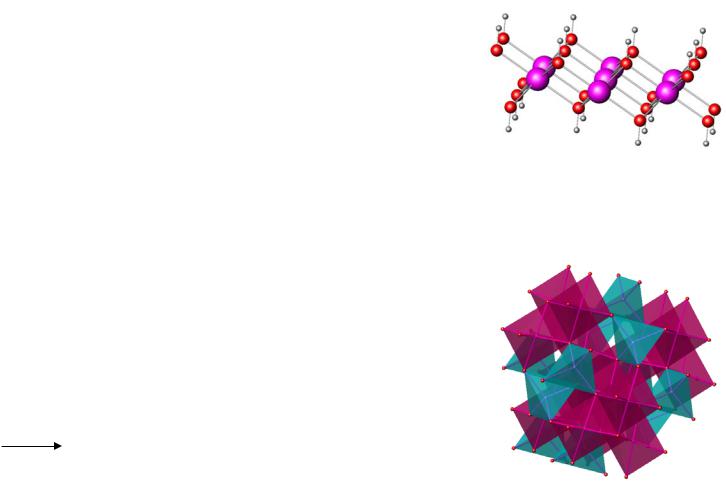
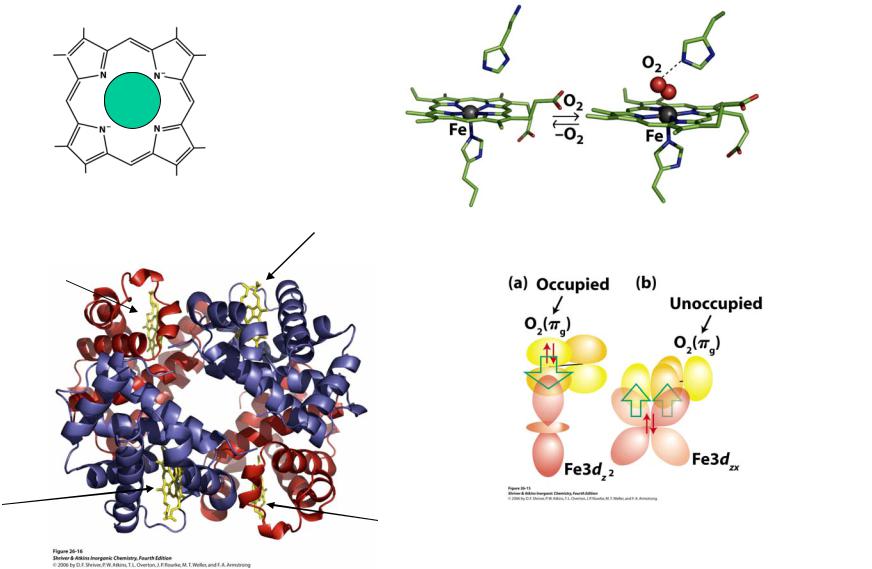
Биологическая роль Fe
1. Транспорт кислорода
Fe
Комплекс Fe(II) |
Обратимый перенос кислорода |
с порфирином |
|
|
Связывание |
|
|
синглетного кислорода |
Гемоглобин: 4 активных центра |
|
|
|
|
|
|
||
|
|
|
vk.com/club152685050 | vk.com/id446425943
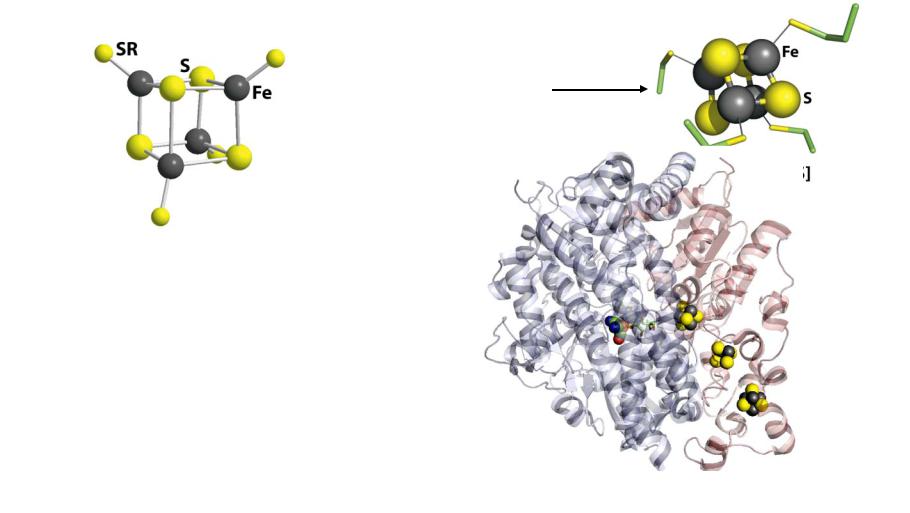
Биологическая роль Fe
2. Электрохимический транспорт: перенос энергии
Ферменты: пероксидаза, карбоксилаза, оксигеназа,
нитрогеназа, гидрогеназа
[Fe4S4]
ферредиксина
«Кубановый кластер»
[Fe4S4]2+ + e– = [Fe4S4]+
2Fe3+:2Fe2+ → Fe3+:3Fe2+
S = 0 |
S = ½ |
E0 = –0.2 … –0.7 В
Кубановые кластеры в гидрогеназе
vk.com/club152685050 | vk.com/id446425943
Элементы 13 группы
B – бор, Al – алюминий, Ga – галлий, In – индий, Tl – таллий
vk.com/club152685050 | vk.com/id446425943
Свойства элементов
|
|
B |
Al |
Ga |
In |
Tl |
Ат. Номер |
5 |
13 |
31 |
49 |
81 |
|
Эл. Конф. 2s22p1 |
3s23p1 |
3d104s24p1 |
4d105s25p1 |
4f145d106s26p1 |
||
Радиус (пм) |
85 |
126 |
141 |
166 |
171 |
|
I1 |
(эВ) |
8.30 |
5.97 |
6.00 |
5.79 |
6.11 |
I2 |
(эВ) |
25.15 |
18.83 |
20.51 |
18.87 |
20.43 |
I3 |
(эВ) |
37.93 |
28.45 |
30.71 |
28.03 |
29.83 |
Ae (эВ) |
0.28 |
0.44 |
0.30 |
0.30 |
– |
|
χP |
2.04 |
1.61 |
1.81 |
1.78 |
2.04 |
|
χAR |
2.01 |
1.47 |
1.82 |
1.49 |
1.44 |
|
С.О. |
0,3 |
0,3 |
0,(1),3 |
0,1,3 |
0,1,(3) |
|
vk.com/club152685050 | vk.com/id446425943
Свойства элементов
|
B |
Al |
Ga |
In |
Tl |
|
Ат. Номер |
5 |
13 |
31 |
49 |
81 |
|
Эл. Конф. 2s22p1 |
3s23p1 |
3d104s24p1 |
4d105s25p1 |
4f145d106s26p1 |
||
Радиус (пм) |
85 |
126 |
141 |
166 |
171 |
|
I1 (эВ) |
8.30 |
5.97 |
6.00 |
5.79 |
6.11 |
|
I2 (эВ)1,8 |
|
25.15 |
18.83 |
20.51 |
18.87 |
|
20.43 |
||
|
|
|
|
R, Å |
|
8,5 |
I1 (эВ) |
|
|
|
|
1,6 |
|
37.93 |
28.45 |
30.718,0 |
28.03 |
|
29.83 |
I3 (эВ) |
|
|
|||||||
|
|
1,4 |
|
|
|
7,5 |
|
|
|
|
|
|
0.28 |
0.44 |
0.30 |
0.30 |
|
– |
|
Ae (эВ) |
|
|
|||||||
|
|
1,2 |
|
|
|
7,0 |
|
|
|
χP |
|
2.04 |
1.61 |
1.81 |
1.78 |
|
2.04 |
||
|
|
|
|||||||
|
|
1,0 |
|
|
|
6,5 |
|
|
|
χ |
AR |
|
2.01 |
1.47 |
6,0 |
1.49 |
|
1.44 |
|
|
|
|
|||||||
|
0,8 |
|
1.82 |
|
|||||
С.О. |
|
200,3 40 |
600,3 80 |
5,5 |
200,1,340 |
|
0,1,(3)80 |
||
|
|
|
|||||||
|
0 |
0,(1),3 0 |
60 |
||||||
vk.com/club152685050 | vk.com/id446425943
Свойства элементов
|
|
B |
Al |
Ga |
In |
Tl |
Ат. Номер |
5 |
13 |
31 |
49 |
81 |
|
Эл. Конф. 2s22p1 |
3s23p1 |
3d104s24p1 |
4d105s25p1 |
4f145d106s26p1 |
||
Радиус (пм) |
85 |
126 |
141 |
166 |
171 |
|
I1 |
(эВ) |
8.30 |
5.97 |
6.00 |
5.79 |
6.11 |
I2 |
(эВ) |
25.15 |
18.83 |
20.51 |
18.87 |
20.43 |
I3 |
(эВ) |
37.93 |
28.45 |
30.71 |
28.03 |
29.83 |
Ae (эВ) |
0.28 |
0.44 |
0.30 |
0.30 |
– |
|
χP |
2.04 |
1.61 |
1.81 |
1.78 |
2.04 |
|
χAR |
2.01 |
1.47 |
1.82 |
1.49 |
1.44 |
|
С.О. |
0,3 |
0,3 |
0,(1),3 |
0,1,3 |
0,1,(3) |
|
vk.com/club152685050 | vk.com/id446425943
Свойства элементов
Ат. Номер Эл. Конф. Радиус (пм) I1 (эВ)
I2 (эВ)
I3 (эВ) Ae (эВ)
B |
|
|
Al |
|
Ga |
|
|
In |
|
|
|
|
Tl |
|
|
|
|
||
5 |
2,1 |
|
13 |
|
31 |
|
|
49 |
|
|
|
|
81 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
2s |
2 |
1 |
2,0 |
|
2 |
1 |
10 |
2 |
P1 |
10 |
2 |
1 |
4f |
14 |
10 |
6s |
2 |
6p |
1 |
|
|||||||||||||||||||
|
2p |
3s 3p |
|
3d 4s |
|
4pχ |
4d 5s |
|
5p |
|
5d |
|
|
||||||
|
|
|
1,9 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
85 |
126 |
141 |
166 |
171 |
|
1,8 |
|
|
|
8.30 |
1,61,7 5.97 |
6.00 |
5.79 |
6.11 |
25.15 |
1,518.83 |
20.51 |
χAR |
20.43 |
18.87 |
|
1,4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
37.93 |
28.45 |
|
|
|
|
30.71 |
|
|
|
|
28.03 |
29.83 |
||
|
|
|
|
|
|
|
||||||||
20 |
|
60 |
80 |
|||||||||||
|
0 |
40 |
|
|
||||||||||
0.28 |
0.44 |
|
|
0.30 |
|
|
0.30 |
– |
||||||
χP |
2.04 |
1.61 |
1.81 |
1.78 |
2.04 |
χAR |
2.01 |
1.47 |
1.82 |
1.49 |
1.44 |
С.О. |
0,3 |
0,3 |
0,(1),3 |
0,1,3 |
0,1,(3) |
vk.com/club152685050 | vk.com/id446425943
Свойства бора
1.Единственный неметалл в 13 группе
2.Очень высокие т.пл. (2573 оС) и т.кип. (3660 оС)
3.d = 2.35 г/см3 – черный, кристаллический бор d = 1.73 г/см3 – коричневый, аморфный бор
4.Кристаллический бор очень твердый
(9.5 по шкале Мооса)
5.Кристаллический бор – полупроводник, Еg = 1.55 эВ
6.Бор имеет 2 стабильных изотопа 10В, 11В
105В + 10n = 42He + 73Li замедление нейтронов
7. Бор – восстановитель, Е0(Н3ВО3/В) = -0.87 В
vk.com/club152685050 | vk.com/id446425943
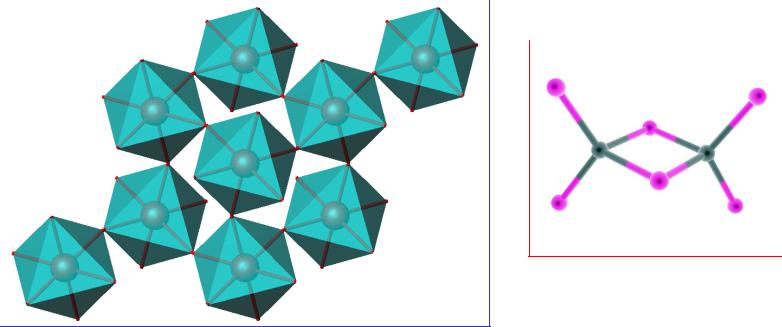
Строение бора
В основе кристаллического строения бора лежит
икосаэдр В12
d(B-B) = 173 пм
в икосаэдре В12
d(B-B) = 202 пм |
Новая форма – ионный бор |
между икосаэдрами В12 |
высокого давления (В2 + В12) |
vk.com/club152685050 | vk.com/id446425943
Строение бора
vk.com/club152685050 | vk.com/id446425943
Строение бора
vk.com/club152685050 | vk.com/id446425943
Химические свойства бора
1. Бор химически инертен. Не реагирует с водой,
кислотами и щелочами при н.у.
2. При нагревании реагирует с неметаллами
4B |
+ 3O = 2B O |
3 |
700 oC |
||
2B |
2 |
2 |
800 oC |
||
+ 3Cl |
2 |
= 2BCl |
|
||
|
|
3 |
|
||
2B |
+ N2 = 2BN |
|
900 oC |
||
3. При Т>1000 оС реагирует со многими
металлами и оксидами
2B + Al = AlB2
10B + 2P2O5 = P4 + 5B2O3
2B + 3H2O = 3H2 + B2O3
4. Окисляется кислотами-окислителями и в щелочных расплавах
B + 3HNO3 (конц) = H3BO3 + 3NO2 100 oC
2B + KClO3 + 2KOH = 2KBO2 + KCl + H2O
vk.com/club152685050 | vk.com/id446425943
Получение бора
Бор встречается в виде оксидных минералов
Na2B4O7·10H2O бура Na2B4O7·4H2O кернит
MgCaB6O11·6H2O гидроборацит
Получение аморфного бора
1) MgCaB6O11·6H2O + 4HCl + H2O = 6H3BO3 + CaCl2 + MgCl2
to
2H3BO3  B2O3 + 3H2O B2O3 + 3Mg = 3MgO + 2B
B2O3 + 3H2O B2O3 + 3Mg = 3MgO + 2B
2) Na2B4O7 + 3Mg = 2NaBO2 + 3MgO + 2B
Получение кристаллического бора
2BBr3 + 3H2 = 6HBr + 2B
vk.com/club152685050 | vk.com/id446425943
Диборан
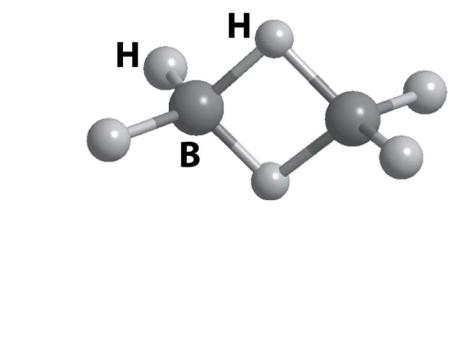
1.BH3 крайне неустойчив. Простейший боргидрид – B2H6
MgB2 + 2Mg + 6HCl = 3MgCl2 + B2H6 2BF3 + 6NaH = 6NaF+ B2H6
2.Гидролиз, окисление B2H6
B2H6 + 6H2O = 2H3BO3 + 6H2 B2H6 + 3O2 = 2H3BO3
3. Строение B2H6
B–H |
B–H–B |
|
|
4 связи |
2 связи |
В: sp3 |
– гибридные орбитали |
|
|
||
2c-2e |
3c-2e |
Всего 12е–: электрон- |
|
|
|
||
|
|
||
дефицитное соединение
vk.com/club152685050 | vk.com/id446425943
Свойства диборана
H3B-CO
(HBNH)3
боразол
B2H5Cl + H2
N |
|
CO |
|
|
|
|
|
p, t |
|
|
|
||
|
H |
|
|
|
||
|
|
|
o |
H |
|
|
|
|
3 |
|
|
||
t |
|
|
|
i |
|
|
|
|
|
L |
|
|
|
o |
|
|
|
O |
||
|
|
|
|
|
t |
|
|
|
|
|
E |
|
|
|
|
|
|
|
2 |
|
|
|
|
B2H6 |
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
|
|
|
|
l |
|
|
/H |
|
|
|
|
|
|
g |
|
|
C |
CH |
|
|
||
H |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
OH |
|
|
|
B(OCH3)3 + H2
LiBH4
NaBH4 + NaB3H8 + …
vk.com/club152685050 | vk.com/id446425943
Тетрагидробораты
1. Получение
B2H6 + 2LiH = 2Li[BH4]
2. Na[BH4] растворим в воде, Li[BH4] – гидролизуется
Li[BH4] + 2H2O = 4H2 + LiBO2 |
– |
|
BH4 |
3.Восстановительные свойства
Li[BH4] + 2I2 = BI3 + LiI + 2H2 Li[BH4] + GeCl4 = GeH4 + BCl3 + LiCl
4Li[BH4] + 9H2O = Li2B4O7 + 16H2 + 2LiOH
4.Другие гидробораты
Na[B3H8], K[B9H14], K[B11H14]
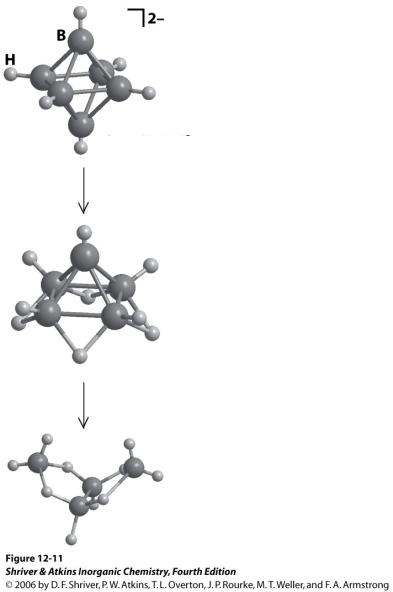
vk.com/club152685050 | vk.com/id446425943
Ряды боргидридов
BnHn2– анионный ряд
B6H62–, B12H122–, …
Клозо- B6H62–
BnHn+4 непредельный ряд
Штока
B2H6, B5H9, … Нидо-B5H9
BnHn+6 предельный ряд Штока
B4H10, B5H11, …
Клозо-кластер
26е– – 6×(B-H)
7 СЭП n+1
-BH +4H
-2e– Нидо-кластер
24е– – 5×(B-H)
7 СЭП n+2
-BH
+2H Арахно-кластер
22е– – 4×(B-H)
7 СЭП n+3
Арахно-B4H10
vk.com/club152685050 | vk.com/id446425943
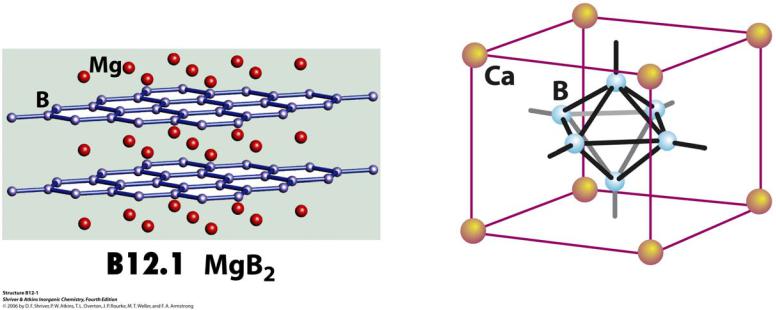
Бориды
1.Образуются большинством металлов
2.Бориды d-металлов тугоплавки, часто нестехиометричны
т.пл. (ZrB) = 2996 оС
3.Получаются прямым взаимодействием при высокой to
4.По кристаллическому строению делятся на 2 группы
-Образованные внедрением атомов B в структуру металла
-Содержащие кластеры В
|
|
|
|
|
|
CaB6 |
|
|
|
|
MgB2 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
Галогениды бора
|
|
|
|
BF3 |
BCl3 |
BBr3 |
BI3 |
Т.пл., оС |
-128 |
-107 |
-46 |
50 |
|||
Т.кип., оС |
-100 |
13 |
90 |
210 |
|||
f |
Ho |
|
(г) |
-1104 |
-407 |
-208 |
-38 |
298 |
|
|
|
|
|
||
кДж/моль |
|
|
|
|
|||
f |
Go |
298 |
(г) |
-1112 |
-339 |
-232 |
+21 |
кДж/моль |
|
|
|
|
|||
d(B-X), пм |
130 |
174 |
188 |
210 |
|||
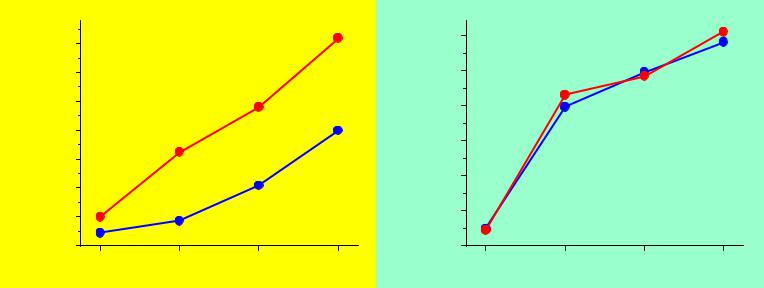
BX3
Плоская молекула
(X-B-X) = 120o
vk.com/club152685050 | vk.com/id446425943
Галогениды бора
|
|
|
|
BF3 |
BCl3 |
BBr3 |
BI3 |
Т.пл., оС |
-128 |
-107 |
-46 |
50 |
|||
Т.кип., оС |
-100 |
13 |
90 |
210 |
|||
|
|
|
|
|
|
|
|
f |
Ho |
|
(г) |
-1104 |
-407 |
-208 |
-38 |
298 |
|
|
|
|
|
||
кДж/моль |
|
|
|
|
|||
f |
Go |
298 |
(г) |
-1112 |
-339 |
-232 |
+21 |
кДж/моль |
|
|
|
|
|
|
|
|
|
|
|
|
|
200 |
to, C |
130 |
|
|
|
174 |
0 |
кДж/моль |
|
|
210 |
||
d(B-X), пм |
|
|
|
-200 |
|
188 |
|
|
|||||
150 |
|
|
|
|
|
|
|
|
|
|
|
|
|
100 |
|
т.кип. |
|
|
|
|
-400 |
|
|
|
Go |
|
|
50 |
|
|
|
|
|
|
|
f |
|
||||
|
|
|
|
|
|
|
-600 |
|
|
298 |
|
||
0 |
|
|
|
|
|
|
|
|
|
fHo298 |
|
||
|
|
|
|
|
|
|
-800BX3 |
|
|
||||
-50 |
|
|
|
т.пл. |
|
|
|
||||||
-100 |
|
|
|
-1000 |
|
|
|
|
|
||||
|
|
|
|
|
|
-1200Плоская молекула |
|||||||
-150 |
|
|
|
|
|
|
|||||||
|
BF |
BCl |
3 |
BBr |
3 |
BI |
|
BF |
BCl |
BBr3 o |
BI3 |
||
|
3 |
|
|
3 |
|
|
(X3-B-X)3 = 120 |
|
|||||
vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
||||||
|
|
|
|
Галогениды бора |
|
|
||||
|
|
|
|
BF3 |
|
|
BCl3 |
|
BBr3 |
BI3 |
Т.пл., оС |
-128 |
|
|
-107 |
|
-46 |
50 |
|||
Т.кип., оС |
-100 |
2 .2 |
d(B-X), Å |
|
90 |
210 |
||||
2 .0 |
|
13 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
f |
Ho |
|
(г) |
-11041 .8 |
|
-407 |
|
-208 |
-38 |
|
298 |
|
|
|
|
|
|
|
|
||
кДж/моль |
|
1 .6 |
|
|
|
|
|
|||
f |
Go |
298 |
(г) |
-11121 .4 |
|
-339 |
|
-232 |
+21 |
|
|
|
|
1 .2 |
|
|
|
|
|
||
кДж/моль |
|
BF3 |
BCl3 |
BBr3 |
BI3 |
|
||||
|
|
|
||||||||
d(B-X), пм |
130 |
|
|
174 |
|
188 |
210 |
|||
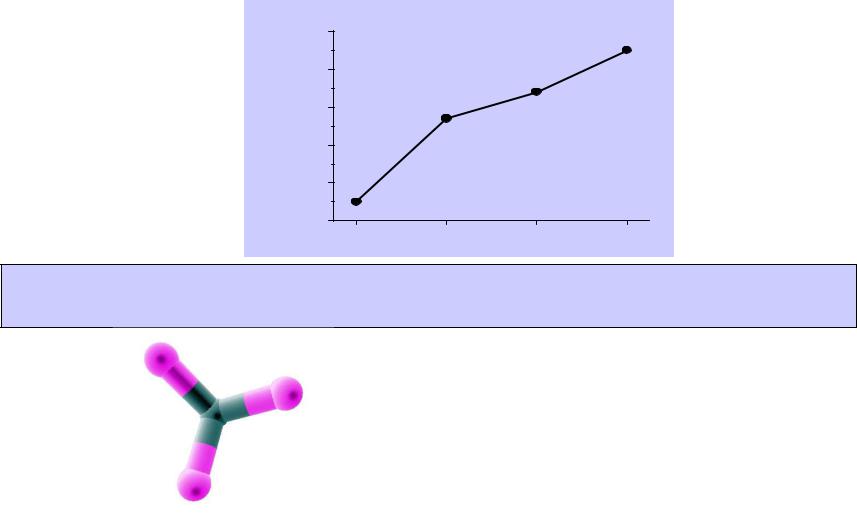
BX3
Плоская молекула
(X-B-X) = 120o
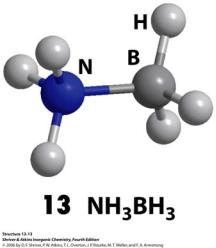
vk.com/club152685050 | vk.com/id446425943
Галогениды бора
1. |
Получение |
|
|
|
|
|
|
B2O3 |
+ 3CaF2 + 3H2SO4 = 2BF3↑ + 3CaSO4 + 3H2O |
||||
|
B2O3 |
+ 3C + 3Cl2 = 2BCl3↑ + CO |
|
|||
|
BF3 + AlBr3 = BBr3 + AlF3 |
|
|
|||
|
Na[BH4] + 2I2 = BI3 + NaI + 2H2 |
|
||||
2. |
Гидролиз |
|
|
|
|
|
|
BCl3 + 3H2O = H3BO3 + 3HCl |
|
|
|||
|
4BF + 3H O = H BO + 3HBF |
4 |
NH3BH3 |
|||
|
3 |
2 |
3 |
3 |
|
|
3. |
Реакции с основаниями Льюиса |
|
|
|||
BF3 (газ) + NH3 (газ) = F3B–NH3 (тв)
трифторборазан
vk.com/club152685050 | vk.com/id446425943
Галогениды бора
4. Тетрафтороборная кислота HBF4 |
BF4– |
Существует только в растворе |
|
сильная кислота pKa = −0.2 |
|
Соли – тетрафторобораты.
Устойчивы, хорошо растворимы, не гидролизуются
5. Другие галогениды бора
B2F4, B2Cl4, B2Br4, B2I4, B4Cl4 – все легко диспропорционируют
vk.com/club152685050 | vk.com/id446425943
Кислородные соединения бора
1. Оксид бора B O |
3 |
т.пл. 577 оС, т.кип. 1860 оС |
||
2 |
G0 |
|
= -1193.7 кДж/моль |
|
|
|
298 |
||
|
|
f |
|
|
ангидрид борной кислоты, легко переходит в аморфное состояние (стекло)
B2O3 + 3H2O = 2H3BO3
2. Ортоборная кислота H3BO3
твердое белое вещество растворимое в воде ( 15% при н.у.) одноосновная кислота
H |
BO |
+ H O H+ + [B(OH) ]– |
pKa = 9.2 |
|
3 |
3 |
2 |
4 |
|
vk.com/club152685050 | vk.com/id446425943
Кислородные соединения бора
3. Тетраборная кислота H2B4O7
Твердое белое вещество, хорошо растворимо в воде двухосновная кислота pKa1 = 4.1; pKa2 = 5.1
образуются только двухзамещенные соли
H3BO3 to HBO2 to H2B4O7 to B2O3
4. Эфиры борной кислоты
окрашивают пламя в зеленый цвет
B(OCH3)3
H3BO3 + 3CH3OH H2SO4 B(OCH3)3 + H2O
vk.com/club152685050 | vk.com/id446425943
Кислородные соединения бора
5. Бораты (в растворе только тетрабораты)
4H3BO3 + 2NaOH = Na2B4O7
Na2B4O7 + 7H2O = 4H3BO3 + 2NaOH гидролиз
Na2B4O7 + 2HCl + 5H2O = 4H3BO3↓ + 2NaCl
3Na2CO3(тв) + 2H3BO3(тв) to 2Na3BO3 + 3H2O + 3CO2
Na2B4O7 + CoO |
to |
Co(BO2)2 + 2NaBO2 |
|
|
перлы буры |
|
to |
2B2O3 + 2Na2O2 |
4NaBO2 + O2 |
vk.com/club152685050 | vk.com/id446425943
Борат-анионы
к.ч. = 3 |
sp2 |
d(B-O) = 136 пм |
BO33– Na3BO3
B2O54– Mg2B2O5
к.ч. = 4 sp3 d(B-O) = 148 пм
B(OH)4– H3BO3
B3O63– NaBO2
к.ч. = 3, 4 sp2, sp3
B4O5(OH)42– Na2[B4O5(OH)4]·8H2O (Na2B4O7·10H2O)
vk.com/club152685050 | vk.com/id446425943
Соединения бора с азотом
Нитрид бора |
|
α-BN структура графита |
β-BN структура алмаза |
|
|
α-BN |
1350 oC |
β-BN |
|
|
|
|
|
|
|
|
|
||
|
|
α-BN |
|
|
|
|
β-BN |
|
|
|
|
|
|
|
|
B2O3 (ж) + 2NH3 (г) |
1200 oC |
2α-BN + 3H2O |
|||||
|
|
||||||
4F B-NH |
3 |
(тв) |
400 oC |
α-BN + 3NH BF |
4 |
||
3 |
|
|
|
|
4 |
||
|
|
to |
|
2β-BN + 3H2 |
|
|
|
2B + 2NH3 |
|
|
|
||||
vk.com/club152685050 | vk.com/id446425943
Соединения бора с азотом
3B2H6 + 6NH3 = 2B3N3H6 + 12H2 боразол
B3N3H6 + 3HCl = B3N3H9Cl3
 δ+
δ+  δ–
δ–
|
|
Аналог |
|
Ароматичность ! |
|
|
|
|
|
трихлорциклогексана |
|
|
|
|
|
H3B–NH3 |
H2B=NH2 |
HB≡NH |
|
боразан |
боразен |
боразин |
|
sp3 |
sp2 |
sp |
|
Увеличение энергии связи B–N
vk.com/club152685050 | vk.com/id446425943
Свойства простых веществ
Т.пл. (оС)
Т.кип. (оС)
атH0298
кДж/моль
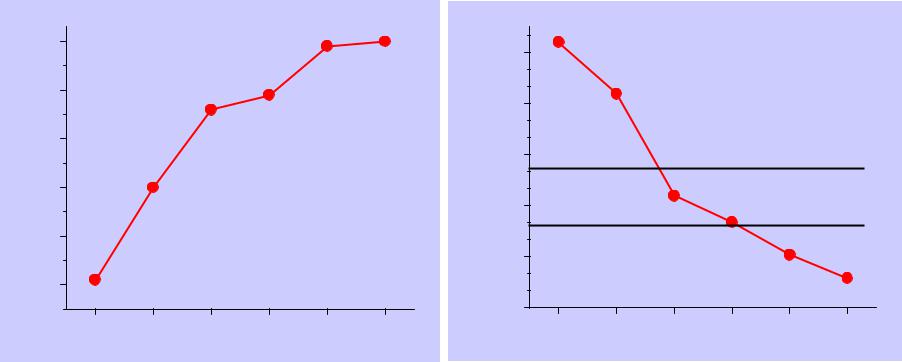
Е(М3+/М), В
Е(М1+/М), В
d, г/см3
B |
Al |
Ga |
In |
Tl |
2092 |
660 |
30 |
157 |
303 |
3660 |
2519 |
2204 |
2073 |
1473 |
560 |
330 |
286 |
243 |
182 |
-0.89 |
-1.68 |
-0.55 |
-0.34 |
+0.72 |
|
|
-0.8 |
-0.18 |
-0.34 |
2.35 |
2.70 |
5.90 |
7.31 |
11.85 |
vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
|
|||
|
Свойства простых веществ |
|
||||||
|
B |
|
Al |
|
Ga |
|
In |
Tl |
Т.пл. (оС) |
2092 |
|
660 |
|
30 |
|
157 |
303 |
Т.кип. (оС) |
3660 |
2500 |
2519 |
2204 |
|
2073 |
1473 |
|
|
|
|
|
Т.пл., оС |
|
|
|
|
атH0298 |
560 |
2000 |
330 |
|
286 |
|
243 |
182 |
кДж/моль |
|
1500 |
|
|
|
|
|
|
Е(М3+/М), В |
-0.89 |
1000 |
-1.68 |
|
-0.55 |
|
-0.34 |
+0.72 |
Е(М1+/М), В |
|
500 |
|
|
-0.8 |
|
-0.18 |
-0.34 |
|
0 |
|
|
|
||||
d, г/см3 |
2.35 |
2.70 |
|
5.90 |
|
7.31 |
11.85 |
|
|
20 |
60 |
||||||
|
|
|
0 |
40 |
80 |
|
||

vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
|
|
|||||
|
|
Свойства простых веществ |
|
||||||||
|
|
|
1,0 |
|
Е(М3+/М), В |
|
|
|
|
||
|
|
B |
0,5 |
|
Al |
|
|
Ga |
|
In |
Tl |
|
|
0,0 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
Т.пл. (оС) |
2092 |
-0,5 |
|
660 |
|
|
30 |
|
157 |
303 |
|
Т.кип. (оС) |
3660 |
-1,0 |
|
2519 |
2204 |
|
2073 |
1473 |
|||
-1,5 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
ат |
H0 |
560 |
-2,0 |
0 |
330 |
20 |
286 |
80 |
243 |
182 |
|
298 |
|
|
|
40 |
60 |
|
|
||||
кДж/моль |
|
|
|
|
|
|
|
|
|
|
|
Е(М3+/М), В |
-0.89 |
|
-1.68 |
-0.55 |
|
-0.34 |
+0.72 |
||||
Е(М1+/М), В |
|
|
|
|
|
-0.8 |
|
-0.18 |
-0.34 |
||
d, г/см3 |
2.35 |
|
2.70 |
|
5.90 |
|
7.31 |
11.85 |
|||
vk.com/club152685050 | vk.com/id446425943
Свойства простых веществ
Т.пл. (оС)
Т.кип. (оС)
атH0298
кДж/моль
Е(М3+/М), В
Е(М1+/М), В
d, г/см3
B |
Al |
Ga |
In |
Tl |
2092 |
660 |
30 |
157 |
303 |
3660 |
2519 |
2204 |
2073 |
1473 |
560 |
330 |
286 |
243 |
182 |
-0.89 |
-1.68 |
-0.55 |
-0.34 |
+0.72 |
|
|
-0.8 |
-0.18 |
-0.34 |
2.35 |
2.70 |
5.90 |
7.31 |
11.85 |
vk.com/club152685050 | vk.com/id446425943
Строение простых веществ
Al –
плотнейшая кубическая решетка типа меди,
к.ч.=14
Ga –
сложная структура, d(Ga–Ga) = 247 пм
[+270+274+279 (×2)]
In –
тетрагональная решетка,
искажение структуры железа, к.ч.=12
Tl –
гексагональная структура типа магния, к.ч.=12
vk.com/club152685050 | vk.com/id446425943
Химические свойства Al, Ga, In, Tl
1. Все металлы растворимы в кислотах-неокислителях
2Al + 6HCl = 2AlCl3 + 3H2 |
|
|
|
Al3+ |
|||
2In + 3H SO |
= In (SO ) + 3H |
2 |
In3+ |
||||
2 |
4 |
2 |
4 3 |
|
|
||
2Tl + 2CH COOH = 2TlCH COO + H Tl1+ |
|||||||
|
3 |
|
|
3 |
|
|
2 |
2. Только Al пассивируется концентрированной HNO3 |
|||||||
3. Al, Ga, In растворимы в щелочах |
|
|
|
||||
2Ga + 2KOH + 10H2O = 2K[Ga(OH)4(H2O)] + 3H2 |
|||||||
4. Только Al реагирует с водой |
|
|
|
|
|||
2Al + 6H2O = 2Al(OH)3 + 3H2 |
|
|
|
||||
5. Реагируют с неметаллами |
|
|
|
|
|||
4Al + 3O |
= 2Al O |
|
H0 |
298 |
= -1676 кДж/моль |
||
2 |
|
2 3 |
|
f |
|
|
|
2Tl + S = Tl2S |
|
|
2Tl + 3Cl2 = 2TlCl3 |
||||

vk.com/club152685050 | vk.com/id446425943
Получение Al
Al – самый распространенный на Земле металл 8.5 массовых процентов в земной коре
Основные минералы: бокситы Al2O3·nH2O корунд Al2O3
каолинит Al2O3·SiO2·2H2O
криолит Na3AlF6
Основной метод получения: Электролиз Al2O3 в расплаве Na3AlF6
vk.com/club152685050 | vk.com/id446425943
Получение Al
Электролиз Al2O3 в расплаве Na3AlF6 с графитовым электродом
Основной катодный процесс: Al3+ + 3e = Al |
|
|
Основной анодный процесс: 2O2- - 4e + C = CO2 |
|
|
Химические реакции: |
|
|
Al2O3= 2Al + 1,5 O2 |
|
(1) |
C + O2 = CO2 |
|
(2) |
Суммарная:Al2O3 + 1,5C = 2Al + 1,5 CO2 |
(3) |
|
C + CO2 = 2CO |
|
(4) |
2Al+AlF3 = 3AlF |
Alраств. |
|
Al + 3NaF = AlF3 + 3Na (Al) Обратная: Al раств.+ CO2 = Al2O3 + CO
vk.com/club152685050 | vk.com/id446425943
Применение Al
Al
фольга |
сплавы |
химическая |
провода |
керамика |
|
|
аппаратура |
|
|
|
дюраль, |
|
|
|
медицина, |
авиаль, |
|
электротехника |
|
в быту |
силумин |
|
|
тигли, |
|
|
|
|
|
|
|
|
|
огнеупоры, |
|
авиация, |
|
|
катализ |
|
|
|
|
|
|
автомобили, |
|
|
|
|
космос |
|
|
|

vk.com/club152685050 | vk.com/id446425943
Получение и применение Ga, In, Tl
Ga, In, Tl своих значимых минералов не имеют
Ga, In – из отходов производства Al или Zn
Tl – сопутствует свинцу в сульфидных рудах
Ga, In, Tl получают электролизом водных растворов солей,
очищают переплавкой в инертной атмосфере
Ga, In применяют:
1.В качестве жидкой эвтектики или в составе легкоплавких сплавов
2.В полупроводниковой технике в виде GaN, GaP, GaAs, InP, InAs
Tl практически не применяется ввиду высокой
токсичности
vk.com/club152685050 | vk.com/id446425943
Соединения Al, Ga, In, Tl с водородом
1. |
Получение |
|
|
Et2O |
Li[AlH4] + 3LiCl |
|
4LiH + AlCl3 |
|
|
2Li[AlH4] + H2SO4 = 2AlH3 + 2H2 + Li2SO4 |
|
|
полимер |
|
2. |
Гидриды In, Tl неустойчивы |
|
NH3AlH3
N |
MC |
|
|
H |
|
4 |
|
C |
|
l |
|
Li[Al(NH2)4] NH3 Li[AlH4]
MH
l
C2H2 Li[AlH(CH=CH2)3]
|
H |
R |
O |
|
H
2 O
Li[AlH(OR)3] Al(OH)3
vk.com/club152685050 | vk.com/id446425943
Тригалогениды Al, Ga, In, Tl
AlF3 |
AlCl3 |
AlBr3 |
AlI3 |
т.пл. 1290оС |
т.пл. 193оС |
т.пл. 98оС |
т.пл. 190оС |
к.ч. = 6 |
к.ч. = 6 |
к.ч. = 4 |
к.ч. = 4 |
GaF3 |
GaCl3 |
GaBr3 |
GaI3 |
т.пл. 1015оС |
т.пл. 78оС |
т.пл. 122оС |
т.пл. 215оС |
к.ч. = 6 |
к.ч. = 4 |
к.ч. = 4 |
к.ч. = 4 |
InF3 |
InCl3 |
InBr3 |
InI3 |
т.пл. 1170оС |
т.разл. 586оС |
т.разл. 420оС |
т.разл. 207оС |
к.ч. = 6 |
к.ч. = 6 |
к.ч. = 6 |
к.ч. = 4 |
TlF3 |
TlCl3 |
TlBr3 |
TlI3 |
т.пл. 550оС |
т.разл. 153оС |
— |
— |
к.ч. = 6 |
к.ч. = 6 |
к.ч. = 6 |
Tl(I3) |
vk.com/club152685050 | vk.com/id446425943
Тригалогениды Al, Ga, In, Tl
AlF3 |
AlCl3 |
AlBr3 |
AlI3 |
||||
т.пл. 1290оС |
т.пл. 193оС |
т.пл. 98оС |
т.пл. 190оС |
||||
|
|
|
= 4 |
к.ч. = 4 |
|||
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
GaBr |
|
GaI3 |
|
|
|
|
|
. |
|
т.пл. 215о |
|
С |
|
|
|
|
ч. |
|
к.ч. = 4 |
|
|
|
|
InBr3 |
Al2Cl6 InI3 |
|
|
||
|
|
|
|||||
|
AlF |
разл. 420оС т.разл. 207оС |
|||||
|
3 |
ч. = 6 |
к.ч. = 4 |
||||
TlF3 |
|
||||||
TlCl3 |
TlBr3 |
TlI3 |
|||||
т.пл. 550оС |
т.разл. 153оС |
— |
— |
||||
к.ч. = 6 |
к.ч. = 6 |
к.ч. = 6 |
Tl(I3) |
||||
vk.com/club152685050 | vk.com/id446425943
Получение и свойства МХ3
1. Все МХ3 (кроме TlCl3, TlBr3, TlI3) синтезируют прямым взаимодействием или галогенированием оксидов
2In + 3Cl2 = 2InCl3 400 oC
Al2O3 + 3C + 3Cl2 = 2AlCl3 + 3CO600 oC
2. Получение TlCl3, TlBr3, TlI3 TlCl + 2NOCl = TlCl3 + 2NO
TlNO3 + I2 + HI = Tl(I3) + HNO3
3. Все МХ3 (кроме MF3) растворимы в полярных
растворителях

vk.com/club152685050 | vk.com/id446425943
Получение и свойства МХ3
4. MX3 не гидролизуются нацело, образуют гидраты, комплексы
AlCl3 + 6H2O = AlCl3·6H2O [Al(H2O)6]3+ + 3Cl–
K3[InCl6] 3K+ + [InCl6]3–
AlCl |
3 |
+ Cl– |
THF |
AlCl |
– |
O |
|
THF |
|||||||
|
|
|
4 |
|
5. TlX3 – сильные окислители
2TlCl3 + 3Na2S = Tl2S + 2S + 6NaCl TlCl3 + 2FeCl2 = 2FeCl3 + TlCl

vk.com/club152685050 | vk.com/id446425943
Получение и свойства МХ3
6. TlX3 легко разлагаются при нагревании
TlCl |
= TlCl + Cl |
2 |
|
153 oC |
|||
3 |
|
|
|
|
|
|
|
2TlBr |
3 |
= Tl Br |
4 |
+ Br |
2 |
40 oC |
|
|
2 |
|
|
|
|||
7. Комплексы Ga, In, Tl разлагаются при нагревании
to InN + 2NH3 + 6HF
(NH4)3GaF6 |
to |
GaF3 + 3NH4F |
|
(NH4)3InCl6 |
to |
(NH4)2InCl5 + NH4Cl |
InCl52– |
|
|

vk.com/club152685050 | vk.com/id446425943
Низшие галогениды Ga, In, Tl
1.Известны все MX (кроме GaF, InF)
2.GaX, InX диспропорционируют при нагревании
3.Только TlF хорошо растворим в воде
|
3GaI |
to |
GaI3 + 2Ga |
|
|||
|
|
|
|||||
4. |
TlX, InI не гидролизуются |
|
|||||
|
3InCl + H2O = 2In + In(OH)Cl2 + HCl |
[InI7] в InI |
|||||
5. |
Известны М2Х4 ≡ MI[MIIIX4] |
||||||
|
|
|
|
|
|
|
|
|
TlF |
|
|
TlCl |
TlBr |
|
TlI |
т.пл. 322 0С |
|
т.пл. 430 0С |
т.пл. 460 0С |
|
разл. тв. |
||
т.кип. 826 0С |
|
т.кип. 720 0С |
т.кип. 815 0С |
|
– |
||
стр. NaCl |
|
стр. CsCl |
стр. CsCl |
|
стр. CsCl |
||
|
|
|
|
|
|
|
|
vk.com/club152685050 | vk.com/id446425943
Оксиды Al, Ga, In, Tl
|
Al2O3 |
Ga2O3 |
In2O3 |
Tl2O3 |
Цвет |
белый |
белый |
желтый |
|
коричневый |
|
|
|
|
Т.пл., оС |
2045 |
1795 |
1900 |
716 (р) |
К.ч. |
6 |
6 |
6 |
6 |
G0 |
-1570 |
-996 |
-837 |
-318 |
f 298 |
|
|
|
|
кДж/моль
1.Al2O3, Ga2O3 имеют 2 модификации
2.In2O3 имеет собственный структурный тип
3.Tl2O3 разлагается при нагревании
to
Tl2O3  Tl2O + O2
Tl2O + O2
vk.com/club152685050 | vk.com/id446425943
Оксиды Al, Ga, In, Tl
4. Оксиды и гидроксиды алюминия
γ-Al |
O |
|
to |
|
|
|
α-Al O |
– корунд, d=4.0 г/см3 |
|
3 |
α-Al O |
||||||||
2 |
|
|
|
2 |
3 |
2 |
3 |
|
|
2AlO(OH) = γ-Al O + H O |
400 oC |
d=3.5 г/см3 |
|||||||
|
|
|
2 |
3 |
|
2 |
|
|
|
α-Al2O3 + H2SO4 ≠ |
|
|
α-Al2O3 + KOH ≠ |
|
|
||||
α-AlO(OH) диаспор |
α-Al(OH)3 гидрогиллит |
||||||||
γ-AlO(OH) бёмит |
|
γ-Al(OH)3 гиббсит |
|
||||||
5. Al2O3 образует сложные оксиды: BeAl2O4 – хризоберилл,
MgAl2O4 – шпинель
MgAl2O4
vk.com/club152685050 | vk.com/id446425943
Оксиды Al, Ga, In, Tl
6. Амфотерность Al(OH)3
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3 + 3CO2 + 6NaCl AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Al(OH)3 + 3KOH + 2H2O = K[Al(OH)4(H2O)2]
γ-Al2O3 + 2KOH + 7H2O = 2K[Al(OH)4(H2O)2]
7. Гидроксиды Ga аналогичны по строению и свойствам гидроксидам Al
Ga(OH)3: pKa1 = 6.8 pKb1 = 6.9
идеальная амфотерность
vk.com/club152685050 | vk.com/id446425943
Оксиды Al, Ga, In, Tl
8. In(OH)3 – более сильное основание, чем Al(OH)3,
Ga(OH)3
2GaCl3 + 3Na2S + 6H2O = 2Ga(OH)3↓ + 6NaCl + 3H2S
2InCl3 + 3Na2S = In2S3↓ + 6NaCl 9. Tl(OH)3 крайне неустойчив
2Tl(NO3)3 + 6KOH = Tl2O3 + 6KNO3 + 3H2O
10.Только Tl2O3 – сильный окислитель
Tl2O3 + 6HCl = 2TlCl↓ + 2Cl2 + 3H2O
11.Соединения Tl(III) – сильные окислители в растворе
Tl(NO3)3 + K2SO3 + H2O = TlNO3 + K2SO4 + 2HNO3
vk.com/club152685050 | vk.com/id446425943
Сравнение кислот/гидроксидов В, Al, Ga, In, Tl
H3BO3 |
Al(OH)3 |
Ga(OH)3 |
In(OH)3 |
Tl(OH)3 |
Увеличение силы оснований
Усиление окислительной способности
Немонотонность свойств как следствие особенностей электронной конфигурации
vk.com/club152685050 | vk.com/id446425943
Аквакомплексы Al
Al(H2O)63+ [Al(H2O)5(OH)]2+ + H+ |
|
|
|
|
|
|
|
|
|
гидролиз |
|||||||||||||||||||
[Al(H |
O) |
(OH)]2+ [(H |
|
O) |
|
Al(OH) Al(H |
O) |
]4+ |
|
|
димеризация |
||||||||||||||||||
|
|
2 |
|
5 |
|
|
|
|
|
|
|
2 |
|
4 |
|
|
2 |
|
2 |
|
|
4 |
|
|
|
|
|
||
Также известны [Al |
(OH) |
]3+, [Al (OH) |
15 |
]3+, [Al |
(OH) ]2+, |
||||||||||||||||||||||||
[Al |
|
(OH) |
|
]7+, [Al |
|
3 |
|
|
|
|
6 |
|
|
6 |
|
|
|
(H |
8 |
|
|
22 |
|||||||
13 |
32 |
13 |
(OH) |
35 |
]4+, [Al |
13 |
O |
(OH) |
24 |
O) |
12 |
]7+ |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
2 |
|
|
|
||||||||
K2SO4 + Al2(SO4)3 + 24H2O = 2KAl(SO4)2·12H2O |
квасцы |
||||||||||||||||||||||||||||
|
[Al |
13 |
O (OH) |
24 |
(H O) |
12 |
]7+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
4 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
K(H2O)6 







Al(H2O)6






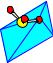

SO4 






KAl(SO4)2·12H2O
vk.com/club152685050 | vk.com/id446425943
Соединения Tl(I)
1. |
Оксид и гидроксид Tl(I) устойчивы |
|
||||||
|
Tl |
O |
= Tl O + O |
2 |
(to) |
черный, т.пл. 300 оС |
||
|
2 |
3 |
2 |
|
|
|
||
|
Tl2O + H2O = 2TlOH |
|
желтый |
|
||||
|
Tl2SO4 + Ba(OH)2 = 2TlOH + BaSO4↓ |
|
||||||
2. |
TlOH – сильное основание |
|
|
|||||
|
TlOH + CO2 = TlHCO3 |
|
|
|||||
|
TlOH + HI = TlI↓ + H2O |
|
|
|||||
|
TlNO3 + Na2S = Tl2S↓ + NaNO3 |
TlP5 |
||||||
3. |
Tl(I) не образует устойчивых комплексов |
|||||||
|
||||||||
|
TlCl + NH3·H2O ≠ |
|
|
|
||||
4. |
Tl(I) окисляется в щелочной среде |
|
||||||
2TlNO3 + 6KOH + 2Cl2 = Tl2O3 + 4KCl + 2KNO3 + 3H2O
vk.com/club152685050 | vk.com/id446425943
Стабилизация In(I)
In(OSO2CF3) [18]crown-6 |
{In 2[15]crown-5}+ |
vk.com/club152685050 | vk.com/id446425943
Полупроводниковые соединения AIIIBV
AlN |
AlP |
AlAs |
AlSb |
вюртцит |
сфалерит |
сфалерит |
сфалерит |
5.9 эВ |
2.4 эВ |
2.1 эВ |
1.5 эВ |
|
|
|
|
GaN |
GaP |
GaAs |
GaSb |
вюртцит |
сфалерит |
сфалерит |
сфалерит |
3.5 эВ |
2.2 эВ |
1.4 эВ |
0.4 эВ |
|
|
|
|
InN |
InP |
InAs |
InSb |
вюртцит |
сфалерит |
сфалерит |
сфалерит |
2.1 эВ |
1.4 эВ |
0.4 эВ |
0.2 эВ |
|
|
|
|
vk.com/club152685050 | vk.com/id446425943
Общие закономерности
1.В группе усиливается «металлический» характер элементов. Все элементы, кроме бора – металлы. Химия бора существенно отличается от химии остальных элементов группы.
2.Бор образует большое число полиморфных модификаций.
3.Для всех элементов не характерно образование кратных связей. Бор образует электрон-дефицитные производные.
4.Вниз по группе уменьшается кислотность оксидов. Только бор образует кислородные кислоты. В ряду Al – Ga – In – Tl уменьшается устойчивость оксоанионов, увеличивается устойчивость катионов.
5.Вниз по группе увеличивается ионность оксидов и галогенидов. Tl(+1) образует ионные галогениды аналогично щелочным металлам.
6.Только таллий проявляет сильные окислительные свойства в высшей степени окисления. Для него характерна степень окисления +1.

vk.com/club152685050 | vk.com/id446425943
Благородныегазы Элементы 18 группыы
Лекция 28
vk.com/club152685050 | vk.com/id446425943
Элементы 18 группы
He – гелий, Ne – неон, Ar – аргон, Kr – криптон, Xe – ксенон, Rn – радон
Благородные газы
vk.com/club152685050 | vk.com/id446425943
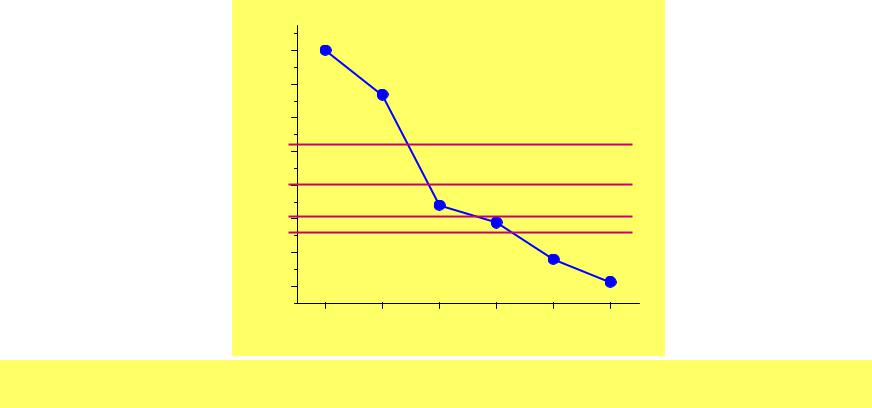
Свойства элементов
He |
Ne |
Ar |
Kr |
Xe |
Rn |
Ат. N |
2 |
10 |
18 |
36 |
54 |
86 |
|
Эл. |
1s2 |
2s22p6 |
3s23p6 |
3d104s24p6 |
4d105s25p6 |
4f145d106s26p6 |
|
конф. |
|
|
|
|
|
|
|
Радиус |
122 |
160 |
192 |
198 |
218 |
220 |
|
пм |
|
|
|
|
|
|
|
I1 |
(эВ) |
24.60 |
21.56 |
15.75 |
14.02 |
12.13 |
10.75 |
I2 |
(эВ) |
54.42 |
40.96 |
27.63 |
24.36 |
21.20 |
21.80 |
χAR |
5.50 |
4.84 |
3.20 |
2.94 |
2.40 |
2.06 |
|
С.О. |
0 |
0 |
0 |
0,(2) |
0,2,4,6,8 |
0,2,(4),(6) |
|
vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
Свойства элементов |
|
|
|
|
|||||
|
|
|
|
He |
|
Ne |
Ar |
|
Kr |
|
Xe |
|
|
Rn |
|
Ат. N |
|
2 |
10 |
18 |
|
36 |
|
54 |
|
|
86 |
|
|||
Эл. |
|
1s2 |
2s22p6 |
3s23p6 |
3d104s24p6 |
4d105s25p6 |
4f145d106s26p6 |
||||||||
конф2.2. |
R, Å |
|
|
|
|
198 24 |
|
|
|
|
|
|
|||
Радиус |
122 |
160 |
192 |
|
|
218 |
|
|
220 |
|
|||||
пм2.0 |
|
|
|
|
|
|
21 |
|
|
|
|
|
|
||
|
|
1.8 |
|
|
|
|
|
|
eV |
|
|
|
|
|
|
|
|
24.60 |
21.56 |
15.75 |
14.0218 |
|
12.13 |
|
10.75 F |
||||||
I1 (эВ) |
|
|
|||||||||||||
|
|
1.6 |
|
|
|
|
|
|
I(1), |
|
|
|
|
|
|
I |
|
54.42 |
40.96 |
27.63 |
24.36 |
|
21.20 |
|
21.80 |
|
|||||
2 |
(эВ) |
|
|
H |
|||||||||||
|
|
|
|
|
|
|
|
15 |
|
|
|
|
|
||
χAR1.4 |
|
5.50 |
4.84 |
3.20 |
2.94 |
|
2.40 |
|
|
2.06 |
|
||||
|
|
1.2 |
|
|
|
|
|
|
12 |
|
|
|
|
|
|
|
|
|
0 |
|
0 |
0 |
|
0,(2)9 |
|
0,2,4,6,8 |
0,2,(4),(6) |
||||
С.О. |
|
|
|
|
|||||||||||
|
|
|
He |
Ne |
Ar |
Kr |
Xe |
Rn |
He |
Ne |
Ar |
Kr |
Xe |
Rn |
|
vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
Свойства элементов |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
He |
Ne |
|
Ar |
|
Kr |
|
|
Xe |
|
|
|
|
|
Rn |
|
|
|
|
||||
|
|
|
|
|
χAR |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5.5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ат. N |
2 |
|
10 |
|
18 |
|
36 |
|
|
54 |
|
|
|
|
|
86 |
|
|
|
|
|||
|
|
|
|
5.0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эл. |
1s |
2 |
2s |
24.5 |
6 |
3s |
2 |
3p |
6 |
10 |
2 |
6 |
10 |
2 |
5p |
6 |
4f |
14 |
10 |
6s |
2 |
6p |
6 |
|
2p |
|
|
|
4d 4s |
|
4p |
4d 5s |
|
|
|
5d |
|
|
|||||||||
конф. |
|
|
|
4.0 |
|
|
|
|
|
|
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
||
Радиус |
122 |
|
3.5 |
|
192 |
|
198 |
|
|
|
|
|
|
|
220 |
|
|
|
|
||||
160 |
|
|
|
|
218 |
|
|
|
|
|
|
|
|
|
|||||||||
пм |
|
|
|
3.0 |
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
2.5 |
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I1 (эВ) |
24.60 |
|
2.0 |
|
15.75 |
|
14.02 |
|
12.13 |
|
|
10.75 |
|
|
|
||||||||
21.56 |
|
|
|
|
|
|
|
||||||||||||||||
I2 (эВ) |
54.42 |
40.96 |
He Ne Ar Kr Xe |
Rn |
|
|
|
|
21.80 |
|
|
|
|||||||||||
27.63 |
|
24.36 |
|
21.20 |
|
|
|
|
|
||||||||||||||
χAR |
5.50 |
4.84 |
|
3.20 |
|
2.94 |
|
|
2.40 |
|
|
2.06 |
|
|
|
|
|||||||
С.О. |
0 |
|
|
0 |
|
0 |
|
|
0,(2) |
|
0,2,4,6,8 |
|
0,2,(4),(6) |
|
|||||||||
vk.com/club152685050 | vk.com/id446425943
Физические свойства Ng
He |
Ne |
Ar |
Kr |
Xe |
Rn |
Т.пл. (оС) |
|
— |
-269 |
-189 |
-157 |
-112 |
-71 |
Т.кип. (оС) |
-268.94 |
-246 |
-185 |
-153 |
-108 |
-62 |
|
vH0bp |
|
0.08 |
1.71 |
6.43 |
9.08 |
12.62 |
18.0 |
кДж/моль |
|
|
|
|
|
|
|
d, г/л (н.у.) |
|
0.18 |
0.90 |
1.78 |
3.75 |
5.90 |
9.73 |
растворимость |
8.6 |
10.5 |
33.6 |
59.4 |
108.0 |
230 |
|
в воде при н.у. |
|
|
|
|
|
|
|
(мл/кгH2O) |
|
|
|
|
|
|
|
vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
|
|
|
|
||||
|
|
Физические свойства Ng |
|
|
|
|||||||
|
|
He |
|
Ne |
|
Ar |
|
Kr |
|
Xe |
|
Rn |
Т.пл. (оС) |
|
— |
|
-269 |
|
-189 |
|
-157 |
|
-112 |
-71 |
|
Т.кип. (оС) |
-268.94 |
|
-246 |
|
-185 |
|
-153 |
|
-108 |
-62 |
||
vH0bp |
|
0.08 |
|
1.71 |
|
6.43 |
|
9.08 |
|
12.62 |
18.0 |
|
кДж/моль |
|
|
|
|
|
|
|
|
|
|
|
|
-50 T, oC |
|
0.18 |
|
0.90 |
|
20 |
vH0bp, кДж/моль |
|
9.73 |
|||
d, г/л (н.у.) |
|
|
|
1.78 |
|
3.75 |
|
5.90 |
||||
-100 |
|
8.6т.кип. |
|
|
16 |
|
|
|
|
|
|
|
|
10.5 |
|
33.6 |
|
59.4 |
|
108.0 |
230 |
||||
растворимость |
|
|
|
|||||||||
-150 |
|
|
|
|
|
12 |
|
|
|
|
|
|
в воде при н.у. |
|
|
|
|
|
|
|
|
|
|
|
|
(мл/кгH2O)4.21 K |
|
т.пл. |
|
8 |
|
|
|
|
|
|
||
-200 |
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-250 |
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
He |
Ne Ar |
Kr |
Xe |
Rn |
|
He |
Ne |
Ar |
Kr |
Xe |
Rn |
|

vk.com/club152685050 | vk.com/id446425943
Физические свойства Ng
He |
Ne |
Ar |
Kr |
Xe |
Rn |
Т.пл. (оС) |
|
— |
-269 |
-189 |
-157 |
-112 |
-71 |
Т.кип. (оС) |
-268.94 |
-246 |
-185 |
-153 |
-108 |
-62 |
|
vH0bp |
|
0.08 |
1.71 |
6.43 |
9.08 |
12.62 |
18.0 |
кДж/моль |
|
|
|
|
|
|
|
d, г/л (н.у.) |
|
0.18 |
0.90 |
1.78 |
3.75 |
5.90 |
9.73 |
растворимость |
8.6 |
10.5 |
33.6 |
59.4 |
108.0 |
230 |
|
в воде при н.у. |
|
|
|
|
|
|
|
(мл/кгH2O) |
|
|
|
|
|
|
|
Ng
vk.com/club152685050 | vk.com/id446425943
Открытие Ng
1.Аргон (ленивый, недеятельный) непрореагировавший остаток воздуха Рамсэй, Рэлей, 1892
2.Гелий (солнечный)
анализ солнечного спектра. Локьер, 1894
3.Криптон (скрытный, секретный) фракционирование воздуха. Рамсэй, 1898
4.Неон (новый)
спектральный анализ фракционированного воздуха Рамсэй, 1898
5. Ксенон (чужой, странный)
спектральный анализ фракционированного воздуха Рамсэй, 1898
6.Радон (аналог радия)
впродуктах распада радия. Резерфорд, Содди, 1901
vk.com/club152685050 | vk.com/id446425943
Строение Ng
1.Ng одноатомны в газовой и жидкой фазах,
имеют кристаллическую решетку меди в твердой фазе.
2.He демонстрирует особый тип поведения при низких to
0-вариантные |
He-I ж, He-II ж, тв |
равновесия: |
He-I ж, He-II ж, газ λ-точка (2.19 K) |
He-II – сверхтекучесть, высокая теплопроводность
vk.com/club152685050 | vk.com/id446425943
Распространение Ng
1.He – 2й по распространенности элемент Вселенной Всегда присутствует в природном газе в результате α-распада, до 7 об.%
2.Ar – 0.93% в атмосфере
3.Ne, Kr, Xe – следовые количества в атмосфере
4.Rn – в продуктах распада 238U
Cодержание Ng в атмосфере, % He 0.00052
Ne 0.0018 Ar 0.93 Kr 0.0011
Xe 0.0000087
1 |
об. % |
|
|
|
|
0.1 |
|
|
|
|
|
0.01 |
|
|
|
|
|
1E-3 |
|
|
|
|
|
1E-4 |
|
|
|
|
|
1E-5 |
|
|
|
|
|
|
He |
Ne |
Ar |
Kr |
Xe |

vk.com/club152685050 | vk.com/id446425943
Получение и применение Ng
1. |
He, Ar |
из природного газа, после сжижения |
|
|
остальных компонентов |
2. |
Ne |
остаток после сжижения воздуха |
3. |
Kr, Xe |
селективная адсорбция воздуха углем |
1.He, Ar – создание инертной атмосферы в лаборатории и на производстве
2.He – как легкий, негорючий газ, охладитель, в дыхательной смеси для глубоководных работ
3.Ne, Kr, Xe – в разрядных лампах
4.Ar – наполнитель ламп накаливания
5.Rn – в медицине
6.XeF2 – как лабораторный окислитель
7.Xe – в ракетном топливе нового поколения

vk.com/club152685050 | vk.com/id446425943
Соединения Ng
1. Короткоживущие ионы, содержащие Ng. Существуют только в газовой фазе при пониженном давлении
2. Клатраты Ng. Устойчивы при н.у. Не содержат химической связи между атомами Ng и клатратной
решеткой, кроме ван-дер-Ваальсова взаимодействия.
3. Истинные химические соединения. Образованы в основном Xe с наиболее электроотрицательными
элементами – F, O, реже – N, Cl, C.
vk.com/club152685050 | vk.com/id446425943
Короткоживущие ионы Ng
1. HeH+
Е
1s 

He
|
|
|
|
|
|
|
впервые получен в 1925 г. |
||
|
|
|
|
|
|
σ |
|
|
•к.с. = 1, но: |
|
|
|
|
|
|
* |
|
1s |
малая устойчивость из-за |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
малой поляризуемости |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
σсв |
|
|
•стремление к |
|
|
|
|
|
|
|
|
||
HeH+ |
H+ |
распаду с |
|||||||
|
|
|
|
|
|
|
|
|
образованием He0 |
2. Гомоатомные катионы
|
He 2+ |
Ne 2+ |
Ar 2+ |
Kr 2+ |
Xe 2+ |
|
2 |
2 |
2 |
2 |
2 |
Едисс. |
228.0 |
130.9 |
122.2 |
110.9 |
99.2 |
кДж/моль |
|
|
|
|
|
уменьшение устойчивости
vk.com/club152685050 | vk.com/id446425943
Клатраты Ng
1. Клатраты построены по типу «гость-хозяин»
Ng – гость, заключенный в решетку хозяина, не
связанный с ним ковалентными связями
2. Типы клатратов Ng: |
|
|
а) с водой |
24Ng@136H2O |
Ar—Rn |
|
8Ng@46H2O |
Ar—Rn |
б) с гидрохиноном |
Ng@3C6H4(OH)2 |
Ar—Xe |
в) с фенолом |
Ng@4C6H5OH |
Xe, Rn |
|
Ng@3C6H5OH |
Ar, Kr |
г) с пара-хлорфенолом |
Ng@3C6H4Cl(OH) |
Xe, Rn |
д) с толуолом |
Ng@2C6H5CH3 |
Rn |
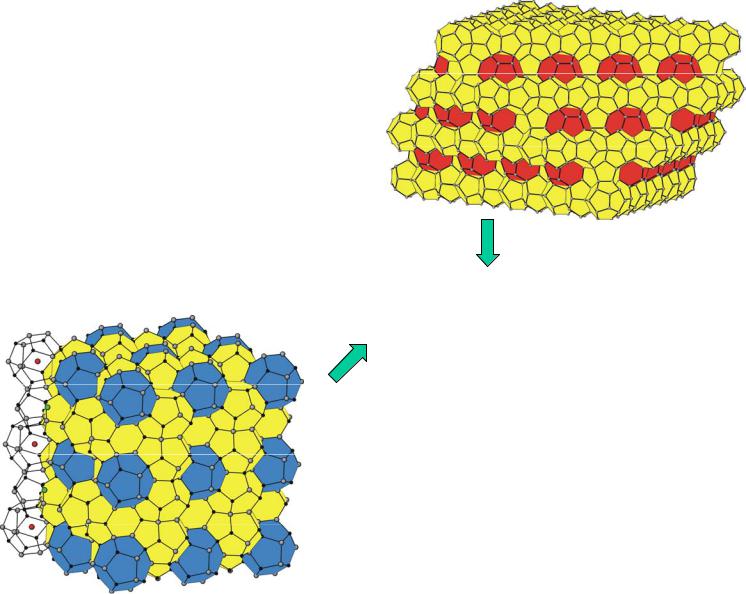
vk.com/club152685050 | vk.com/id446425943
Клатраты Ng
1. Клатраты построены по |
» |
Ng – гость, заключенный |
, не |
связанный с ним |
|
2. Типы клатратов Ng: |
|
|
а) с водой |
24Ng@136H2O |
Ar—Rn |
|
8Ng@46H2O |
Ar—Rn |
б |
Ng@3C6H4(OH)2 |
Ar—Xe |
|
Ng@4C6H5OH |
Xe, Rn |
|
Ng@3C6H5OH |
Ar, Kr |
г |
Ng@3C6H4Cl(OH) |
Xe, Rn |
|
Ng@2C6H5CH3 |
Rn |

vk.com/club152685050 | vk.com/id446425943
Клатраты Ng
3. Образование и устойчивость клатратов определяется
комплементарностью гостя и хозяина
Для клатратов Ng:
Комплементарность – соответствие формы и размера полости каркаса хозяина размеру сферического
атома Ng
4. Устойчивость 8Ng@46H2O
Ar Kr Xe Rn
р, мм Hg |
98 14.5 1.15 0.4 |
при 0 оС
увеличение устойчивости
5. Получение:
совместная кристаллизация при высоком давлении
vk.com/club152685050 | vk.com/id446425943
Фториды Xe
1. Первое истинное соединение Ng (Бартлетт, 1962)
|
Xe + PtF6 = Xe[PtF6] |
строение неизвестно |
|||
Аналогично O2 + PtF6 = [O2][PtF6] |
|
||||
|
I (Xe) ≈ E(O |
2 |
→ O +) ≈ 12.1 эВ |
|
|
|
1 |
2 |
|
|
|
2. Фториды Xe – наиболее стабильные соединения Xe |
|||||
|
|
|
XeF2 |
XeF4 |
XeF6 |
Т.пл., оС |
|
140 |
117 |
49 |
|
H0 |
, кДж/моль |
|
-109 |
-216 |
-294 |
f |
298 |
|
|
|
|
d(Xe–F), пм |
|
200 |
195 |
189 |
|
молекулярная |
линейная |
квадратная |
октаэдрическая |
||
геометрия |
|
|
|
|
|
vk.com/club152685050 | vk.com/id446425943
Фториды Xe
3. Получение
Xe (газ) + F (газ) |
20 оС |
XeF |
|
(тв) |
|
|
УФ |
2 |
|||
2 |
|
|
|
||
|
|
rH0298 = -175 кДж/моль |
|||
NiF2 100 оС |
|
XeF6 |
|
|
|
Xe + 3F2 |
|
|
|
||
NiF2 300 оС |
|
Всегда с примесью |
|||
XeF4 |
|
XeF |
|||
Xe + 2F2 |
|
|
2 |
||
vk.com/club152685050 | vk.com/id446425943
Фториды Xe
4. Разделение |
|
|
|
|
XeF2 |
AsF5 |
[Xe2F3][AsF6] |
||
XeF4 |
XeF4 |
|||
BrF3 |
(ж) |
|||
XeF6 |
[XeF5][AsF6] |
|||
|
|
|||
5. Гидролиз
2XeF2 + 2H2O = 2Xe + 4HF + O2
XeF5+
медленно
6XeF4 + 12H2O = 2XeO3 + 4Xe + 24HF + 3O2
XeF6 + 3H2O = XeO3 + 6HF
vk.com/club152685050 | vk.com/id446425943
Фториды Xe
6. Фторирующие агенты, окислители
|
XeF6 > XeF4 > XeF2 |
только в лаборатории |
||
S + 3XeF |
HF (ж) |
SF + 3Xe |
|
|
|
2 |
|
6 |
|
2Ir + 5XeF2 |
HF (ж) |
2IrF5 + 5Xe |
|
|
2XeF6 |
+ SiO2 = 2XeOF4 + SiF4 |
не red/ox ! |
||
5XeF2 |
+ 2MnSO4 + 2H2O = 5Xe + 2HMnO4 + 10HF + 2H2SO4 |
|||
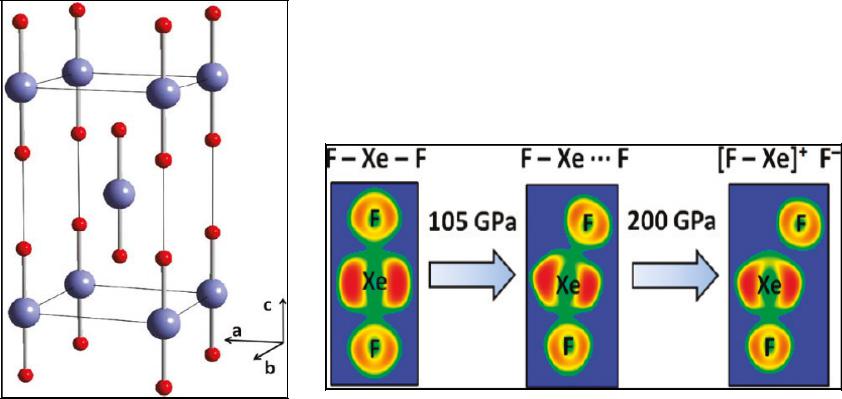
vk.com/club152685050 | vk.com/id446425943
Фториды Xe
7. Строение XeF2
Строение всех фторидов Xe → метод Гиллеспи
Ионизация под давлением
vk.com/club152685050 | vk.com/id446425943
Фторокомплексы Xe
1. Фторокатионы Xe
2XeF2 + SbF5 = [Xe2F3][SbF6] |
|
|||
XeF |
+ SbF |
= [XeF ][SbF ] |
Xe2F3+ |
|
6 |
5 |
5 |
6 |
|
XeF2 |
+ HClO4 = [XeF]ClO4 + HF |
|
||
XeF2 |
+ 2BiF5 = [XeF][Bi2F11] |
(77 K) |
||
Mg(XeF2)(XeF4)(AsF6)4
[XeF][Bi2F11]
vk.com/club152685050 | vk.com/id446425943
Фторокомплексы Xe
2. Оксофториды Xe
XeF6 |
+ H2O |
HF |
XeOF4 + 2HF |
|
|
|
XeOF4 |
|
|||||
|
|
|||||
XeF + H O |
HF |
XeOF + 2HF |
|
|
||
|
|
|||||
4 |
2 |
|
|
2 |
|
|
CsF + XeO |
3 |
HF |
Cs[XeO F] |
устойчив |
||
|
|
|
3 |
|
|
|
XeF82–
3. Фтороксенаты
2CsF + XeF6 = Cs2[XeF8] т.разл. ≈ 450 оС
2CsF + XeF4 = Cs2[XeF6] т.разл. ≈ 600 оС

vk.com/club152685050 | vk.com/id446425943
Кислородные соединения Xe
1. Оксиды Xe |
|
|
|
||
|
|
XeO3 |
|
XeO4 |
|
бесцветные кристаллы |
светло-желтый газ |
||||
|
|
нелетуч |
|
неустойчив |
|
H0 |
298 |
= +402 кДж/моль |
H0 |
298 |
= +642 кДж/моль |
f |
|
f |
|
||
очень взрывчатые вещества !
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d(Xe–O) = 176 пм |
|
|
|
|
пм |
||
|
d(Xe–O) |
= 174 |
|||||
(O–Xe–O) = 103o |
(O–Xe–O) = 109.45o |
||||||
vk.com/club152685050 | vk.com/id446425943
Кислородные соединения Xe
2. |
Получение |
|
|
XeF6 + 3H2O = XeO3 + 6HF |
|
|
Na4XeO6 + 4H2SO4 (конц) = XeO4 + 4NaHSO4 + 2H2O |
|
3. |
Свойства |
|
|
XeO3 + KOH = K[HXeO4] |
гидроксоксенат |
2K[HXeO4] + 2KOH (к) = Xe + O2 + K4XeO6 + H2O
перксенат
4XeF6 + 18Ba(OH)2 = 3Ba2XeO6 + Xe + 12BaF2 + 18H2O
K4XeO6 + 2Na2SO4 + 8H2O = Na4XeO6·8H2O↓ + 2K2SO4
vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
|
Кислородные соединения Xe |
|||||
4. Окислители |
|
|
|
|
|
5XeO3 + 6MnSO4 + 9H2O = 5Xe + 6HMnO4 + 6H2SO4 |
|||||
K4XeO6 + 4MnO2 + 4KOH = 4K2MnO4 + Xe + 2H2O |
|||||
18 |
nE0 |
|
|
|
H4XeO4 |
|
|
|
|
||
15 |
|
|
|
XeO3 |
|
12 |
|
|
|
|
|
|
|
|
|
|
|
9 |
|
|
|
HXeO4– |
|
6 |
|
|
|
|
HXeO 3– |
|
|
|
|
|
6 |
3 |
Xe |
|
|
|
|
0 |
|
|
|
|
|
|
0 |
2 |
4 |
6 |
8 |
|
степень окисления |
||||
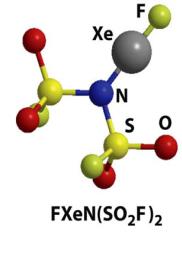
vk.com/club152685050 | vk.com/id446425943
Другие соединения Xe
1. Соли Xe2+
[XeF]ClO4 + HClO4 (конц) = Xe(ClO4)2 + HF
XeF2 + HSO3F = Xe(SO3F)2
2. Соединения со связью Xe–Cl, Xe–N
XeF2 + NaCl + 2SbF5 = [XeCl][Sb2F11] + NaF XeF2 + HN(SO2F)2 = FXeN(SO2F)2 + HF
vk.com/club152685050 | vk.com/id446425943
Другие соединения Xe
3. Комплексные соединения |
|
|
|
|
|
||
(C |
F ) B + 3XeF |
HF |
[C F Xe][BF ] + 2[C F Xe]F |
||||
6 |
5 3 |
2 |
6 |
5 |
4 |
6 |
5 |
Также известны: |
|
|
[AuXe4][Sb2F11]2 |
Xe2[Sb4F21] |
|
[AuXe4]2+ |
||
Xe + d(Xe–Xe) = 309 пм |
||
|
2 |
|
|
парамагнитен |
|
|
устойчив до –60 оС |
|
d(Au–Xe) = 274 пм |
|
|
|
Xe2OH2 |
vk.com/club152685050 | vk.com/id446425943
Соединения Kr, Rn
1.Для Kr известны только дифторид и его производные
2.KrF2 – белый, твердый, т.разл. ≈ 25 оС
fH0298 = +60 кДж/моль
Kr + F |
УФ, 77 К KrF |
|
|
|
|
||
|
2 |
|
2 |
|
|
|
|
KrF + MnF |
HF (ж) |
MnF + Kr |
|
|
|
|
|
2 |
2 |
|
4 |
|
|
|
KrF2 |
7KrF2 + Au = 2[KrF][AuF6] + 5Kr |
|
|
|
||||
KrF + SbF |
HF (ж) |
[KrF][Sb F |
11 |
] + [Kr F ][SbF ] |
|||
2 |
5 |
|
2 |
2 |
3 |
6 |
|
3. Соединения Rn мало изучены
Rn – α-эмиттер  разлагает соединения
разлагает соединения
3Rn + 2ClF3 = 3RnF2 + 2Cl2 бесцветный, нелетучий
