

vk.com/club152685050 | vk.com/id446425943
Методы защиты от коррозии
Содержание
Методы защиты металлов от коррозии …………………………………… …….2 Коррозионностойкое легирование………………………………………… …. 2 Обработка коррозионной среды…………………………………………… …. 3 Обработка растворов электролитов……………………………………… …… 3
Ингибиторы…………………………………………………………………… ... 3 Номенклатура………………………………………………………………… 4 Механизм ………………………………………………………………………6 Анодные ингибиторы …………………………………………………………7 Катодные ингибиторы …………………………………………………………8
Электрохимическая защита ……………………………………………………..9 Катодная защита внешним током……………………………………………10
Протекторная защита…………………………………………………………10 Защитные покрытия …………………………………………………………….11
Неметаллические защитные покрытия ……………………………..………12 Металлические защитные покрытия…………………………………….…. 13
ЛИТЕРАТУРА ……………………………………………………………….……15
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
7 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
Методы защиты металлов от коррозии
Для борьбы с коррозией принимают самые разнообразные методы, учитывающие особенности не только самого металла, но и условия эксплуатации металлического изделия. В большинстве случаев можно подобрать тот или иной конструкционный материал для его эксплуатации в коррозионных средах. Когда этот выбор сделать нельзя, приходится защищать металл от коррозии. Выбор того или иного способа защиты определяется его эффективностью и экономической целесообразностью.
Все используемые в практике меры по защите металлов от коррозии можно разделить на несколько групп:
1.Повышение коррозионной стойкости металлов и сплавов легированием.
2.Снижение агрессивности коррозионной среды.
3.Защита электрическим током (электрохимическая защита).
4.Нанесение защитных покрытий.
5.Комбинированные методы защиты и рациональное конструирование.
Коррозионностойкое легирование
К числу мер борьбы с коррозией, основанных на повышении коррозионной стойкости металлов можно отнести термообработку и коррозионностойкое легирование. Термообработка, повышающая коррозионную стойкость металла, способствует гомогенизации структуры металла, снятию внутренних напряжений, предотвращению выпадения карбидов по границам зерен и др.
Во многих случаях высокая коррозионная стойкость металлических конструкций достигается правильным выбором материалов – металлов и сплавов, устойчивых в данной коррозионной среде.
Примером повышения коррозийной стойкости металла легированием являются сплавы меди с золотом (анодное легирование). Для надежной защиты меди необходимо добавлять к ней значительное количество золота (не менее 52,2 ат.%).
Введение хрома в количестве нескольких процентов резко увеличивает коррозионную стойкость сталей. Такие добавки (хрома, никеля, титана, молибдена, меди, кремния, алюминия, бериллия и др.), в большинстве случаев уменьшают анодную активность сплава за счет его пассивации в определенных коррозионных средах.
В отдельных случаях повышение коррозионной стойкости достигается легированием катодными добавками, когда снижение скорости коррозии достигается за счет торможения катодного процесса.
Обычно легирование проводят в том случае, когда металл конструкции не позволяет применять другие методы защиты.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
6 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
Обработка коррозионной среды
Одним из факторов, определяющих скорость коррозии и характер коррозионных разрушений металлов, является состав коррозионной среды. Понижение агрессивности среды путем ее соответствующей обработки широко используется для предотвращения коррозионных разрушений металлоконструкций.
Обработка коррозионной среды с целью уменьшения ее коррозионной активности по отношению к металлу целесообразна только при ее ограниченном объеме, когда это технологически и экономически оправдано.
Обработка растворов электролитов
Скорость электрохимической коррозии в значительной степени зависит от содержания деполяризатора (ионов водорода или растворенного кислорода) в коррозионной среде. Обработка коррозионной среды с целью снижения ее агрессивности сводится к уменьшению содержания в ней деполяризатора и введения в нее замедлителей (ингибиторов) коррозии металлов.
Уменьшение содержания деполяризатора достигается нейтрализацией кислых растворов, вызывающих коррозию с водородной деполяризацией, или удалением из раствора электролита кислорода, вызывающего коррозию с кислородной деполяризацией.
Обескислороживание воды в замкнутых системах проводят термическим, химическим или десорбционным методами.
Термический - коррозионную среду нагревают до определенной температуры, при которой происходит деаэрация среды за счет удаления кислорода и углекислого газа, что способствует уменьшения скорости коррозии.
Десорбционный – воду перемешивают с инертным газом (азотом). При барботировании кислород переходит в инертный газ и затем уже жидкую и газообразную фазы разделяют.
При химическом способе обескислороживания в воду добавляют восстановители, которые взаимодействуют с растворенным кислородом, связывая его в различные соединения.
В качестве восстановителей используют гидросульфит натрия, сульфит натрия, гидразин, карбогидразид, тиосульфат натрия, сернистый газ (SO2) и др.
Na2SO3 + O2 = 2Na2SO4
Ингибиторы
Ингибирование атмосферной коррозии как черных, так и цветных металлов требует применения химических соединений, выраженной склонностью к по-
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
6 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
верхностной адсорбции, и способностью к образованию прочных и устойчивых связей с поверхностью металла.
Ингибиторы коррозии представляют наиболее экономически выгодное, и при этом чрезвычайно мощное средство для борьбы с ущербом, наносимым атмосферной коррозией металлам и сплавам.
Номенклатура
По Фишеру [1], ингибиторы коррозии делятся на две категории:
1.Поверхностные ингибиторы. Поверхностные ингибиторы уменьшают скорость физических, электрохимических и/или химических процессов электродных реакций, протекающих непосредственно на поверхности раздела металл/электролит.
2.Ингибиторы поверхностного слоя. Ингибиторы слоя электролита могут уменьшать физических и химических процессов электродных реакций,
протекающих в слое электролита, примыкающего к поверхности раздела фаз. Этот слой может представлять собой часть двойного слоя, диффузионный слой Нернста или пограничный слой Прандтля. Вещества, растворенные или диспергированные в слое электролита, вызывают ингибирование в слое электролита.
Далее, в зависимости от происхождения активных защитных частиц, Фишер подразделяет ингибиторы на первичные и вторичные:
1.Первичные ингибиторы. Вещества, изначально присутствующие в слое электролита и не изменяющиеся химически.
2.Вторичное ингибирование.Вызывается веществами, которые не присутствуют в электролите изначально. Они генерируются на поверхности раздела фаз или в поверхностном слое электролита путем химических или электрохимических процессов.
Ингибиторы коррозии разделяют, в зависимости от условий их применения, на жидкофазные и парофазные или летучие. Жидкофазные ингибиторы делят в свою очередь на ингибиторы коррозии в нейтральных, щелочных и кислых средах.
В качестве ингибиторов кислотной коррозии применяются почти исключительно органические вещества, содержащие азот, серу или кислород в виде амино-, имино-, тиогрупп, а также в виде карбоксильных, карбонильных и некоторых других групп. Согласно наиболее распространенному мнению, действие ингибиторов кислотной коррозии связано с их адсорбцией на границе раздела металл – кислота. В результате адсорбции ингибиторов наблюдается торможение катодного и анодного процессов, снижающие скорость коррозии.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
6 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
Влияние того или иного фактора структуры молекулы ингибитора определяется зарядом и природой металла, рН среды, характером адсорбции ингибитора и образующихся связей при взаимодействии металл-ингибитор.
Из вышеприведенного видно, что одним из важных факторов строения молекул органических ингибиторов содержащих гетероатомы азота, кислорода и серы определяющих их защитную способность при коррозии железа, является взаимодействие неподеленной пары электронов гетероатома с незавершенными d- уровнями атома железа.
Введение в молекулу ингибитора электронодонорных заместителей приводит обычно к усилению защитного эффекта ингибитора. Донорная функция соединения в химической реакции, как правило, характеризуется энергией образования их возбужденного состояния за счет перехода неподеленных электронов с несвязывающих орбиталей на разрыхляющие p-орбитали.
При рассмотрении защитного эффекта ингибитора коррозии наряду с электронной плотностью на гетероатомах необходимо учитывать и структурные факторы строения молекулы ингибитора. Структура молекул ингибитора может способствовать увеличению защитного эффекта (образование хелатных структур на поверхности металла, увеличение площади покрываемой молекулой ингибитора), а может снижать защитное действие ингибитора (разветвленность молекулы).
Адсорбция, однако, является лишь необходимым условием проявления ингибирующего действия органических веществ, но не определяет полностью фактического эффекта ингибиторов. Последний зависит также от многих других факторов – электрохимических особенностей протекания данного коррозионного процесса, характера катодной реакции, величины и природы перенапряжения водорода (при коррозии с водородной деполяризацией), возможных химических превращений ингибитора в ходе коррозии и т.д.
Действие большинства ингибиторов кислотной коррозии усиливается при одновременном введении добавок поверхностно – активных анионов: галогенидов, сульфидов и роданидов.
В качестве ингибиторов для нейтральных растворов чаще всего применяются неорганические вещества анионного типа. Их тормозящее действие связано, повидимому, или с окислением поверхности металла (нитриты, хроматы), или с образованием пленки труднорастворимого соединения между металлом, данным анионом и, возможно, кислородом (фосфаты, полифосфаты).
Для ингибирования железа полифосфатами необходимо присутствие растворенного кислорода в коррозионной среде (вода). В отсутствие растворенного кислорода, при содержании в растворе полифосфата натрия в количестве 60 мг/л, коррозия ускоряется. В случае комплексов фосфорсодержащих соединений с 2-х валентными катионами (Zn, Ca, Mg) защитное действие ингибитора
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
6 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
увеличивается. Это объясняется образованием на поверхности металла трудно растворимых пленок гидроксокомплексов катионов щелочноземельных металлов.
Все ингибиторы для нейтральных сред тормозят преимущественно анодную реакцию, смещая стационарный потенциал в положительную сторону.
До настоящего времени еще не удалось найти эффективных ингибиторов коррозии металлов в щелочных растворах. Некоторым тормозящим действием обладают лишь высокомолекулярные соединения.
Летучие ингибиторы коррозии - вторичные ингибиторы поверхностного слоя электролита, обладающие достаточным давлением насыщенного пара в атмосферных условиях, и обеспечивающие таким образом заметный перенос веще- ства-ингибитора из паровой фазы.
По определению, к ЛИК можно отнести только вещества, обладающие достаточным давлением насыщенного пара в атмосферных условиях, и способные действовать как ингибиторы поверхностного слоя электролита путем электрохимического изменения кинетики электродных реакций.
Механизм
Процесс замедления коррозии железа сопровождается адсорбцией молекул ингибитора на активных центрах поверхности металла. Действие ингибитора выражается в экранировании поверхности металла и изменении энергии активации коррозионного процесса.
Балезин [2] подчеркивает, что каждый ингибитор коррозии, в том числе и летучие ингибиторы, должны обладать следующими свойствами:
1.Способностью образовывать устойчивую связь с поверхностью металла при данном составе окружающей среды и в определенном диапазоне кислотности и давления.
2.Создавать слой, непроницаемый для ионов, вызывающих коррозию.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
6 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
Механизм ингибирования проиллюстрирован на рисунке.
Функциональная группа R1, связанная с ядром молекулы-ингибитора R0, обеспечивает адсорбцию на поверхности при данном составе окружающей среды. Функциональная группа R2, также связанная с ядром R0, отвечает за толщину и непроницаемость образующейся пленки. При разработке ингибиторов для определенного состава окружающей среды необходимо вначале варьировать функциональную группу R1 до тех пор. пока не будет получено вещество, прочно адсорбирующееся на поверхности металла. После выбора группы R1, группа R2 варьировалась до достижения удовлетворительной устойчивости к проникновению агрессивных ионов. Использование такого подхода позволило разработать ингибиторы коррозии, эффективные для большого числа металлов и различных составов окружающей среды.
По механизму своего действия на процесс электрохимической коррозии ингибиторы делятся на катодные и анодные, в зависимости от того, каким электродным процессом в локальных гальванических элементах они препятствуют, а также экранирующие (изолирующие активную поверхность металла от коррозионной среды).
Анодные ингибиторы
Как правило, способствуют переходу анодного участка локального гальванического элемента в пассивное состояние или образованию на них защитных пленок, представляющих собой труднорастворимые продукты взаимодействия ингибитора с переходящими в раствор ионами металла. Образование сплошных нерастворимых пленок на металле препятствует дальнейшему протеканию анодного процесса при коррозии металлов.
Анодные ингибиторы чаще всего используют в нейтральных средах при коррозии с кислородной деполяризацией. К таким ингибиторам относятся неорганические вещества-окислители: хроматы, бихроматы, нитриты, молибдаты, вольфраматы щелочных металлов.
Являясь деполяризаторами, они легко восстанавливаются на катодных участках поверхности металла и способствуют возрастанию плотности коррозионного тока. Увеличение на анодных участках плотности тока, превышающей величину необходимую для пассивации металла, сдвигает потенциал металла в область пассивации и скорость анодного процесса растворения металла резко снижается.
Ингибирующее действие фосфатов, полифосфатов, боратов, силикатов, солей бензойной и адипиновой кислот проявляется только при наличии в электролите растворенного кислорода, который и играет роль пассиватора. Эти вещества способствуют адсорбции кислорода на поверхности металла, переводя его в пассивное состояние. Помимо этого, они тормозят анодный процесс растворе-
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
6 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
ния металла за счет образования труднорастворимых защитных пленок самого разнообразного характера.
Для обеспечения эффективной защиты металлов от коррозии с помощью анодных ингибиторов необходимо поддерживать концентрацию ингибитора выше предельного во всех участках защищаемого изделия. В противном случае пассивация может не наступить или будет неполной. Неполная пассивация приводит к сокращению анодных участков, увеличению скорости и глубины разрушения металла на локализованных участках.
При определенных условиях анодные ингибиторы коррозии могут превратиться в ее стимуляторы. Это характерно для коррозионных процессов, протекающих с катодным контролем. В этом случае окислители легко восстанавливаются на катодных участках и тем самым увеличивают как скорость катодного процесса, так и скорость коррозии металла. Поэтому анодные ингибиторы относятся к категории опасных.
Применение анодных ингибиторов разнообразно. Хроматы и бихроматы используют для защиты стальных конструкций в оборотных охлаждающих водах резервуаров, баков, башенных холодильников, в двигателях внутреннего сгорания, а также для защиты алюминия, магния и их сплавов в нейтральных и щелочных растворах. Нитриты используются как ингибиторы в антифризах. Фосфаты и полифосфаты применяют как ингибиторы стали в воде и холодильных рассолах. Большой эффект достигается при совместном присутствии фосфатов и хроматов.
Катодные ингибиторы
Не изменяют числа и площади анодов локальных гальванических элементов, а замедляют вызывающие коррозию анодные процессы за счет снижения эффективности катодного процесса или сокращения площади катодов коррозионной гальванопары. Катодные ингибиторы, прочно адсорбируясь на катодных участках поверхности металла, обычно увеличивают перенапряжение катодного процесса, препятствуя перемещению деполяризующего вещества (ионов водорода или кислорода) к катодным участкам корродирующей поверхности. Снижение скорости катодного процесса при коррозии с кислородной деполяризацией может быть достигнуто за счет уменьшения содержания кислорода в коррозионной среде, а при коррозии с водородной деполяризацией за счет повышения перенапряжения реакции выделения водорода.
Уменьшение содержания растворенного в жидкой коррозионной среде кислорода тормозит реакцию его катодного восстановления, а следовательно, и скорость коррозии металла.
Перенапряжение катодной реакции выделения водорода может быть достигнуто при введении в коррозионную среду солей тяжелых металлов, обладающих
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
6 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
высоким перенапряжением для водорода, и органических веществ, в молекулах которых содержатся полярные группы.
Катионы тяжелых металлов (Hg, Pb, Bi, As), контактно восстанавливаются на катодных участках, затрудняя реакцию выделения водорода и соответственно коррозию металла, протекающую с водородной деполяризацией.
Катодные ингибиторы коррозии чаще всего применяют при травлении металлов в металлургическом производстве для удаления окалины и ржавчины с поверхности металла. При введении органических ингибиторов в травильный раствор скорость растворения металла значительно уменьшается, а растворяются преимущественно оксиды (окалина или ржавчина), на которых катодные ингибиторы не адсорбируются (или адсорбируются очень слабо) и потому не мешают их растворению.
В качестве катодных ингибиторов кислотной коррозии применяют азотсодержащие и серосодержащие органические вещества, ацетиленовые соединения, например, диэтиламин, уротропин, тиокрезол и др.
Катодные ингибиторы по защитному действию менее эффективны, чем анодные. Однако, они совершенно безопасны, так как не вызывают усиления коррозии при их недостаточном содержании.
Электрохимическая защита
Сущность электрохимической защиты заключается в том, что металлоконструкции подвергают внешней поляризации (катодной или анодной). В зависимости от вида поляризации различают катодную и анодную защиту.
Все электрохимические методы защиты основаны на изменении скорости протекания анодных или катодных процессов при электрохимической коррозии металлов. Материальный эффект (разрушение металла) связан с протеканием анодной реакции:
Ме – nе = Меn+ |
Анодный процесс |
2Н+ + 2е = Н2 |
Катодный процесс |
Подавая из внешней среды на металл электроны, можно менять скорость электрохимических реакций: уменьшать скорость анодной реакции, увеличивать скорость катодной реакции. При этом можно подобрать такие условия, при которых ток анодного растворения ja = 0. В этом случае коррозии наблюдаться не будет.
Наиболее распространенным случаем электрохимической защиты является катодная защита: внешним током или протекторная.
Сущность катодной защиты сводится к подаче на защищаемое сооружение избытка электронов, которые затрудняют окисление металла. Катодную поляризацию можно осуществлять путем присоединения защищаемой конструкции к
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
6 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
отрицательному полюсу внешнего источника постоянного тока или к металлу имеющему более электроотрицательный электродный потенциал. В последнем случае нет необходимости во внешнем источнике тока, так как образуется гальванический элемент с тем же направлением тока, т.е. защищаемая деталь становится катодом, а более отрицательный металл (протектор) – анодом.
Катодная защита внешним током
Катодная защита внешним током заключается в том, что защищаемую металлическую конструкцию присоединяют к отрицательному полюсу внешнего источника постоянного тока, а к положительному полюсу вспомогательный электрод, который работает как анод. При пропускании электрического тока через систему потенциал защищаемого металла смещается в отрицательную сторону, что приводит к ослаблению работы локальных анодов или превращению их в катоды, на которых восстанавливается окислитель (деполяризатор), что приводит к уменьшению или полному прекращению коррозионного разрушения. Для полного прекращения электрохимической коррозии металла его нужно катодно заполяризовать до равновесного или более отрицательного значения потенциала.
Анод подвергается активному разрушению. В качестве материала анода используют металлический лом (старые трубы, рельсы и др.). Для защиты более ответственных сооружений (газо- и нефтепроводов) используют устойчивые к растворению материалы и сплавы (графит, уголь, кремнистые чугуны, легированные медью).
Для снижения при прохождении электрического тока переходного сопротивления системы почва-анод слой почвы в непосредственной близости от анода поливают соленой водой или же анод помещают в толстый слой кокса, в который добавляют поваренную соль.
Катодную защиту внешним током применяют для защиты от коррозии подземных металлических сооружений – газо- и нефтепроводов, резервуаров, подводных поверхностей металлических сооружений – обшивки судов, свай и др. В последнее время расширилось применение катодной защиты для предупреждения коррозии заводской аппаратуры – реакторов, теплообменников, варочных котлов и др.
Катодную защиту внешним током широко применяют как дополнительное средство защиты к изоляционному покрытию. Эффективность защиты при этом значительно увеличивается, так как улучшается распределение защитного тока, который протекает в основном по обнаженным участкам металла.
Протекторная защита
Протекторная защита металлических конструкций от коррозии заключается в том, что к защищаемой конструкции присоединяют металл, потенциал которого
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
6 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
в данной коррозионной среде отрицательнее потенциала защищаемого металла. В возникшей макрогальванопаре будет растворяться преимущественно металл протектора, который посылает электроны защищаемой конструкции и катодно заполяризовывает ее. Полная защита конструкции становится возможной в том случае, если при присоединении протектора к защищаемому металлу общий потенциал гальванической макропары (протектор-изделие) достигает или становится отрицательнее равновесного потенциала защищаемого металла, что приводит к подавлению работы локальных микроэлементов на поверхности защищаемого металла. При этом коррозия изделия либо полностью прекращается, либо значительно замедляется.
e
- |
|
|
|
+ |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Fe |
|
|
Mg, Zn, Al |
|
|
|
|||
Изделие |
протектор |
|||
В качестве материала протектора чаще всего используют цинк и сплавы на основе магния, алюминия и цинка. Протектор работает эффективно, если переходное сопротивление между ним и коррозионной средой невелико. Действие протектора ограничивается определенным расстоянием. Максимально возможное удаление протектора от защищаемого сооружения зависит от электропроводности среды, разности потенциалов между протектором и защищаемой конструкцией, поляризационных характеристик. С увеличением электропроводности среды защитное действие протектора распространяется на большее расстояние.
Защитные покрытия
Самый распространенный метод защиты металлов от электрохимической коррозии – нанесение различных защитных металлических и неметаллических покрытий или превращение поверхностного слоя металла в инертное химическое соединение.
Механизм действия большинства защитных покрытий – предотвращение контакта защищаемой поверхности металла с агрессивной коррозионной средой. Защитные покрытия должны быть коррозионно-стойкими в определенных агрессивных средах, иметь прочное сцепление с основным металлом и в большинстве случаев иметь хороший внешний вид.
Все защитные покрытия можно подразделить на металлические и неметаллические, которые включают в себя химические соединения металлов и органические покрытия.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
6 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
Классификация защитных покрытий: |
|
|
|
|
Металлические |
Химические соедине- |
Неметаллические |
||
покрытия |
ния металлов |
|
покрытия |
|
Цинк, кадмий, |
Оксидные, |
|
Лаки, |
Бетон, |
никель, медь, |
оксидно- |
краски, |
цемент, |
|
свинец, олово, |
хроматные, |
резина, |
эмали, |
|
хром, алюминий, |
фосфатные, |
пластмассы, |
керамические |
|
сплавы металлов |
сульфидные |
|
битум |
плитки |
Неметаллические защитные покрытия Лакокрасочные покрытия
Неметаллические покрытия являются самым распространенным видом защиты металлов от коррозии. Основная роль неметаллического покрытия как средство защиты металлов от коррозии сводится к изоляции металлической поверхности от внешней коррозионной среды.
В качестве неметаллических покрытий для защиты металлов от коррозии наибольшее распространение получили лаки, краски, эмали, полимерные композиции.
Основными достоинствами лакокрасочных покрытий являются: дешевизна, простота нанесения, легкость восстановления разрушенного покрытия, сочетаемость с другими способами защиты, возможность получения покрытия любого цвета. К недостаткам лакокрасочных покрытий следует отнести малую термостойкость, невысокую механическую прочность, набухаемость.
Неорганические покрытия
Большинство металлов окисляются кислородом воздуха с образованием на поверхности оксидных пленок. При защите металлов от коррозии целесообразно улучшать самопроизвольно образующуюся на поверхности металла защитную оксидную пленку искусственным путем, создавая пленки обладающие более высокой коррозионной стойкостью, чем основной металл.
Существуют различные методы получения неметаллических защитных пленок на металлах. При определенной химической или электрохимической обработке можно создать на поверхности металла довольно стойкие оксидные или фосфатные пленки, обеспечивающие достаточно надежную защиту металлов от атмосферной коррозии. Особенно велико значение оксидной пленки для алюминия и магния.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
6 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
Оксидирование – наиболее простой и надежный способ защиты алюминия и магния от коррозионного разрушения. Оксидирование алюминия может быть осуществлено химическим или электрохимическим путем.
Металлические защитные покрытия
По назначению все металлические покрытия делятся на защитные, защитнодекоративные и специальные. Основная цель защитного покрытия – защита поверхности металлических изделий от атмосферной коррозии. Защитнодекоративные покрытия защищают изделия от коррозии и придают им эстетический вид. Специальные покрытия применяют для придания деталям поверхностной твердости, износостойкости, жаропрочности, отражательной способности, паяемости, электропроводности, изоляционных и других специальных свойств.
Металлы, используемые в качестве защитного покрытия, обычно обладают повышенной коррозионной стойкостью в условиях эксплуатационной среды. Причиной этой стойкости могут быть легкая пассивируемость металла (никель, хром), затруднительный разряд окислителей на катоде (цинк, кадмий, олово, свинец) или высокий окислительно-восстановительный потенциал металла (золото, серебро, родий, палладий, рений).
Классифицируя металлопокрытия по способу защиты основного металла, их обычно подразделяют на катодные и анодные.
Катодные покрытия
Это покрытия металлами, равновесные электродные потенциалы которых в данной коррозионной среде положительнее равновесного электродного потенциала защищаемого металла. Для углеродистых и низколегированных сталей это покрытия из золота, серебра, меди, свинца, олова, никеля и хрома.
Анодные покрытия
Это покрытия, равновесные электродные потенциалы которых в данной коррозионной среде отрицательнее равновесного потенциала защищаемого металла (цинк и кадмий на углеродистых и низколегированных сталях). Эти покрытия в обычных условиях защищают металл не только механически, но и электрохимически в результате протекторного действия. В образовавшемся гальваническом элементе металл покрытия становится анодом и подвергается коррозии. Обнаженные участки защищаемого металла являются катодами и коррозионному разрушению не подвергаются, пока сохраняется контакт покрытия с защищаемым металлом.
Например, в 3% ном растворе растворе хлорида натрия при частичном нарушении цинкового покрытия на железе возникает гальванопара цинк-железо. Так как равновесный потенциал железа в 3% ном растворе хлорида натрия
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
6 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
(ЕFe(OH)2/Fe = - 0,255В) значительно положительнее, чем равновесный потенциал цинка (ЕZn(OH)2/Zn = - 0,772В), то железо в этой гальванопаре будет служить катодом, а цинк – анодом. При работе такой гальванопары окисляется цинк, а на
железе протекает реакция восстановления деполяризатора (окислителя), роль которого в растворе хлорида натрия выполняет вода.
Zn – 2e + 2H2O = Zn(OH)2 + 2H+ |
|
|
2H2O + 2e = H2 + 2OH- |
|
(на железе) |
Zn + 2H2O = Zn(OH)2 + 2H2 |
|
|
Цинк, при повреждении покрытия, продолжает играть защитную роль по отношению к железу, являясь протектором. Поэтому степень пористости анодных покрытий в отличие от катодных не играет существенной роли.
Оцинкование применяют для защиты стальных изделий, соприкасающихся с пресной водой при температуре не выше 60-70ОС. Кадмирование чаще прменяют для защиты от коррозии черных и цветных металлов в условиях тропического климата и в морской воде, содержащей хлориды.
Никелевые покрытия применяют для защиты стальных изделий от коррозии и для декоративной отделки при изготовлении предметов бытового назначения. Никелевые покрытия весьма стойки в атмосфере, в растворах щелочей, что обусловлено сильно выраженной способностью никеля к пассивации в этих средах. По отношению к железу никель является катодным покрытием, поэтому для защиты стальных изделий используют толстые покрытия, исключающие наличие в них пор, либо с подслоем меди.
Вследствие сильно выраженной способности к пассивированию хром приобретает повышенную химическую стойкость и является катодным покрытием по отношению к железу. Хромовые покрытия хорошо сопротивляется атмосферной коррозии, характеризуются высокой твердостью, жаростойкостью, износостойкостью, имеют красивый внешний вид. Поэтому они широко используются в качестве защитно-декоративных и износостойких покрытий при восстановлении изношенных деталей машин, при изготовлении валов, цилиндров двигателей внутреннего сгорания и др. В связи с высокой пористостью хромовые покрытия наносят в сочетании с медью и никелем.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
6 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
ЛИТЕРАТУРА
1.Антропов Л.И., Макушин Е.М., Панасенко В.Ф. Ингибиторы коррозии металлов. Киев: Техника, 1981. 183 с.
2.Розенфельд И.Л. Ингибиторы коррозии. М.: Химия, 1977. 350 с.
3.Григорьев В.П., Экилик В.В. Химическая структура и защитное дейст-
вие ингибиторов коррозии. Ростов н/Д: Изд-во Ростов. гос. ун-та, 1978. 184 с.
4.Улиг Г.Г., Реви Р.У. Коррозия и борьба с ней. Л.: Химия, 1989. 456 с.
5.Колотыркин Я.М. Металл и коррозия. М.: Металлургия, 1985. 88 с.
Исполнитель: |
|
Дата: |
|
|
|
|
|
|
|
|
|
|
Мероприятие № |
4 |
2 |
6 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

vk.com/club152685050 | vk.com/id446425943
Подгруппа хрома
Элементы 6й группы
Лекции 8-9
vk.com/club152685050 | vk.com/id446425943
Подгруппа хрома
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
|
|
|
|
|
|
|
|
|
|
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
|
|
|
|
|
|
|
|
|
|
La |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
|
|
|
|
|
|
|
|
|
|
Cr – хром, Mo – молибден, W – вольфрам
vk.com/club152685050 | vk.com/id446425943
Подгруппа хрома
|
Cr |
Mo |
W |
Ат. № |
24 |
42 |
74 |
Эл. Конф. |
3d54s1 |
4d55s1 |
4f145d46s2 |
R(ат.), пм |
127 |
139 |
140 |
I1, эВ |
6.77 |
7.10 |
7.98 |
I2, эВ |
15.50 |
16.15 |
17.70 |
I6, эВ |
90.6 |
68.0 |
60.9 |
χ(A-R) |
1.56 |
1.30 |
1.40 |
C.O. |
2,3,(4),(5),6 |
2,3,4,5,6 |
(2),(3),(4),5,6 |

vk.com/club152685050 | vk.com/id446425943
Свойства элементов
|
Cr |
Mo |
W |
Т.пл., оС |
1860 |
2620 |
3410 |
Т.кип., оС |
2680 |
4630 |
5700 |
vH0, кДж/моль |
348.8 |
594.1 |
799.1 |
d, г/см3 |
7.23 |
10.22 |
19.30 |
E0(M3+/M0), В |
–0.74 |
–0.20 |
–0.11 |
Структурный тип α-Fe
решетка кубическая
объемоцентрированная

vk.com/club152685050 | vk.com/id446425943
Химические свойства Cr
1.Пассивируется концентрированными H2SO4, HNO3 и царской водкой при н.у.
2.Растворяется в кислотах-неокислителях и кислотахокислителях
Cr + 2HCl = CrCl2 + H2 (без доступа O2) 4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O
10Cr + 36HNO3 (разб) = 10Cr(NO3)3 + 3N2 + 18H2O
2Cr + 6H |
SO |
4 |
(конц) |
to |
Cr (SO ) + 3SO |
2 |
+ 6H O |
|
|
2 |
|
|
2 |
4 3 |
2 |
||
3. Не растворяется в щелочах

vk.com/club152685050 | vk.com/id446425943
Химические свойства Cr
4. |
Окисляется в щелочном расплаве |
|
|
|
|||||||
|
Cr + 3KNO + 2KOH = K CrO + 3KNO + H O |
400 оС |
|||||||||
|
|
|
|
3 |
|
2 |
4 |
2 |
2 |
|
|
5. |
Окисляется парами воды |
|
|
|
|
||||||
|
2Cr + 3H |
2 |
O = Cr O + 3H |
2 |
|
|
900 oC |
||||
|
|
|
2 |
3 |
|
|
|
|
|
||
6. |
Реагирует с галогенами, образуя CrX |
(всегда Cr3+) |
|||||||||
|
|
|
|
|
|
|
|
|
3 |
|
|
|
2Cr + 3F |
|
|
250 oC |
2CrF |
3 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
||
7. |
Реагирует с кислородом при нагревании |
|
|||||||||
|
4Cr + 3O |
|
= 2Cr O |
3 |
|
|
|
|
400 oC |
||
|
|
2 |
2 |
|
|
|
|
|
|
||
vk.com/club152685050 | vk.com/id446425943
Химические свойства Cr
8. Реагирует со многими неметаллами при
нагревании
Cr + S = CrS
2Cr + N2 = 2CrN
Cr + 2P = CrP2
Cr + As = CrAs
7Cr + 3C = Cr7C3 (т.пл. 1810 оС)
Cr + B = CrB (т.пл. 2100 оС)
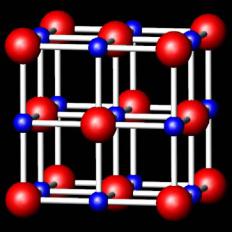
CrN
vk.com/club152685050 | vk.com/id446425943
Получение Cr
Хром – средний по распространенности элемент (0.012 мас.%)
основные минералы: FeCr2O4 хромистый железняк (Cr3+) PbCrO4 крокоит (Cr6+)
Получение технического хрома
4FeCr2O4 + 8Na2CO3 + 7O2 = 8Na2CrO4 + 2Fe2O3 + 8CO2 2Na2CrO4 + 2H2SO4 + 2KCl = K2Cr2O7 + 2NaHSO4 + 2NaCl + H2O K2Cr2O7 + 2C = Cr2O3 + K2CO3 + CO
Cr2O3 + 2Al = Al2O3 + 2Cr алюмотермия

vk.com/club152685050 | vk.com/id446425943
Получение Cr
Получение чистого хрома
Cr2O3 + 3H2SO4 = Cr2(SO4)3 + 3H2O 2Cr2(SO4)3 + 6H2O = 4Cr + 3O2 + 6H2SO4
электролиз раствора
Получение феррохрома
FeCr2O4 + 4C = Fe + 2Cr + 4CO

vk.com/club152685050 | vk.com/id446425943
Применение Cr
Ежегодное мировое производство хрома ~ ¾ млн. тонн
1.Нержавеющие стали
2.Декоративные покрытия
3.Зеркала, прожекторы
4.Нагреватели (нихром)
5.Абразивы (Cr2O3)
6.Пигменты (зеленый Cr2O3, желтый PbCrO4)
7.Ингибиторы коррозии (MgCrO4, CaCr2O7)
8.Катализаторы (на основе Cr2O3)
vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
||
Диаграмма Фроста для Cr |
||||||
2 |
pH = 0 |
|
|
Cr(V) |
|
|
1 |
|
|
|
Cr2O72– |
||
|
|
CrO2 |
|
|
||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
-1 |
|
Cr2+ |
|
|
|
|
-2 |
|
|
Cr3+ |
|
|
|
nE |
|
|
|
|
|
|
-3 |
|
|
|
|
pH = 14 |
|
-4 |
|
|
Cr(OH) – |
|
||
-5 |
|
|
|
|
|
|
|
|
4 |
|
|
CrO42– |
|
|
|
|
|
|
||
-6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
n |
|
|
|
vk.com/club152685050 | vk.com/id446425943
Соединения Cr(VI)
1. Триоксид хрома CrO3
красные кристаллы, т.пл. 197 оС
2CrO = 2CrO |
2 |
+ O |
2 |
т.разл. 205 оС |
3 |
|
|
ангидрид хромовой кислоты
CrO3 + H2O = H2CrO4
CrO3 + 2KOH = K2CrO4 + H2O растворение CrO3
CrO3
CrO42–
vk.com/club152685050 | vk.com/id446425943
Соединения Cr(VI)
2. Хромовые кислоты
H CrO H+ + HCrO |
– |
хромовая кислота |
||||
2 |
4 |
|
4 |
|
|
|
HCrO - H+ + CrO 2– |
|
|
|
|||
|
4 |
|
4 |
|
|
|
|
сильная кислота pKa1 = –0.61, pKa2 = 6.49 |
|||||
2HCrO |
– Cr O 2– |
+ H O |
дихромат, pK = –2.2 |
|||
|
4 |
2 |
7 |
|
2 |
|
2K2CrO4 + 2H2SO4 = K2Cr2O7 + 2KHSO4 + H2O
K2Cr2O7 + 2K2CO3 + H2O = 2K2CrO4 + 2KHCO3
K2Cr2O7 + 2BaCl2 + H2O = 2BaCrO4↓ + 2KCl + 2HCl
vk.com/club152685050 | vk.com/id446425943
Соединения Cr(VI)
3. Полимеризация хроматов |
|
|
||||||||
2CrO |
2– + 2H+ Cr O |
2– |
+ H O |
оранжевый |
||||||
|
4 |
|
|
2 |
7 |
|
|
2 |
|
|
3Cr O |
2– |
+ 2H+ |
2Cr O |
2– |
+ H O |
красный |
||||
2 |
|
7 |
|
|
3 |
|
10 |
2 |
|
|
4Cr O |
2– + 2H+ 3Cr |
4 |
O |
2– + H O |
красно-коричневый |
|||||
3 |
|
10 |
|
|
|
|
13 |
2 |
|
|
Cr O |
|
2– |
+ 2H+ |
4CrO ↓ + H O |
|
|||||
4 |
13 |
|
|
|
3 |
|
2 |
|
||
Cr O |
2– |
Cr O |
2– |
2– |
2 7 |
|
Cr4O13 |
||
|
|
3 |
10 |
|
r(Cr6+) < r(V5+) |
|
всегда к.ч. (Cr+6) = 4 |
||
vk.com/club152685050 | vk.com/id446425943 |
|
Соединения Cr(VI) |
|
4. Окислительные свойства хроматов |
|
4CrO3 + C2H5OH = 2Cr2O3 + 2CO2 + 3H2O |
бурно |
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O “химический вулкан”
K2Cr2O7 (тв) + 14HCl (конц) = 2CrCl3 + 3Cl2 + 7H2O + 2KCl
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 +
K2SO4 + 7H2O
FeSO4 + K2CrO4 ≠
3(NH4)2S + 8K2CrO4 + 8KOH + 20H2O = 8K3[Cr(OH)6] +
3(NH4)2SO4
сильные окислители в кислой среде, слабые – в щелочной
vk.com/club152685050 | vk.com/id446425943
Соединения Cr(VI)
5. Галоген-производные |
|
||
2CrO3 + 3F2 |
400 oC |
2CrF6 + 3O2 |
|
|
|
300 атм |
желтые кристаллы |
CrF6 = CrF5 + ½F2 |
при н.у. |
||
K2Cr2O7 |
+ 2HCl = 2KCrO3Cl + H2O |
||
K2Cr2O7 |
(тв) + 6HCl (газ) = 2CrO2Cl2 + 3H2O + 2KCl |
||
|
|
|
хромил хлорид |
[CrO3Cl]–

vk.com/club152685050 | vk.com/id446425943
Соединения Cr(V,IV)
1. Галогениды
CrF5, CrF4, CrCl4, CrBr4 только фториды устойчивы
2CrO |
+ 5F |
450 oC |
|
2CrF |
|
+ 3O |
|
т.пл. 30 оС |
||
2 |
|
|
5 |
2 |
||||||
|
3 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
красный |
|
|
||
Cr + 2F |
150 oC |
CrF |
4 |
т.разл. 200 оС |
||||||
|
|
2 |
|
|
|
|
|
|
|
|
фиолетовый
2. Оксид CrO2
черный, т.разл. 400 оС, нерастворим
CrO2
4CrO2 = 2Cr2O3 + O2
2CrO2 + 8HCl (конц) = 2CrCl3 + Cl2 + 4H2O
vk.com/club152685050 | vk.com/id446425943
Соединения Cr(V,IV)
3. Хроматы (V) и (IV)
4BaCrO4 + 2Ba(OH)2 = 2Ba3(CrO4)2 + O2 + 2H2O
2K2CrO4 + K2SO3 + 2KOH = 2K3CrO4 + H2O + K2SO4
голубой
CrO2 + Na2O2 = Na2CrO3 + ½O2
темно-зеленый
3Na2CrO3 + 5H2O = 2Cr(OH)3 + Na2CrO4 + 4NaOH
Хроматы (IV) и (V) очень сильные окислители!

vk.com/club152685050 | vk.com/id446425943
Соединения Cr(V,IV)
4. Пероксиды
2K2CrO4 + 9H2O2 + 2KOH = 2K3CrO8 + 10H2O + O2
K2CrO4 + 3H2O2 + 3NH3 = Cr(O2)2(NH3)3 + O2 + 2H2O + 2KOH
Cr(O2)2(NH3)3 + ½O2 + py = CrO(O2)2(py) + 3NH3 |
N |
K3CrO8: K3[Cr(O2)4] коричневый, Cr(V) |
|
Cr(O2)2(NH3)3 зеленый, Cr(IV) |
пиридин, py |
CrO(O2)2(py) синий, Cr(VI) |
|
[Cr(O2)2]3– Cr(O2)2(NH3)3
vk.com/club152685050 | vk.com/id446425943
Соединения Cr(III)
1. Оксид
Cr2O3 зеленый
т.пл. 2275 оС, структура корунда |
|
||||||
очень твердый, химически инертный |
|
||||||
Cr2O3 + HNO3 ≠ |
|
Cr2O3 + KOH (р-р) ≠ |
Cr2O3 |
||||
|
|
||||||
Cr2O3 |
|
|
|
|
to |
2K2CrO4 + 3KNO2 + 2H2O |
|
+ 4KOH + 3KNO3 |
|||||||
Cr2O3 |
+ 3K2S2O7 |
|
|
to |
Cr2(SO4)3 + 3K2SO4 |
|
|
|
|
|
|
||||
Cr2O3 |
+ K2CO3 |
to |
|
2KCrO2 + CO2 |
|
||
|
|
|
|
||||
Cr2O3 |
to |
|
2CrCl3 |
+ 3COCl2 |
|
||
+ 3CCl4 |
|
|
|
||||
vk.com/club152685050 | vk.com/id446425943
Соединения Cr(III)
2. Гидроксиды
Cr(NO3)3 + 3NH3 + 3H2O = Cr(OH)3↓ + 3NH4NO3
Cr(OH) |
τ CrO(OH) + H O |
«старение» |
|
3 |
2 |
|
|
Cr(OH)3 |
+ KOH + 2H2O = K[Cr(OH)4(H2O)2] |
pKa = 16 |
|
2Cr(OH)3 + 3H2SO4 = Cr2(SO4)3 + 6H2O |
pKb = 10 |
||
CrO(OH)
vk.com/club152685050 | vk.com/id446425943
Соединения Cr(III)
3. Гидролиз
K3[Cr(OH)6] + 2H2O K[Cr(OH)4(H2O)2] + 2KOH
[Cr(OH)6]3– + 2H2O [Cr(OH)4(H2O)2]– + 2OH– Cr(NO3)3 + H2O Cr(OH)(NO3)2 + HNO3
[Cr(H2O)6]3+ [Cr(OH)(H2O)5]2+ + H+
K3[Cr(OH)6] + 3CO2 = CrO(OH)↓ + 3KHCO3 + H2O
Cr(NO3)3 + 3Na2CO3 + 3H2O = Cr(OH)3↓ + 3NaNO3 +
3NaHCO3

vk.com/club152685050 | vk.com/id446425943
Соединения Cr(III)
4. Окисление и восстановление
2Cr(OH)3 + 10KOH + 3Br2 = 2K2CrO4 + 6KBr + 8H2O pH > 8
Cr2(SO4)3 + 3MnO2 + 2H2O = 2H2CrO4 + 3MnSO4 pH = 6
Cr2(SO4)3 + 2K2S2O8 + 7H2O = K2Cr2O7 + 7H2SO4 + 2K2SO4 pH = 2
CrCl3 + Zn = CrCl2 + ZnCl2
pH = 1

vk.com/club152685050 | vk.com/id446425943
Соединения Cr(III)
5. Галогениды
CrF3 |
CrCl3 |
CrBr3 |
CrI3 |
зеленый фиолетовый темно-зеленый черный |
|||
возг. 1200 оС |
возг. 1115 оС |
т.пл. 1130 |
разл. ~700 оС |
Нерастворимы в воде, растворимы в пиридине (кроме CrF3)
Cr + Br |
2 |
= CrBr |
3 |
|
|
|
|
|
|
700 оС |
|||
Cr O |
3 |
+ 3C + 3Cl |
2 |
= 2CrCl |
3 |
+ 3CO |
500 0C |
||||||
2 |
|
|
|
|
|
|
|
|
400 oC |
||||
2CrCl |
3 |
+ 3H S = Cr S |
3 |
+ 6HCl |
|||||||||
|
|
|
2 |
|
|
2 |
|
|
|
|
|||
CrCl3 + NH3 = CrN + 3HCl |
|
|
500 0C |
||||||||||
CrF3
CrCl3
vk.com/club152685050 | vk.com/id446425943
Комплексы Cr(III)
1. Гидраты
[Cr(H O) ]Cl |
3 |
|
|
[Cr(H O) ]3+ |
фиолетовый |
|||||
2 |
6 |
|
|
|
2 |
6 |
|
|
||
[CrCl(H |
O) ]Cl ·H O |
[CrCl(H O) ]2+ |
светло-зеленый |
|||||||
2 |
|
|
5 |
|
2 |
2 |
2 |
|
5 |
|
[CrCl (H |
O) ]Cl·2H O |
[CrCl (H O) ]+ |
темно-зеленый |
|||||||
2 |
2 |
|
4 |
|
2 |
2 |
2 |
4 |
|
|
[CrCl (H |
O) ]·3H O |
[CrCl (H O) ]0 |
красный |
|||||||
3 |
2 |
|
3 |
|
2 |
3 |
2 |
3 |
|
|
Cr(OH) |
|
+ 3HCl + H O = [CrCl (H O) ]+ + Cl– |
||||||||
|
3 |
|
|
|
|
2 |
2 |
2 |
4 |
|
Хромокалиевые квасцы:
K2Cr2O7 + 3SO2 + H2SO4 + 23H2O = 2KCr(SO4)2·12H2O↓

vk.com/club152685050 | vk.com/id446425943
Комплексы Cr(III)
E |
eg |
Cr3+ |
d3 (t2g3) |
Все комплексы инертны и
[Cr(H2O)6]3+ устойчивы
О
Чем больше О, тем выше
устойчивость
t2g
Вытеснение гидратной воды:
[CrCl2(H2O)4]Cl + 6KCN = K3[Cr(CN)6] + 3KCl + 4H2O
vk.com/club152685050 | vk.com/id446425943
Комплексы Cr(III)
2. Аммиакаты
CrCl3 + 6NH3 (ж) = [Cr(NH3)6]Cl3 желтый [Cr(NH3)6]Cl3 + 3HNO3 (конц) = [Cr(NH3)6](NO3)3 + 3HCl
[Cr(NH3)6]Cl3 100 oC [CrCl3(NH3)3] + NH3 зеленый 2[Cr(NH3)6]Cl2 + O2 + 2NH4Cl = 2[Cr2(OH)(NH3)10]Cl5 + 6NH3
|
розовый |
[Cr2(OH)(NH3)10]Cl5 |
+ KOH = [Cr2O(NH3)10]Cl4 + KCl + H2O |
|
синий |
[Cr2(OH)(NH3)10]Cl5 |
+ HCl = 2[CrCl(NH3)5]Cl2 + H2O красный |
транс-[CrCl (NH ) ]+ |
[Cr (OH)(NH ) ]5+ |
[Cr (OH) (NH ) ]5+ |
||||
2 |
3 4 |
2 |
3 10 |
3 |
4 |
3 10 |
vk.com/club152685050 | vk.com/id446425943
Комплексы Cr(III)
3. Хелатные комплексы
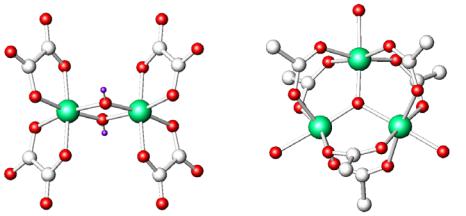
Устойчивость комплексов увеличивается при включении би- и полидентатных лигандов
K2Cr2O7 + 2K2C2O4 + 7H2C2O4 = 2K3[Cr(C2O4)3] + 6CO2 + 7H2O K2Cr2O7 + 7H2C2O4 = 2K[Cr(C2O4)2(H2O)2] +6CO2 + 3H2O 2K[Cr(C2O4)2(H2O)2] + 2KOH = K4[Cr2(OH)2(C2O4)4] + 2H2O димер
Наибольшую устойчивость имеют 5- и 6-членные циклы
3CrCl3 + 9Na(ac) + 4H2O = Cr3O(CH3COO)7·3H2O + 9NaCl + 2H(ac)
[Cr3O(CH3COO)6]+
[Cr2(OH)2(C2O4)4]4–

vk.com/club152685050 | vk.com/id446425943
Соединения Cr(II)
1. Оксид |
|
|
E |
|
|
|
|
|
|
|
dx2-y2 |
||||
CrO черный, структура NaCl |
|
|
|
|
|
|
|
dz2 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
3CrO |
700 oC Cr |
O + Cr |
|
|
|
|
|
|
|
|
|
|
|
dxy |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
2 |
3 |
|
|
|
|
|
|
|
|
|
|
|
|
dxz dyz |
2. Окисление |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
4Cr (SO ) + Zn |
H+ ZnSO + CrSO |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
4 3 |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
2CrSO4 + 2H2O = 2Cr(OH)SO4 + H2
4[Cr(H2O)6]2+ + 4H+ + O2 = 4[Cr(H2O)6]3+ + 2H2O

vk.com/club152685050 | vk.com/id446425943
Соединения Cr(II)
3. Гидроксид и соли
Cr(OH)2 желтый, только основные свойства
CrCl2 + 2NaOH = Cr(OH)2 + 2NaCl
без доступа воздуха
Cr(OH)2 + H2SO4 = CrSO4 + 2H2O
голубой [Cr(H2O)6]2+
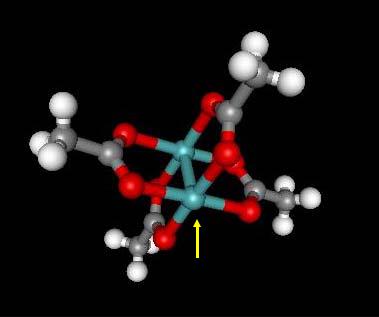
CrCl2 + 2Na(cp) = Cr(cp)2 + 2NaCl
коричневый
Cr(cp)2 cp ≡ C5H5
vk.com/club152685050 | vk.com/id446425943
Соединения Cr(II)
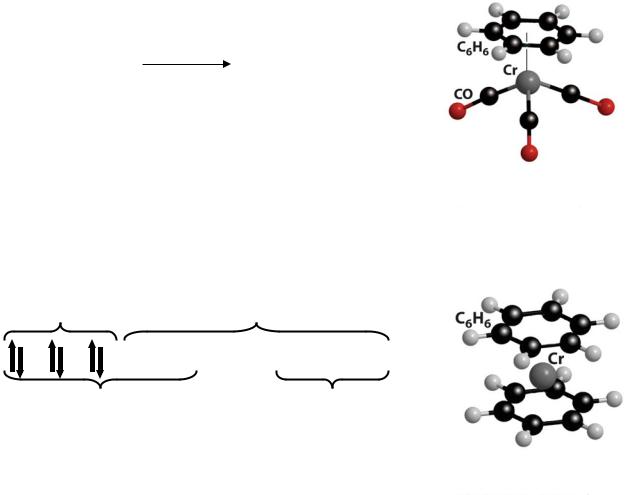
4. Ацетат хрома(II)
2CrCl2 + 4NaCH3COO = Cr2(CH3COO)4·2H2O↓ + 4NaCl
красный
H
O
C
Cr
vk.com/club152685050 | vk.com/id446425943
Соединения Cr(0)
1. Карбонил
CrCl3 (тв) + Al (тв) + CO |
THF |
Cr(CO)6 + AlCl3 |
Cr(CO)6 = Cr + 6CO разложение (200 oC)
молекулярное строение, бесцветный
Cr(CO)3(C6H6)
Cr(CO)6 + 2Na = Na2[Cr(CO)5] + CO
карбонилат-анион
|
|
|
Cr0 (d6) |
:CO (x6) |
|
||||||||||||||
Cr(CO)6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
×× ×× ×× ×× |
×× ×× |
|
|
|
|
|
|
3d |
4s |
4p |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
2. Дибензолхром
Cr(C6H6)2
CrCl3 (тв) + Al (тв) + 2C6H6 = Cr(C6H6)2 + AlCl3
коричневый
vk.com/club152685050 | vk.com/id446425943
Химические свойства Mo, W
1.Не растворяются в кислотах-неокислителях
2.Окисляются в кислой среде:
W + 2HNO3 + 8HF = H2[WF8]
Mo + 2HNO3 + 2HCl = MoO2Cl2 + 2NO + 2H2O
3. Окисляются в щелочных расплавах
Mo + 3KNO3 + 2KOH = K2MoO4 + 3KNO2 + H2O 4. Окисляются кислородом при нагревании
2Mo + 3O = 2MoO |
3 |
(400 oC) |
2 |
|
|
5. Реагируют с галогенами |
||
Mo + 3F2 = MoF6 |
|
2Mo + 5Cl2 = 2MoCl5 |
W + 3Cl2 = WCl6 |
|
2W + 5Br2 = 2WBr5 |

vk.com/club152685050 | vk.com/id446425943
Получение Mo, W
Редкие элементы: по ~10–3 мас. % в земной коре
Минералы: MoS2 |
|
|
молибденит |
сульфид |
|||||
|
|
|
|
|
CaWO4 |
|
|
шеелит |
оксиды |
|
|
|
|
|
(Fe,Mn)WO |
4 |
вольфрамит |
||
|
|
|
|
|
|
|
|
|
|
2MoS |
2 |
+ 7O = 2MoO + 4SO |
|
обжиг при 600 oC |
|||||
|
|
|
2 |
3 |
2 |
|
|
|
|
MoO |
+ 3H |
2 |
= Mo + 3H O |
восстановление при 600 oC |
|||||
3 |
|
|
|
2 |
|
|
|
|
|
4(Fe,Mn)WO4 + 4Na2CO3 + O2 = 4Na2WO4 + 4CO2 +
2(Fe,Mn)2O3 Na2WO4 + 2HCl = WO3 + 2NaCl + H2O
WO3 + 3H2 = W + 3H2O

vk.com/club152685050 | vk.com/id446425943
Применение Mo, W
-для производства жаропрочных сплавов -в радиотехнике и электронике -в авиапромышленности
-для производства сверхтвердых сплавов -в химической промышленности
-для измерения высоких (>2500 К) температур
-МоО3 в качестве катализатора -MoS2 в качестве твердой смазки
vk.com/club152685050 | vk.com/id446425943 |
|
|
|
|
|||
|
Диаграмма Фроста для Mo, W |
||||||
|
2 |
|
pH = 0 |
|
|
|
Cr |
|
|
|
|
|
|
||
|
1 |
|
|
|
WO2 |
H2MoO4 |
|
|
|
|
|
|
|||
nE |
0 |
|
|
Mo3+ |
Mo2O42+ |
|
|
-1 |
|
|
|
MoO2 |
|
H2WO4 |
|
|
|
|
|
W2O5 |
|||
|
-2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
n |
|
|
|
vk.com/club152685050 | vk.com/id446425943
Соединения Mo(VI), W(VI)
1.Наиболее устойчивая с.о. для W
2.Триоксиды MoO3 т.пл. 796 оС, WO3 т.пл. 1472 оС
светло-желтые, слоистая структура – октаэдры МО3
нерастворимы в воде |
|
|
|
MO3 + 2KOH = K2MO4 + H2O |
M = Mo, W |
||
K2MO4 |
+ 2HCl = H2MO4↓ + 2KCl очень слабые кислоты |
||
K2MO4 |
+ 2HCl (конц) = MO2Cl2 + 2H2O |
pH < 0 |
|
(NH4)6Mo7O24 = 7MoO3 + 6NH6 + 3H2O
(400 oC)
MoO42–
vk.com/club152685050 | vk.com/id446425943
Соединения Mo(VI), W(VI)
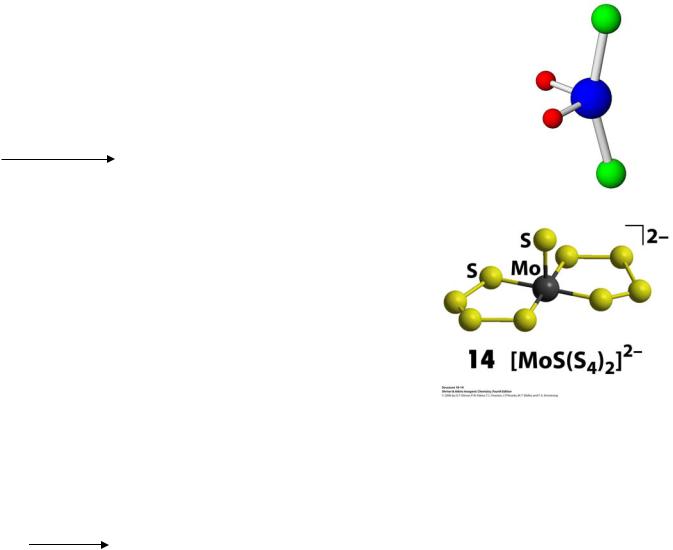
3. Галогениды MX6
молекулярная структура, гигроскопичны
MoF6 – бесцветная жидкость WF6 – светло-желтая жидкость
WCl6 – темно-синие кристаллы
WCl6 + 3H2O = WO3 + 6HCl 4. Пероксиды
MoO3 + 2KOH + 4H2O2 = K2Mo(O2)4 + 5H2O
K2Mo(O2)4 красный
K2W(O2)4 желтый
vk.com/club152685050 | vk.com/id446425943
Соединения Mo(VI), W(VI)
5. Производные молибденила, вольфрамила |
Cl |
||||||||
|
|||||||||
MoO 2+ |
молибденил, WO 2+ |
вольфрамил |
O |
|
|||||
|
2 |
|
HCl |
2 |
|
|
|
W |
|
WCl6 + 2H2O |
WO2Cl2 + 4HCl |
WO2Cl2 |
|
||||||
|
|
||||||||
MoO3 + 2HCl = MoO2Cl2 + H2O |
|
||||||||
|
|
||||||||
MoO3 + H2SO4 = MoO2(SO4) + H2O |
|
|
|||||||
2CsCl + MoO3 + 2HCl = Cs2[MoO2Cl4] + H2O |
|
|
|||||||
6. Тиосоли |
|
|
|
|
|
|
|
||
(NH4)6Mo7O24 + 21H2S + 3H2SO4 = 7MoS3↓ + 3(NH4)2SO4 |
|
||||||||
|
|
|
|
|
|
|
|
+ 24H2O |
|
K |
WO + 4H S KOH |
K WS |
4 |
+ 4H O (+ HCl → WS ↓) |
|
||||
2 |
4 |
2 |
|
2 |
|
2 |
3 |
|
|
Na2MoO4 + 4Na2S2 + S + 4H2O = Na2[MoS(S4)2] + 8NaOH
vk.com/club152685050 | vk.com/id446425943
Соединения Mo(VI), W(VI)
7. Полимеризация молибдатов, вольфраматов
7MoO |
2– |
+ 8H+ Mo O |
6– + 4H |
2 |
O |
|
pH ≈ 7 |
||
|
|
4 |
7 |
24 |
|
|
|
|
|
8Mo O |
6– + 20H+ 7Mo O |
4– + 10H |
2 |
O pH ≈ 4 |
|||||
7 |
|
24 |
|
8 |
26 |
|
|
|
|
Mo O |
|
4– + 4H+ + 6H O 8H MoO ↓ |
|
pH ≈ 1 |
|||||
8 |
26 |
2 |
|
2 |
|
4 |
|
|
|
Mo7O246– |
Mo O |
4– |
|
|
|
|
H W O |
10– |
|||||||
|
|
|
|
|
8 |
26 |
|
|
|
|
|
2 |
12 |
42 |
|
12WO |
2– |
+ 14H+ H W O |
10– |
+ 6H O |
pH ≈ 6 |
||||||||||
|
|
|
4 |
|
2 |
12 |
42 |
|
|
2 |
|
|
|
||
H W O |
10– |
+ 4H+ H W O |
6– + 2H O |
pH ≈ 3 |
|||||||||||
2 |
|
12 |
42 |
2 |
12 |
40 |
|
|
|
2 |
|
|
|||
5H |
2 |
W O |
6– |
+ 6H+ 6W O |
4– |
+ 8H |
2 |
O |
pH ≈ 2 |
||||||
|
12 |
40 |
|
10 |
32 |
|
|
|
|
|
|
||||
W O |
4– |
+ 4H+ + 8H O 10H |
2 |
WO ↓ |
|
|
pH ≈ 1 |
||||||||
10 |
32 |
|
2 |
|
|
|
|
4 |
|
|
|
|
|||

vk.com/club152685050 | vk.com/id446425943
Гетерополисоединения Mo(VI), W(VI)
1. Анионы Кеггина
12(NH4)6Mo7O24 + 51HNO3 + 7H3PO4 = 7(NH4)3[PMo12O40]·2H2O↓ + 51NH4NO3 + 22H2O
12Na2WO4 + Na2SiO3 + 22HNO3 =
Na4[SiW12O40] + 11H2O + 22NaNO3
Анионы Кеггина: |
[EM12O40]n– |
M = Mo, W |
к.ч. (Е) = 4 |
||
к.ч. (М) = 6 |
|||||
|
|
|
E = P, As |
n=3 |
|
|
|
|
E = Si |
n=4 |
|
|
|
|
E = B |
n=5 |
PO4 |
[PM |
O |
40 |
]3– |
MoO6 |
|
12 |
|
|
|
|
|
vk.com/club152685050 | vk.com/id446425943
Гетерополисоединения Mo(VI), W(VI)
2. Анионы Доусона
18Na2WO4 + 32H3PO4 = Na6[P2W18O62] + 30NaH2PO4 + 18H2O «удвоение» анионов Кеггина
3. Анионы Андерсона |
|
|
9(NH4)6Mo7O24 + 7NiSO4 + 7H2O2 |
= 7(NH4)6[NiMo9O32] + |
|
Ni2+ → Ni4+ октаэдр |
H2SO4 + 6H2O + 6(NH4)2SO4 |
|
d6 |
(t 6) |
|
|
|
2g |
E
eg
d6





 t2g
t2g
[P2W18O62]6– [NiMo9O32]6–
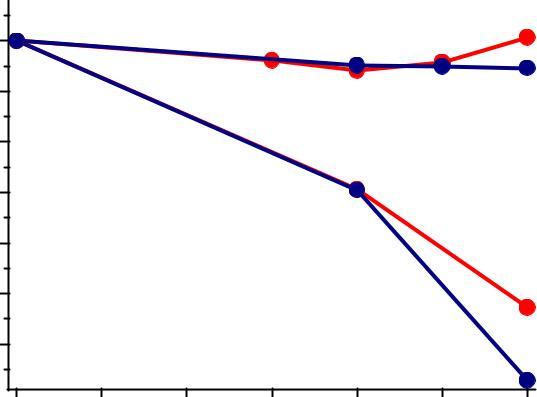
vk.com/club152685050 | vk.com/id446425943
Восстановление соединений Mo(VI), W(VI)
|
0 |
|
|
pH=0 |
|
Mo |
|
|
-1 |
|
|
|
|
W |
|
|
-2 |
|
|
|
|
|
|
nE |
-3 |
|
|
pH=14 |
|
Mo |
|
-4 |
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
-5 |
|
|
|
|
W |
|
|
-6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
n
Восстановление возможно только в кислой среде
vk.com/club152685050 | vk.com/id446425943
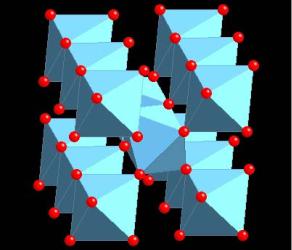
Сини и бронзы
1. Молибденовые сини
5Na2MoO4 + H2S + 10HCl = Mo5O14↓ + S + 6H2O + 10NaCl
5Na2MoO4 + SnCl2 + 12HCl = Mo5O14↓ + Na2SnCl6 + 6H2O + 8NaCl
основные составы синей: Mo5O14, Mo9O26, Mo8O23·8H2O, Mo5O13·2H2O, Mo2O4(OH)2
Mo5O14 (3MoO3·Mo2O5),…
2. Вольфрамовые бронзы |
|
|
|
|
|
|||
|
|
|
x=0 |
|||||
WO3 + xNa |
to |
NaxWO3 |
тип перовскита |
|
||||
|
|
фиолетовый |
||||||
3xNa WO + (6-4x)WO + xW to |
6Na WO |
3 |
3 |
|
||||
2 |
4 |
|
3 |
|
x |
WO |
|
|
Na WO |
4 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
x |
красный |
|
Na2W3O10 |
|
H2 |
NaxWO3 |
|
|
Na |
||
|
|
|
|
|||||
|
to |
|
|
|
||||
Na10H2W12O40 |
|
|
|
|
желтый |
|||
|
|
|
|
|
||||
|
|
|
|
|
|
|
x=1 |
|
vk.com/club152685050 | vk.com/id446425943
Соединения Mo(V,IV) и W(V,IV)
1. Оксиды и гидроксиды
(NH4)6Mo7O24 + 20HCl + 7Zn + 4H2O = MoO2·2H2O↓ +
|
|
|
|
6NH4Cl + 7ZnCl2 |
WO + H |
2 |
= WO + H O 600 oC |
||
3 |
|
2 |
2 |
|
MoO2, WO2 |
|
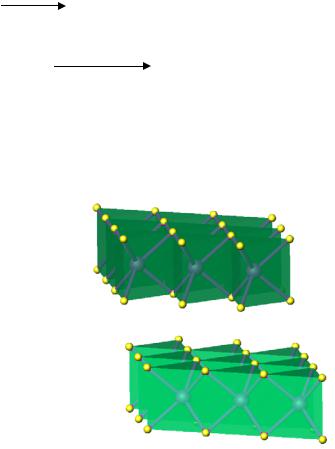
искаженная структура рутила |
||
|
|
|
|
только основные свойства |
Кристаллическая структура рутила

vk.com/club152685050 | vk.com/id446425943
Соединения Mo(V,IV) и W(V,IV)
2.Комплексы
3MoO2 + 2H2C2O4 + K2C2O4 + H2O =
K2[Mo3O4(C2O4)3(H2O)3]
Наиболее устойчивы комплексы с
лигандами сильного поля или хелатными
[MoV(CN)8]3–, [MoIV(CN)8]4–, [W3O2(CH3COO)6(H2O)3]2–
MoO(HSO4)(SO4)

vk.com/club152685050 | vk.com/id446425943
Соединения Mo(V,IV) и W(V,IV)
3. Галогениды и оксогалогениды |
|
|||||||||
|
MoF5 MoF4 WF5 |
WF4 |
Все гигроскопичны, |
|||||||
|
MoCl5 MoCl4 WCl5 |
WCl4 |
||||||||
|
|
MoBr4 WBr5 |
WBr4 |
к.ч. = 6 (октаэдр) |
||||||
|
|
|
||||||||
|
|
|
|
|
|
WI4 |
|
|
||
2WCl6 + H2 |
400 oC |
2WCl5 + 2HCl |
||||||||
MoO |
2 |
+ CCl |
4 |
450 oC |
MoCl |
4 |
+ CO |
2 |
||
|
|
|
|
|
|
|
||||
W(CO) + 2Cl |
C6H6 |
WCl |
4 |
+ CO |
2– |
|||||
|
|
6 |
|
2 |
|
|
|
|
[MoOCl5] |
|
(NH4)6Mo7O24 + 8NH4I + 35HCl = 7(NH4)2[MoOCl5] + 7/2I2 + 17H2O + HI
vk.com/club152685050 | vk.com/id446425943
Соединения Mo(V,IV) и W(V,IV)
4. Сульфиды
2K2[MoOCl5] + 5H2S = Mo2S5↓ + 4KCl + 6HCl + 2H2O
to |
MoS2 |
|
|
|
|
Mo + S2 |
|
|
|
||
2WO + 7S |
K CO |
|
2WS |
|
+ 2SO |
2 o |
3 |
2 |
|||
3 |
t |
|
|
2 |
|
MoS2, WS2 слоистая структура, полупроводники, твердая смазка
MoS2

vk.com/club152685050 | vk.com/id446425943
Соединения Mo(III), W(III)
1.Более устойчивы соединения Mo(III), оксиды неизвестны
2.Известны все MX3, кроме WF3
MoCl5 + H2 = MoCl3 + 2HCl |
(250 oC) |
|
|||
3Mo + 3Br2 = 2MoBr3 |
(350 oC) |
|
|||
2W(CO) |
6 |
+ 3I |
= 2WI + 12CO |
(150 oC) |
|
|
2 |
3 |
|
MoBr3 |
|
3. Галогенидные комплексы |
|
||||
|
|
||||
2MoO2Cl2 + 8HCl + Zn = 2H3MoCl6 + 3ZnCl2 + 4H2O 2Na2MoO4 + 16HCl + 3Zn = 2Na2[MoCl5(H2O)] + 6H2O +
|
|
|
3ZnCl2 |
|
2WCl3 + 3CsCl = Cs3W2Cl9 |
|
|||
4. Другие комплексы |
d3 октаэдр |
t2g3 |
||
[Mo(H O) ]3+, |
[Mo(HCOO) ]3– |
|
||
2 |
6 |
|
6 |
W2Cl93– |
|
2– |
|
3– |
|
[Mo2(HPO4)4] , |
[Mo(SCN)6] |
|
||
vk.com/club152685050 | vk.com/id446425943
Низшие с.о. Mo, W
1.Оксиды и оксокомплексы неизвестны
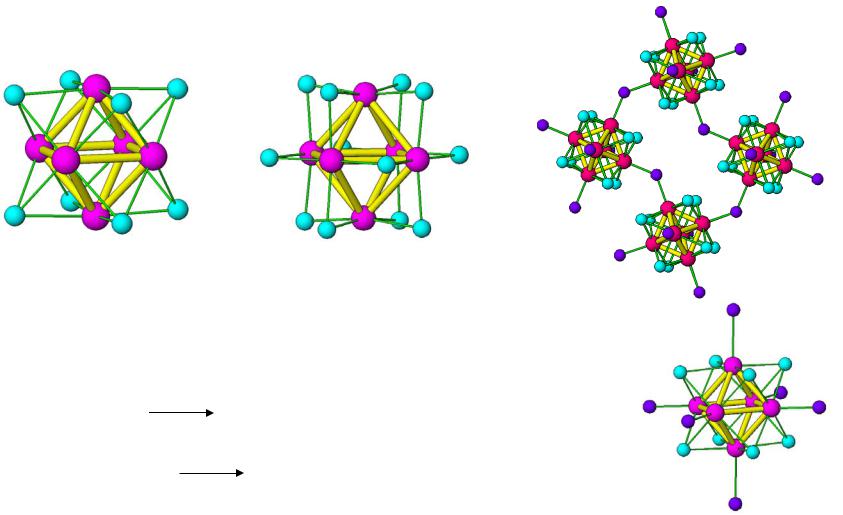
2.Кластерные галогениды Mo, W
M6X8
M6X12
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
MoCl2 |
Mo + COCl2 = MoCl2 + CO |
|
|
|
|
[Mo6Cl8]Cl4 |
||||||||||||
6MoCl2 |
+ 4AgNO3 |
= [Mo6Cl8](NO3)4 + 4AgCl |
|
||||||||||||||
6WCl |
2 |
+ 2Cl |
2 |
CCl4 |
W Cl |
16 |
|
[W Cl |
12 |
]Cl |
4 |
|
|||||
|
|
|
|
|
6 |
|
|
|
6 |
|
|
|
|||||
6MoCl |
2 |
+ 2CsCl HCl Cs Mo Cl |
14 |
[Mo Cl ]Cl 2– |
|||||||||||||
|
|
|
|
|
|
|
2 |
6 |
|
|
|
6 |
8 |
6 |
|||
WCl |
2 |
+ 4H O = H WO + 2H |
2 |
+ 2HCl |
|
|
[Mo6Cl8]Cl62– |
||||||||||
|
|
|
2 |
|
2 |
4 |
|
|
|
|
|
|
|
|
|
||

vk.com/club152685050 | vk.com/id446425943
Низшие с.о. Mo, W
3. Соединения с кратными связями
2Mo(CO)6 + 4CH3COOH = Mo2(CH3COO)4 + 2H2 + 12CO Mo2(CH3COO)4 + 4KCl + 4HCl = K4[Mo2Cl8] + 4CH3COOH
K4[Mo2Cl8] + 4H3PO4 = K4[Mo2(HPO4)4] + 8HCl
K4[Mo2Cl8] + 4H3PO4 + ½O2 = K2[Mo2(HPO4)4]+6HCl+2KCl+H2O
|
Mo 4+ |
к.с. = 4 |
|
|
2 |
|
|
|
d(Mo–Mo) = 210 пм |
||
|
Mo 6+ |
к.с. = 3 |
|
|
2 |
|
|
|
d(Mo–Mo) = 225 пм |
||
Mo Cl 4– |
|
|
|
|
Mo2(CH3COO)4 |
||
2 |
8 |
|
т.субл. = 320 оС |
|
|
|
|
vk.com/club152685050 | vk.com/id446425943
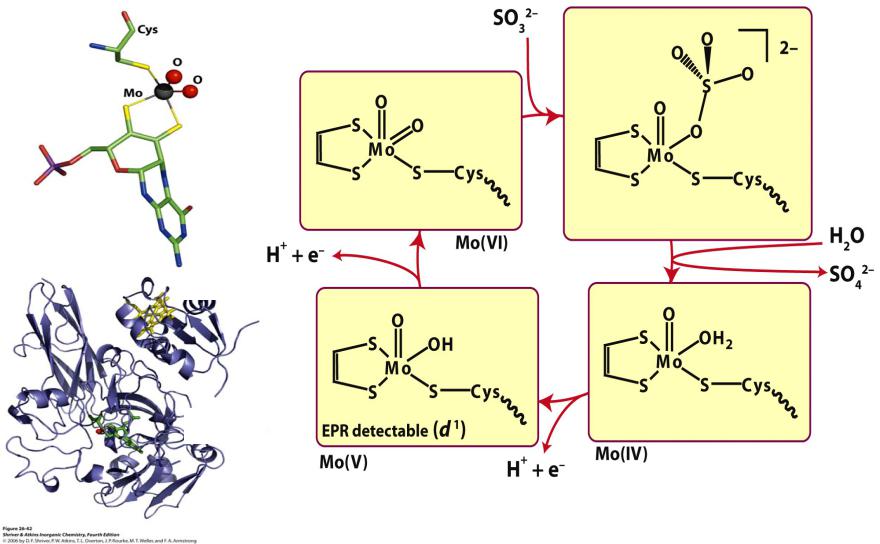
Биологическая роль Mo, W
1. Mo: катализ переноса кислорода воды для окисления сульфитов, арсенитов, альдегидов, СО
дитиолен
птерин
гем
Mo
Сульфитоксидаза
vk.com/club152685050 | vk.com/id446425943
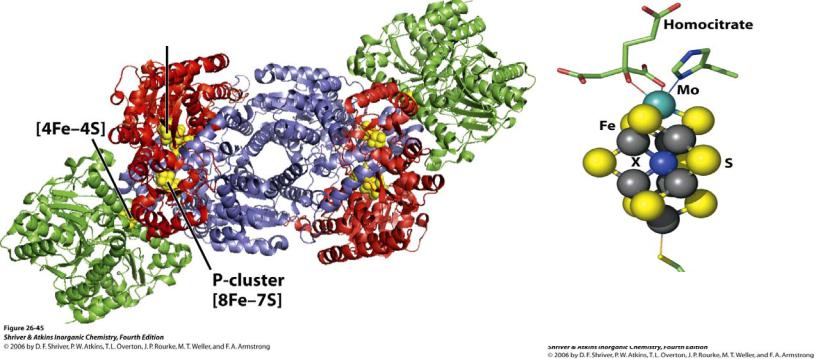
Биологическая роль Mo, W
2. Mo: катализ переноса кислорода при восстановлении нитратов
E0(NO3–/NO2–) = +0.40 В при pH = 7
3.Mo: в составе нитрогеназы для фиксации азота
4.W: катализ образования связи С–Н при нефотосинтезном поглощении СО2 простейшими организмами
Fe-Mo кофактор
Нитрогеназа Fe-Mo
vk.com/club152685050 | vk.com/id446425943
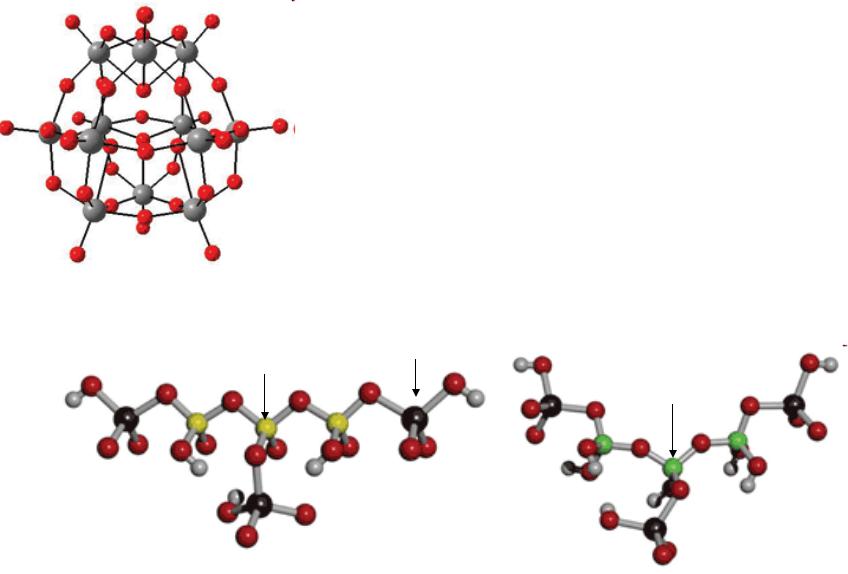
Токсичность W
Метавольфрамат (додэкавольфрамат) H2W12O406– токсичен
Проникает в воду через почву
(натриевая соль), может замещать молибден в энзимах и захватывать
фосфат или силикат, образуя цепочечные гетерополивольфраматы
Si |
W |
|
H |
|
O |
P |
|
vk.com/club152685050 | vk.com/id446425943
Тенденции в 6 группе
1.Свойства Cr отличаются от свойств Mo, W, которые менее схожи, чем Zr, Hf или Nb, Ta
2.Вниз по группе устойчивость с.о. 6 увеличивается, а низших с.о. уменьшается. Mo проявляет наибольшее разнообразие с.о.
3.С уменьшением с.о. усиливаются основные свойства, Cr(VI) проявляет только кислотные свойства, Mo, W (II, III, IV) – только основные.
4.Вниз по группе увеличивается окислительная способность элементов в с.о. +6 и восстановительная способность в с.о. +2.
5.В высших с.о. наиболее устойчивы комплексы с донорными лигандами F, O, в низших – с С, N, Cl.
6.В высших с.о. соединения Mo, W стабилизируются образованием изо- и гетерополисоединений, в низших – образованием кластеров и кратных связей M–M.
