
- •Введение
- •Обработка результатов физико-химических измерений
- •Погрешность измерений
- •Выражение результатов измерений и расчетов
- •Таблица 1
- •Содержание отчета по лабораторной работе
- •Лабораторная работа № 1. Определение кислотности нефтепродуктов методом потенциометрического титрования
- •Цель работы
- •Сущность работы
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Обработка экспериментальных данных
- •Лабораторная работа № 2. Определение кинематической вязкости нефтепродуктов
- •Цель работы
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Лабораторная работа № 3. Определение содержания солей хлоридов в нефти индикаторным титрованием
- •Цель работы
- •Сущность работы
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Лабораторная работа № 4. Определение содержания воды в нефти методом Дина-Старка
- •Цель работы
- •Сущность метода
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Лабораторная работа № 5. Определение АСП в нефти по сернокислотному способу
- •Цель работы
- •Сущность метода
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Лабораторная работа № 6. Определение карбонильного числа
- •Цель работы
- •Сущность метода
- •Оборудование и реактивы
- •Выполнение работы
- •Протокол лабораторной работы
- •Обработка результатов эксперимента
- •Содержание
vk.com/club152685050 | vk.com/id446425943
мента на некоторые их производные (lgx, 1/x и др.). Такие графики удобнее криволинейных тем, что позволяют легко и быстро производить интерполяцию (определение значения функции между ее измеренными значениями), экстраполяцию (определение значения функции за пределами измерений), графическое дифференцирование и интегрирование, находить аппроксимационные уравнения.
Если же линеаризация зависимости невозможна или по какой-либо причине нежелательна, между измеренными точками проводят плавную кривую. При построении любых графических зависимостей следует стремиться к тому, чтобы прямая или кривая проходила через большинство точек с учетом погрешности, а выпадающие точки находились равномерно по обе стороны зависимости. Толщина линий должна быть такой, чтобы она не ухудшала точности измерений и расчетов.
Обычно при физико-химических измерениях вид функциональной зависимости известен заранее из теоретических соображений. Соответственно задача исследователя сводится к определению коэффициентов уравнения и определению среднеквадратического отклонения экспериментальных данных от полученных зависимостей.
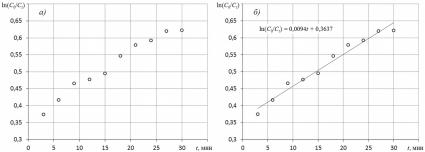
Проще всего данная задача решается при линейной зависимости между функцией и аргументом. В этом случае необходимо найти коэффициенты a и b уравнения y = ax + b. Зависимость можно обработать при помощи Microsoft Excel.
Рис. 1. Пример построения графика (а) и обработанный график с уравнением линейной зависимости
(б).
Для этого 1) выделить на графике диапазон данных; 2) в меню «диаграмма» или «макет» выбрать «добавить линию тренда»; 3) выбрать тип линии тренда «линейный»; 4) открыть вкладку «параметры линии тренда»; 5) отметить позицию «показывать уравнение на диаграмме»; 6) щелкнуть кнопку «ОК». Пример построения и обработки графических зависимостей см. на рис. 1.
Содержание отчета по лабораторной работе
1.Название работы.
2.Цель работы.
3.Ход эксперимента (см. «выполнение работы»).
4.Экспериментальные данные (см. «содержание протокола лабораторной работы»).
5.Обработка экспериментальных данных.
6.Вывод.
Лабораторная работа № 1. Определение кислотности нефтепродуктов методом потенциометрического титрования
Цель работы
определить уровень кислотности в предложенной пробе бензина.
Сущность работы
Определение уровня кислотности основано на реакции нейтрализации: Н++ОН−→Н2О. Вследствие протекания реакции потенциал стеклянного электрода постепенно понижается. Как только все ионы Н+ окажутся связанными в наступает резкий скачок потенциала. При дальнейшем добавлении щелочи потенциал электрода меняется незначительно. Электродом сравнения служит хлорсеребряный электрод. В данной работе надо получить зависимость ЭДС от объема добавленной щелочи – кривую титрования. Определить точку эквивалентности и вычислить концентрацию кислот в пробе.
5
vk.com/club152685050 | vk.com/id446425943
Оборудование и реактивы
рН-метр; Комбинированный электрод; Мерный цилиндр объемом 50 мл; Магнитная мешалка; Стакан для титрования объемом 100 или 200 мл; Стакан для щелочи объемом 50 мл; Бюретка для титрования объемом 25 мл; Гидроксид натрия, 0,05 М спиртовый раствор; Разбавитель – смесь хлороформа и этилового или пропилового спирта; Проба бензина.
Выполнение работы
1.В стакан для титрования мерным цилиндром отбирают пробу бензина объёмом 50 мл.
2.В стакан с пробой помещают якорь магнитной мешалки.
3.Бюретку заполняют раствором щелочи – в бюретку помещают максимально возможный объем щелочи.
4.Проверяют отсутствие воздуха в шланге и носике бюретки, при необходимости воздух удаляют. Для этого приподнимают нос бюретки под острым углом и нажимают на шарик в шланге бюретки.
5.После того, как бюретка заполнена и воздуха в ней нет, доводят объём щелочи до отметки
«0».
6.Стакан с пробой и якорем устанавливают на магнитную мешалку и размещают под бюрет-
кой.
7.Измерительный комбинированный электрод закрепляют в лапке штатива и опускают в стакан с пробой. Электрод должен быть максимально погружен в раствор и при этом не должен мешать свободному вращению якоря.
8.Проверяют уровень пробы: боковое окошко электрода должно быть закрыто исследуемым раствором. Если это не так, то доливают разбавитель.
9.Включают рН-метр в режим измерения ЭДС и записывают показания прибора в таблицу.
10.Титруют раствором NaOH с шагом 0,5 мл до резкого изменения значения ЭДС, после которого получают значения ЭДС еще для 5 точек, прибавляя каждый раз по 0,5 мл щелочи.
11.Результаты эксперимента заносят в таблицу экспериментальных данных Протокола лабораторной работы.
Протокол лабораторной работы
1.Объем пробы, взятый для титрования Va = ___________ мл.
2.Концентрация раствора гидроксида натрия СТ = ___________ экв./л.
3.№ задачи _______.
4.Зависимость э.д.с. от объема титранта
Объем титранта V, мл |
Е, мВ |
Объем титранта V, мл |
Е, мВ |
|
|
|
|
0 |
|
11 |
|
|
|
|
|
1 |
|
12 |
|
|
|
|
|
2 |
|
13 |
|
|
|
|
|
3 |
|
14 |
|
|
|
|
|
4 |
|
15 |
|
|
|
|
|
5 |
|
16 |
|
|
|
|
|
6 |
|
17 |
|
|
|
|
|
7 |
|
18 |
|
|
|
|
|
8 |
|
19 |
|
|
|
|
|
9 |
|
20 |
|
|
|
|
|
10 |
|
|
|
|
|
|
|
Обработка экспериментальных данных
1. По данным таблицы экспериментальных данных построить кривую потенциометрического титрования
6
