
Лекция № 11 Фазовые равновесия и фазовые превращения
Механическая и термическая устойчивость вещества
В термодинамике фазой называется совокупность однородных, одинаковых по своим свойствам, частей системы. При определенных условиях разные фазы одного и того же вещества могут находиться в равновесии друг с другом, соприкасаясь между собой. Равновесие более чем трех фаз одного и того же вещества невозможно.
Переход из одной фазы в другую обычно сопровождается поглощением или выделением некоторого количества тепла, которое называется теплотой перехода.
У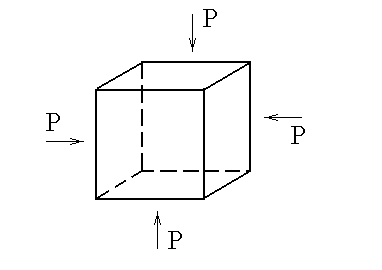 словие
механической устойчивости вещества
словие
механической устойчивости вещества
![]()
![]() ,
,
![]() и наоборот -
и наоборот -
![]() ,
,
![]() (где P
– давление, V-
объем).
(где P
– давление, V-
объем).
Условие термической устойчивости вещества
![]()
Перенос тепла
осуществляется от более нагретого тела
к менее нагретому (![]() ).
Сопровождается это понижением температуры.
Следовательно,
).
Сопровождается это понижением температуры.
Следовательно,
![]() .
Иной перенос тепла невозможен. Это
условие выполняется всегда.
.
Иной перенос тепла невозможен. Это
условие выполняется всегда.
Удельные теплоты фазовых переходов
В жидких и твердых телах всегда имеется некоторое количество молекул, энергия которых оказывается достаточной, чтобы покинуть поверхность тела и перейти в газообразную фазу.
Переход жидкости в газообразное состояние называется испарением, переход твердого тела в газообразное состояние называется сублимацией.
При испарении и сублимации тело покидают наиболее быстрые молекулы, средняя энергия оставшихся молекул уменьшается и тело охлаждается. Переход жидкости в пар сопровождается поглощением тепла.
Тепло, которое надо сообщить единице массы вещества, чтобы перевести его в другое фазовое состояние, называется удельной теплотой фазового перехода.
При испарении жидкости молекулы совершают работу против сил, действующих в поверхностном слое толщиной r
![]() ,
,
где f - средняя величина силы;
n – число молекул в единице массы.
Кроме этого, совершается работа, связанная с увеличением объема вещества
![]() ,
,
где VП - удельный объем пара;
VЖ - удельный объем жидкости.
А1 и А2 совершаются за счет теплоты испарения q.
![]() .
.
![]() с ростом Т.
Следовательно
с ростом Т.
Следовательно
![]() .
.
![]() ,
плотность молекул пара меньше, чем
жидкости.
,
плотность молекул пара меньше, чем
жидкости.
Наряду с испарением протекает и обратный переход из газообразной фазы в жидкую, называемый конденсацией.
Конденсация
жидкости увеличивается по мере возрастания
плотности молекул в пространстве над
жидкостью, т.е.
![]() .
При достижении некоторого Р
количество
молекул, покидающих жидкость равно
количеству молекул, возвращающихся в
жидкость. Плотность пара не изменяется
.
При достижении некоторого Р
количество
молекул, покидающих жидкость равно
количеству молекул, возвращающихся в
жидкость. Плотность пара не изменяется
![]() ,
,
![]() ,
где Рнас
–
давление
насыщения.
,
где Рнас
–
давление
насыщения.
В открытом сосуде испарение происходит тем быстрее, чем больше площадь открытой поверхности.
В закрытом сосуде интенсивность испарения тем больше, чем дальше от состояния насыщения пар над поверхностью жидкости.
При конденсации и . Переход сопровождается выделением тепла. Плотность жидкости больше, чем плотность пара.
Все сказанное о равновесии между жидкостью и газом справедливо и для системы твердое тело-газ.
Переход вещества
из твердого состояния в жидкое называется
плавлением,
а обратный переход – отвердеванием.
Процесс плавления происходит с поглощением
энергии и требует затраты некоторого
количества тепла, которое называют
теплотой
плавления.
Следовательно,
![]() и
и
![]() .
.
При сообщении веществу тепла его температура Т растет в зависимости от времени по следующему закону.
М ежду
жидкой и твердой фазой осуществляется
непрерывный теплообмен, приводящий к
вы-равниванию температур. Вещество в
твердом состоянии не может существовать
при Т > Тпл,
поэтому,
пока все
твердое тело не перейдет в жидкость его
Т = Тпл.
ежду
жидкой и твердой фазой осуществляется
непрерывный теплообмен, приводящий к
вы-равниванию температур. Вещество в
твердом состоянии не может существовать
при Т > Тпл,
поэтому,
пока все
твердое тело не перейдет в жидкость его
Т = Тпл.
Подводимое количество теплоты идет на выполнение работы по разрушению кристаллической решет-ки, т.е. на увеличение Wпот молекул вещества.
Величина, измеряемая
количеством теплоты, необходимым для
плавления единицы массы твердого тела
при Т = Тпл,
называется удельной
теплотой плавления
![]() .
.
Некоторые вещества могут находиться в так называемом аморфном состоянии, имеющем структуру ближнего порядка, но не обладающем основным свойством жидкости – текучестью.
При увеличении температуры эти вещества стремятся к жидкостям, и (происходит поглощение тепла).
Кристаллизация происходит при той же температуре, что и плавление. При расчете количества теплоты, выделившегося при кристаллизации, также пользуются формулой
![]() .
.
При охлаждении жидкости до температуры, когда фазы жидкого и твердого тела уравновешивают друг друга, начинается одновременный рост кристалликов вокруг зародышей или центров кристаллизации.
Центрами кристаллизации могут служить взвешенные в жидкости твердые частицы.
Процесс кристаллизации сопровождается выделением такого же количества тепла, какое поглощается при плавлении. , т.к. плотность твердого тела больше, чем жидкости.
Существуют переходы
из одной кристаллической модификации
в другую, которые не связаны с поглощением
или выделением тепла. Они называются
фазовыми
переходами второго рода.
Для них
![]() ,
,
![]() .
.
Все сказанное выше можно свести в таблицу:
Фазовые переходы |
Процессы |
Изменения |
|
теплоты |
плотности |
||
І рода |
Испарение Конденсация |
|
|
І рода |
Плавление Кристаллизация |
|
|
ІІ рода |
Структурные превращения |
|
|
