
- •Содержание:
- •Шкала электромагнитных волн
- •Э Рис. 1.То испускание электромагнитных волн за счет внутренней энергии тел.
- •Основные характеристики:
- •Энергетическая светимость
- •Пусть на элементарную площадку тела падает поток лучистой энергии
- •Закон Кирхгоффа (1859)
- •Закон Стефана-Больцмана (1884)
- •Формула Планка (1900)
- •Закон смещения Вина
- •Закон Релея-Джинса
- •Квантовое объяснение фотоэффекта
- •Некоторые характеристики фотоэффекта
- •Корпускулярный механизм передачи энергии
- •Квантовое объяснение эффекта Комптона
- •Опыты по рассеянию -частиц. Формула Резерфорда. Ядерная модель атома.
- •10-14М,
- •Линейчатые спектры атомов.
- •Гипотеза де Бройля (1923 г.)
- •Уравнение Шредингера.
- •Свойства уравнения Шредингера.
- •Частица в одномерной потенциальной яме с бесконечно высокими стенками.
- •Собственные значения волновой функции
- •Частица в прямоугольном трехмерном потенциальном ящике.
- •Понятие о вырождении энергетических уровней.
- •Одномерный потенциальный барьер.
- •Потенциальная стенка (потенциальный порог)
- •Гармонический осциллятор. Фотоны.
- •Математический аппарат квантовой механики.
- •Основные операторы квантовой механики:
- •Оператор квадрата момента импульса
- •Собственные значения и собственные функции операторов квантовой механики.
- •Средние значения физических величин.
- •Аналогично
- •Условия возможности одновременного измерения разных механических величин.
- •Соотношения неопределенностей.
- •Свободная частица.
- •Движение в центральном поле.
- •Оператор квадрата момента количества движения
- •Законы сохранения в центрально симметричном поле.
- •Собственные функции и собственные значения оператора проекции момента количества движения.
- •Уравнение Шредингера для атома водорода.
- •Уравнение Шредингера
- •Решение простейших задач в сферических координатах.
- •Правила отбора.
- •Литература.
10-14М,
3. в центре атома имеется компактный положительный заряд.
Опыт Резерфорда подтвердил планетарную модель атома и проблема радиационного коллапса остается.
Атом Бора.
Орбита
круговая, длина окружности должна быть
равна в соответствие с теорией де Бройля
целому числу длин волн электрона, это
условие стоячей волны:
![]()
Где n=1,2,3,........ г- радиус.
![]()
z - целое число протонов в ядре.
Условие стоячей волны связано с импульсом электрона:
![]()
![]() -
употребляется для сокращенной записи
величины
-
употребляется для сокращенной записи
величины
![]()
Надо
исключить зависимость
![]()
![]() ,
где
,
где
![]() или
или
![]()
![]()
Радиус зависит лишь от фундаментальных констант. Подставим в формулу для энергии:
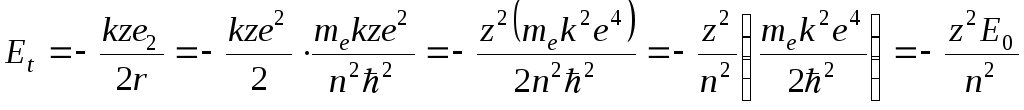

Et - величина полной энергии при условии стоячей волны принимает только определенные значения, на рис. Показаны разрешенные значения полной энергии электрона в атоме водорода.
E0 - энергия основного состояния, n - квантовое число.
Все другие значения энергии приводят к такому состоянию длины волны и радиуса орбиты, при котором электронная волна будет испытывать самогашение, т.е. не сможет существовать на этой орбите стационарно.
Cамое главное - доказательство существования наинизшего, наиболее связанного состояния!
Движение электрона с меньшей энергией не удовлетворяет условию стоячей волны м, следовательно, невозможно. В состоянии
Атом должен быть устойчивым относительно потерь на излучение. Мы имеем дело с волной!
Поэтому атом в состоянии n= 1 не излучает энергии.
n - квантовое число. При малых n квантовое свойство оказывается существенным -разрешенные уровни энергии сильно различаются по энергии (дискретные значения энергии).
При очень больших n, когда связь электрона с ядром значительно ослабевает, разность разрешенных значений энергии уменьшается и становится несущественной, то есть непрерывный спектр энергии, мы возвращаемся к представлениям классической физики. Это будет иметь место в случае любого квантового эффекта, что называется принципом соответствия.
Квантованию
подвергается не только энергия. Из
условия стоячей волны
![]()
![]() следствием волновой природы электрона
квантуется и его орбитальный момент
следствием волновой природы электрона
квантуется и его орбитальный момент
![]()
Излучение происходит дискретными порциями. Находясь на более высоком, чем основной, энергетическом уровне, электрон испытывает притяжение к положительному заряду и переходит на энергетический уровень, которому соответствует более сильное
связанное состояние.
![]()
![]()
Именно, такую энергию надо затратить, чтобы вырвать электрон из атома (эта энергия называется ионизационным потенциалом).

Энергия
связи электрона с ядром атома водорода:
![]()
Измеренное
значение:
![]() 13,588
эв , что прекрасно согласуется с
теоретическим.
13,588
эв , что прекрасно согласуется с
теоретическим.
Линейчатые спектры атомов.
Разрешённые значения разности энергии двух состояний:
![]() но
но
![]()
Все частотные излучения водорода определяются:
![]() ,
где R=Const
- постоянная, Ридберга, определяется по
спектральным линиям излучения водорода.
,
где R=Const
- постоянная, Ридберга, определяется по
спектральным линиям излучения водорода.
![]() откуда
откуда
![]()
Эту величину необходимо сравнить с
![]()
Что прекрасно согласуется с экспериментом.

Постулаты Бора.
1. Постулат стационарных орбит: электроны движущиеся по стационарным орбитам не излучают.
2. Стационарными орбитами являются те, для которых
![]() n=1,2,3,…
n=1,2,3,…
3. Постулат частот, который принял фотонный механизм излучения и поглощения света атомами:
При переходе с более удалённой орбиты на менее удалённую электрона атом излучает фотон, энергия которого
![]()
Поглощение
атомом фотона с энергией
![]() , сопровождается
переходом электрона, при котором его
энергия равна
, сопровождается
переходом электрона, при котором его
энергия равна
![]()
.
