
Кинетика Электролиза.
Стадии:
1) подвод частиц к поверхности, диффузия
2) разрядка частиц, связанная с принятием/отдачей е
3) отвод продуктов реакции
Все эти стадии могут определяться как лимитирующие.
Плотность анодного
тока i
![]() А/с функция силы тока
А/с функция силы тока
Применение электролиза:
1) в хим. Пром-ти ( производство хлора из НаХл и соды – НаОАш – едкий натр. Хлор для ядов, каучука и т.д.)
2) в металлургии – получение химически чистых свободных металлов – электрометаллургия, Эл-з водных растворов – гидроэлектрометаллургия
Эл-з расплавов и их солей - пироэлектрометаллургия
3)в технике, гальваноплоастика нанесение покрытия металлов, гальваностегия меньшее покрытие, Эл. Хим. Обработка металлов, Эл. Хим. Заточка, шлифование, спец. Обработка поверхностей.
4) сварка, для получения чистых О2 и Аш2
С нерастворимым
анодом![]()
С растворимым
анодом
![]()
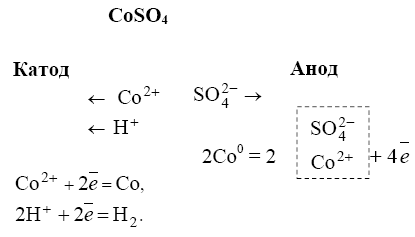
h=6,626*10-34 Дж/с e=1,6*10-19 Кл m=9,1*10-31 1 Кал=4,184 Дж 1 атм. = 101,3 КПа=101325 Па NA=6,022*1023 |
R=8,31 Дж/град*моль K=1,38*10-23 Больцмана |
Электродными или потенциал определяющими процессами называются хим. превращения, происходящие на электродах с участием заряженных частиц, в ходе которых осуществляется перенос частиц через границу раздела двух фаз.
1 з-н Фарадея. Масса итого вещества, претерпевшего электрохим. превращение на каждом из электродов, прямо пропорциональна количеству прошедшего через систему электричества. mi~qi
2 з-н Фарадея. Массы веществ, претерпевших при прохождении через различные системы электрохим. превращения, пропорциональны их массам хим. эквивалентов.
![]() по закону Фарадея
по закону Фарадея
![]()
Механизм возникновения ДЭС на межфазной границе металл-электролит.
1)подвод частиц электролита и адсорбция
2)диполь-ионное взаимодействие , к-рое сопровождается выделением энергии гидратации. Ионы Zn, окруженные молекулами воды, попадают в раствор, металл окисляется.
3)на поверхности электролита образуется избыток электронов и отрицательная обкладка, положительные ионы Zn2+ из раствора притягиваются к отрицательной обкладке, сверху на поверхности металла образуется положительная обкладка, возникает ДЭС.
4)некоторые ионы цинка принимают электроны, превращаются в атомы и встраиваются в кристаллическую решётку, т.е. процесс идет до установления равновесия.
Между металлом и раствором возникает разность потенциалов – электродный потенциал фи Нернста.
Пси – потенциал Гельмгольца – когда протекает скачок потенциала в ДЭС
А если скачок потенциала в диффузионной фазе, то это электрокинетический потенциал . =+
Чем меньше значение потенциала, тем более сильными восстановительными свойствами обладает металл. Если энергия гидратации больше энергии кристаллической решетки, то решетка разрушаться не будет, а будет достраиваться за счет адсорбции ионов металла из раствора. Будет создаваться положительная обкладка, а сверху отрицательная. Так происходит, когда фи больше 0, напр. у меди.
Электроды первого рода:
1)металлический электрод. Металл в растворе собственных ионов.
2) редокси электрод – электродная ОВР. Состоит из электродного проводника (Ме), к-рый находится в контакте с раствором, к-рый содержит и окислители, и восстановители.
3)водородный электрод – эталонный.
Электроды второго рода состоят из металла, покрытого слоем его труднорастворимой соли (или оксида, у Al), погруженного в раствор, содержащий анионы, одноименные с анионами его труднорастворимой соли (хлорсеребряный электрод, напр.).
Электроды третьего рода (относится хингидронный электрод) такой же, как водородный, только Pt опущена в раствор хингидрона
Электроды 4 рода – ионно-обменные электроды (ионно-селективные электроды, мембранные; обязательно есть мембрана)
Классификация ГЭ
1)по обратимости. ГЭ обратимый, если состоит из двух обратимых электродов
2)по наличию или отсутствию жидкостного соединения между растворами двух электродов (с переносом/без переноса). Соляной мостик, насыщенный раствор соли – тогда с переносом
3)по характеру процесса, лежащего в основе ГЭ:
- концентрационные состоят из двух одинаковых электродов (отличаются заряды ионов в растворе). Водородный – платина, переносчик – ион H+
- Химические: элемент Даниэля-Якоби.
4) по типу соединения электродов внешней цепи (ГЭ правильно разомкнутые – отличаются материалы электродов, напр. Zn и Cu соединены серебряной проволокой)
5 )по
принципу действия – ХИТы
)по
принципу действия – ХИТы
Сухие ГЭ (батарейки)
Аноды обычно Zn, Mg, Li, Na
Катоды (токопроводящие среды) MnO2, CuO, Ag2O, PbCl2.
1-анод –цинковый стаканчик, 2- Mn, 3 – Электролит, 4-стержень, графитовый электрод. 2, 3, 4 –Катод
1 2 3 4
Аккумулятор
При разряде: ГЭ.
-А. (Pb) PbPb+ +e
+К. (PbO2) PbO2+4H++2ePb2++2H2O
При разряде – Электролизёр
-К (Pb) PbSO4 + 2e Pbтв + SO4р2-
+А (PbO2) PbSO4г + 2H2Oг PbO2т +SO4р2- + 4H+р +2e
Щелочные аккумуляторы Ni-Cd, Ni-Fe;
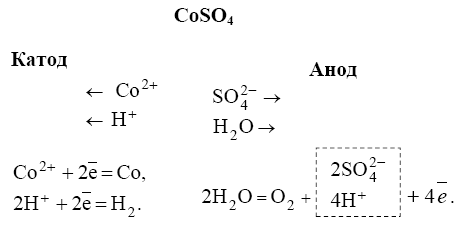
Электролиз – ОВ процессы, протекающие при прохождении электрического тока, подаваемого от внешнего источника тока, проходящего через раствор или расплав электролита.
Процессы:
1)электролиз, сопровождающийся хим. разложением электролита;
2) Электролиз, сопровождающийся хим. разложением растворителя;
3) Электролиз раствора солей ряда металлов с растворимыми анодами.
На катоде восстанавливаются в первую очередь окисленные формы ОВ систем с наибольшим положительным электродным потенциалом
На аноде окисляются в первую очередь восстановленные формы с наименьшим отрицательным электродным потенциалом.
Катодные процессы
Восстановление молекулы воды:
pH>=7. -K 2H2O + 2e H2 _ 2OH-
pH<7 -K 2H+ +2e H2
1) >0 Cu2+, Ag+, Hg2+, Au3+, o2, I2, Br2, Cl2 все галогены, PbO2, MnO4-, Cr2O72-
K: Me z+ +ze Me0, Оф +zeВф
2) <-1,7. Активные металлы Li+, Na+, K+, Ba2+
С водой. Между 2) и 3) Al3+
3) остальные все, все реакции
Сравнение ММО и МВС
С помощью них объясняется распределение электр. плотности в соединениях.
В ММО показано как образуется МО при перекрывании АО, причем прочность связи растет с увеличением эл. плотности между ядрами.
В обоих методах вводятся понятия о споривании спинов электронов.
Оба метода приближенны
В обоих методах могут образовываться сигма, пи и дельта связи
В МВС валентность атома определяется числом эл. пар. В ММО Число связей определяется как полуразность между числами связ. и разр. эл-нов.
Комплексные соединения. Анионные: K+4[Fe(CN)6]-4 гексоцианоферрат (II) калия
Катионные [Zn(NH3)2Cl]+Cl- хлоридхлордиамин цинка.
Нейтральные [Ni(CO)4]0 тетракарбонил никеля.
