
- •Пространственно-временная система отсчёта
- •Траектория, путь, перемещение, скорость, ускорение.
- •Касательное и нормальное ускорение
- •Кроме центростремительного ускорения, важнейшими характеристиками равномерного движения по окружности являются период и частота обращения.
- •Вращательное движение, угловая скорость и ускорение
- •Связь между линейными и угловыми величинами.
- •, Отсюда
- •Аналогия между уравнениями поступательного и вращательного движений
- •Законы Ньютона
- •Первый закон Ньютона (закон инерции)
- •Преобразования Галилея
- •Принцип относительности Галилея
- •Второй закон Ньютона
- •Третий закон Ньютона
- •Второй закон Ньютона для системы тел
- •Силы в механике
- •Работа и мощность силы. Диссипативные силы
- •Потенциальная энергия тела в поле гравитационной, кулоновской и упругой сил
- •Связь между потенциальной энергией и консервативной силой
- •Полная механическая энергия
- •Момент силы и импульса относительно оси
- •Момент инерции материальной точки
- •Уравнение моментов для материальной точки
- •Классификация колебаний
- •Квазиупругие силы
- •Гармонические колебания
- •Векторное и комплексное представление гармонических колебание
- •Скорость и ускорение колебаний
- •Дифференциальное уравнение гармонических колебаний или уравнение гармонического осциллятора
- •Маятники: пружинный, физический, математический. Периоды их колебаний
- •Свободные затухающие колебания пружинного маятника. Амплитуда, частота и период затухающих колебаний.
- •Характеристики колебательной системы с затуханием: логарифмический декремент колебаний и добротность колебательной системы
- •Вынужденные колебания. Резонанс.
- •Основные понятия: молярная масса и количество вещества
- •Температурные шкалы Кельвина и Цельсия
- •Нулевое начало термодинамика. Термодинамическое определение температуры
- •Уравнение состояния идеального газа или уравнение Клапейрона-Менделеева
- •Постулат Больцмана о равнораспределении энергии по степеням свободы молекулы. Полная кинетическая энергия молекулы.
- •Деление веществ на твёрдые тела, жидкости и газы. Идеальный газ
- •Внутренняя энергия идеального газа и её изменение
- •Количество теплоты. Теплоёмкость
- •Работа газа. Работа газа в изопроцессах
- •Первое начало термодинамики и его частные случаи для изопроцессов
Внутренняя энергия идеального газа и её изменение
Внутренняя
энергия
тела (обозначается как E
или U) —
полная энергия этого тела за вычетом
кинетической
энергии
тела как целого и потенциальной
энергии
тела во внешнем поле сил. Следовательно,
внутренняя энергия складывается из
кинетической энергии хаотического
движения молекул,
потенциальной энергии взаимодействия
между ними и внутримолекулярной энергии.
Внутренняя энергия является однозначной
функцией состояния системы. Это означает,
что всякий раз, когда система оказывается
в данном состоянии, её внутренняя энергия
принимает присущее этому состоянию
значение, независимо от предыстории
системы. Следовательно, изменение
внутренней энергии при переходе из
одного состояния в другое будет всегда
равно разности между ее значениями в
конечном и начальном состояниях,
независимо от пути, по которому совершался
переход. Согласно закону Джоуля,
выведенному эмпирически, внутренняя
энергия идеального
газа
не зависит от давления или объёма. Исходя
из этого факта, можно получить выражение
для изменения внутренней энергии
идеального газа. По определению молярной
теплоёмкости
при постоянном объёме,
 .
Так как внутренняя энергия идеального
газа является функцией только от
температуры, то
.
Так как внутренняя энергия идеального
газа является функцией только от
температуры, то
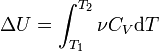 .
Эта же формула верна и для вычисления
изменения внутренней энергии любого
тела, но только в процессах при постоянном
объёме (изохорных
процессах);
в общем случае CV(T,V)
является функцией и температуры, и
объёма. Если пренебречь изменением
молярной теплоёмкости при изменении
температуры, получим: ΔU
= νCVΔT,
где ν —
количество вещества, ΔT —
изменение температуры.
.
Эта же формула верна и для вычисления
изменения внутренней энергии любого
тела, но только в процессах при постоянном
объёме (изохорных
процессах);
в общем случае CV(T,V)
является функцией и температуры, и
объёма. Если пренебречь изменением
молярной теплоёмкости при изменении
температуры, получим: ΔU
= νCVΔT,
где ν —
количество вещества, ΔT —
изменение температуры.
Количество теплоты. Теплоёмкость
Количество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основных термодинамических величин.
Количество
теплоты является функцией процесса,
а не функцией состояния,
то есть количество теплоты, полученное
системой, зависит от способа, которым
она была приведена в текущее состояние.
Теплоёмкость
тела (обычно обозначается латинской
буквой C) — физическая
величина,
определяющая отношение бесконечно
малого количества
теплоты
δQ, полученного телом, к соответствующему
приращению его температуры
δT:
![]() Единица измерения теплоёмкости в системе
СИ —
Дж/К.
Удельной теплоёмкостью называется
количество теплоты, которое необходимо
для нагревания единичного количества
вещества. Количество вещества может
быть измерено в килограммах, кубических
метрах и молях. В зависимости от того,
к какой количественной единице относится
теплоёмкость,
различают массовую, объёмную и мольную
теплоёмкость.
Единица измерения теплоёмкости в системе
СИ —
Дж/К.
Удельной теплоёмкостью называется
количество теплоты, которое необходимо
для нагревания единичного количества
вещества. Количество вещества может
быть измерено в килограммах, кубических
метрах и молях. В зависимости от того,
к какой количественной единице относится
теплоёмкость,
различают массовую, объёмную и мольную
теплоёмкость.
Работа газа. Работа газа в изопроцессах
Пусть идеальный
газ заполняет цилиндр, закрытый подвижным
поршнем. При перемещении поршня на
бесконечно малое расстояние ∆х
совершается работа A=F∆x=pS∆x=p∆V.
Где F
– сила, действующая на поршень со стороны
газа, p
– давление под поршнем, S
– площадь поперечного сечения, ∆V
- приращение объём. Работа, совершаемая
при изменении объёма газа на конечную
величину V2
– V1,
находится по общему правилу вычисления
работы:
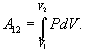 Графически работа изображается площадью
криволинейной трапеции под графиком
давления в координатах давление-объём.
Работа при изменении объёма газа
определяется не только начальным и
конечным состояниями газа, но и характером
процесса изменения объёма. Изохорным
называют процесс, происходящий при
неизменном объёме газа. При изохорном
процессе приращение объёма ∆V
= 0, поэтому и работа, совершённая газом,
равна нулю: A=0. Изобарным называют
процесс, происходящий при постоянном
давлении. Если давление в изобарном
процессе равно p1,
работа равна: A=p1(V2-V1).
Изотермическим называют процесс,
происходящий при неизменной температуре
газа. Работа при изотермическом расширении
газа равна:
=
RTинтеграл(dV/V)=
RTlnV2/V1.
Адиабатическим называют процесс,
происходящий без подвода и отвода тепла.
При адиабатическом расширении газ
совершает работу за счёт убыли его
внутренней энергии: A=U1-U2
Графически работа изображается площадью
криволинейной трапеции под графиком
давления в координатах давление-объём.
Работа при изменении объёма газа
определяется не только начальным и
конечным состояниями газа, но и характером
процесса изменения объёма. Изохорным
называют процесс, происходящий при
неизменном объёме газа. При изохорном
процессе приращение объёма ∆V
= 0, поэтому и работа, совершённая газом,
равна нулю: A=0. Изобарным называют
процесс, происходящий при постоянном
давлении. Если давление в изобарном
процессе равно p1,
работа равна: A=p1(V2-V1).
Изотермическим называют процесс,
происходящий при неизменной температуре
газа. Работа при изотермическом расширении
газа равна:
=
RTинтеграл(dV/V)=
RTlnV2/V1.
Адиабатическим называют процесс,
происходящий без подвода и отвода тепла.
При адиабатическом расширении газ
совершает работу за счёт убыли его
внутренней энергии: A=U1-U2
U1- внутренняя энергия газа в начальном состоянии, U2- внутренняя энергия в конечном состоянии.
