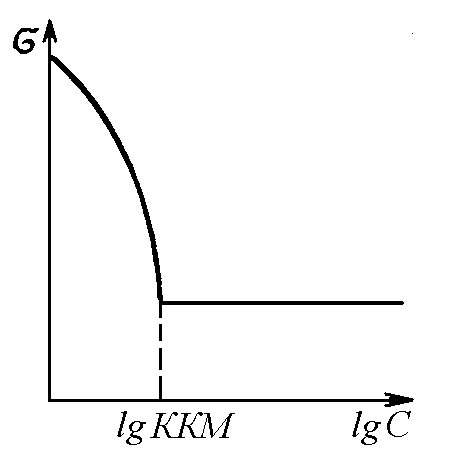Определение критической концентрации мицеллообразования.
Поверхностно-активные вещества, классификация.
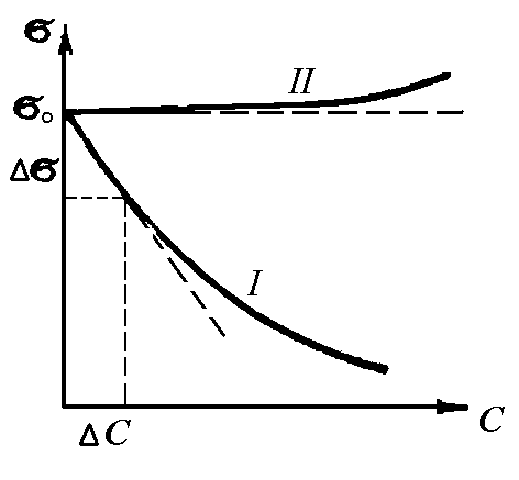
По изменению поверхностного натяжения вещества делят на поверхностно-активные и поверхностно-инактивные. Важнейшей адсорбционной характеристикой веществ, определяющей многие их свойства и области применения является поверхностная активность, обозначается символом G, в честь Гиббса. Чем сильнее уменьшается поверхностное натяжение () с увеличением концентрации (с) адсорбируемого вещества, тем больше поверхностная активность этого вещества: G = - d /dc.
Органические вещества, снижающие поверхностное натяжение (поверхностную энергию) вследствие адсорбции на границе раздела фаз, называют поверхностно-активными веществами. Для них характерны кривые типа I (рис. 1).
|
Графики зависимости поверхностного натяжения () от концентрации (с) веществ дают два основных типа кривых (рис. 1). Вещества, повышающие поверхностное натяжение () при растворении, дают кривые типа II и называются поверхностно-инактивными.
Рис. 1. Зависимость поверхностного натяжения () от равновесной концентрации (с). |
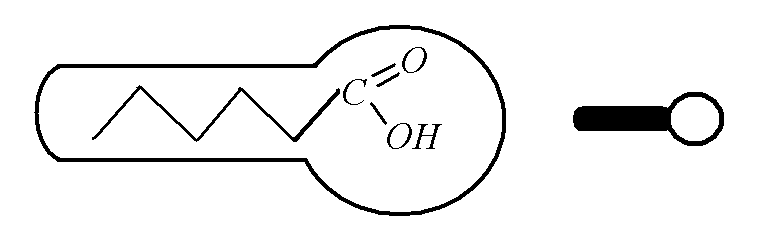
Термин «поверхностно-активные вещества» (ПАВ) обычно применяют к специфическим веществам, обладающим очень большой поверхностной активностью по отношению к воде. Поверхностно-активные вещества имеют дифилъное строение, то есть они содержат в молекулах одновременно гидрофобную и гидрофильную группы. В качестве гидрофобной группы обычно выступает углеводородный радикал, содержащий 10–18 углеродных атомов, чаще всего линейного строения. К гидрофильным группам могут относиться –СООН, –COONa, –S03Na, –ОН, –NH2 и другие. Чаще всего молекулу поверхностно-активного вещества изображают в виде палочки с утолщением на конце (рис. 2).
|
Рис. 2. Модель молекулы ПАВ |
Примером поверхностно-инактивных веществ по отношению к воде являются электролиты, то есть вещества, диссоциирующие на ионы, и более полярные, чем вода: неорганические соли, кислоты, щелочи, которые сильно гидратируются. Они взаимодействуют с водой сильнее, чем молекулы воды между собой. В случае органических растворителей свойства веществ обращаются: электролиты выступают поверхностно-активными веществами, а вещества, молекулы которых имеют дифильное строение и включают большой углеводородный радикал – являются поверхностно-инактивными веществами.
Правило Дюкло–Траубе: поверхностная активность увеличивается с увеличением длины углеводородного радикала ПАВ для полярных растворителей (вода). Правило обращается для органических растворителей.
Наличие гидрофильной и олеофильной частей у молекул ПАВ является характерной отличительной особенностью их строения. По способности к диссоциации в водных растворах поверхностно-активные вещества делят на ионогенные и неионогенные.
В свою очередь ионогенные ПАВ в зависимости от характера образующихся при диссоциации в водных растворах ионов, обеспечивающих поверхностную активность, можно разделить на анионо-активные и катионо-активные. Кроме того, имеются еще и амфолитные или амфотерные, ПАВ, которые содержат в молекуле две активные группы – анион и катион.
Из поверхностно-активных веществ большую по численности группу составляют анионные ПАВ. Они широко применяются для производства синтетических моющих средств (CMC). Катионоактивные вещества по сравнению с анионоактивными и неионогенными вырабатывают в промышленности в меньшем количестве, так как катионные ПАВ — наиболее токсичные и наименее биологически разлагаемые из всех ПАВ; их часто используют в качестве бактерицидных, фунгицидных, дезинфицирующих веществ, ингибиторов коррозии.
Амфолитные ПАВ содержат две функциональные группы, одна из которых имеет кислый, а другая основный характер, например карбоксильную и аминную группы. В зависимости от рН среды амфолитные ПАВ проявляют анионоактивные или катионоактивные свойства:Error: Reference source not found
RNН(СН2)n СООˉˉ + Н2О анионоактивные свойства |
+ ОН– ––– щелочная среда |
RNH(СН2)nСООН |
+ Н+ ––– кислая среда |
RN+ H2 (СН2)n СООН катионоактивные свойства |
Амфолитные ПАВ хорошо растворимы в воде, но их растворимость уменьшается с увеличением числа углеродных атомов в цепи. Они являются ингибиторами коррозии, а также обладают солюбилизирующей способностью по отношению к органическим соединениям и диспергирующей способностью в отношении пигментов.
Неионогенные ПАВ в водном растворе не образуют ионов. Синтезированы на основе оскиэтилена. Их растворимость в воде обусловлена функциональными группами, имеющими гидрофильный характер. В отличие от ионогенных ПАВ в гомологических рядах этих соединений может изменяться не только гидрофобная, но и гидрофильная часть молекулы. Этим и объясняется большое разнообразие их свойств.
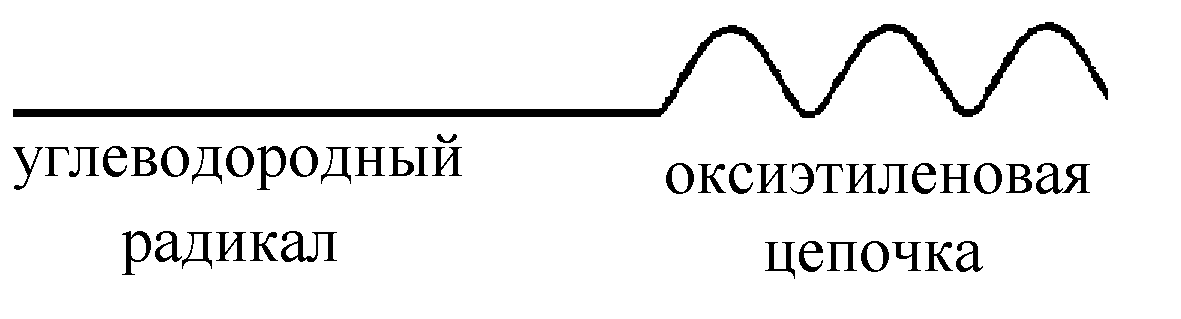
Схематически молекула неионогенного ПАВ обозначают следующим образом:
|
Рис. 3. Схема молекулы неионогенного ПАВ. |
Полиоксиэтиленовая цепь определяет гидрофильные свойства неионогенных ПАВ. Изменяя длину полиоксиэтиленовой цепи, легко регулировать их коллоидно-химические свойства. Эти ПАВ применяются в любых средах (кислой и щелочной), а также в присутствии растворимых солеи.
К недостаткам этих ПАВ относится медленное разложение из-за наличия в их составе ароматического радикала и, как следствие, накопления их в объектах окружающей среды. Неионогенные ПАВ с алкильными радикалами способны биологически разлагаться достаточно полно и быстро.
В последнее время все шире применяют высокомолекулярные ПАВ. Это растворимые карбо- и гетероцепные полимеры ионогенного или неионогенного типа. К ним могут относиться природные соединения (белки, пектиновые вещества), производные целлюлозы и синтетические полимеры. Высокомолекулярные ПАВ получают в основном из полимеров полимераналогичным превращением
Неионогенные ПАВ в водном растворе не образуют ионов. Синтезированы на основе оскиэтилена.
Адсорбция на границе раздела фаз.
Молекулы ПАВ содержат одновременно гидрофильную часть, которая легко взаимодействуют с водой, и гидрофобную часть, которая стремиться «оттолкнуться» от воды, поэтому они располагаются на границе раздела фаз (вода–масло, вода–воздух) таким образом, что гидрофильные группы направлены к воде и растворены в ней, а гидрофобные – выталкиваются из нее.
В отличие от молекул и ионов, адсорбционное равновесие на границе раздела фаз достигается медленно, даже для такой подвижной границы как ПАВ–воздух, время установления равновесия достигает 40–50 минут.
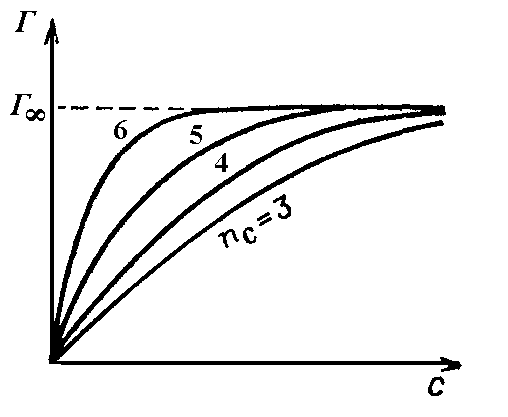
Кривые зависимости адсорбции от концентрации (Г-с) называются изотермами адсорбции и имеют характерный вид, изображенный на рис. 3. По мере увеличения концентрации (с) адсорбция (Г) возрастает сперва резко, затем все медленнее, асимптотически приближаясь к некоторому пределу. Адсорбция возрастает с удлинением цепи в гомологическом ряду, но для всех членов ряда кривые стремятся к одному и тому же предельному значению (Г∞), называемому предельной адсорбцией.
|
Рис. 4. Семейство изотерм адсорбции на границе раствор – газ для гомологического ряда. 3 – пропионовая; 4 – масляная; 5 – изовалериановая; 6 – капроновая кислота. |
Существование этого предельного значения объясняется тем, что тонкий поверхностный слой при высоких концентрациях ПАВ в растворе насыщается молекулами ПАВ. Однако факт постоянства (Г∞) для всех членов ряда, на первый взгляд, удивителен, так как он означает, что на единице площади поверхностного слоя в пределе помещается одно и то же число адсорбированных молекул, независимо от их длины. Этот факт, установленный экспериментально (а также другие данные по поверхностным слоям), позволил Лэнгмюру (1915г.) выдвинуть представление об ориентации адсорбированных молекул в поверхностном слое.
Лэнгмюр исходил из того, что молекулы ПАВ состоят из двух частей – полярной (например, -СООН, -СН20Н, -NН3ОН) и неполярного радикала, обладающего слабым молекулярно-силовым полем. Лэнгмюр сформулировал принцип независимости поверхностного действия, заключающийся в том, что при адсорбции полярная группа, обладающая большим сродством к полярной фазе – воде, втягивается в воду, в то время, как неполярный радикал выталкивается в неполярную фазу. Происходящее при этом уменьшение свободной поверхностной энергии ограничивает размер поверхностного слоя толщиной в одну молекулу. Образуется так называемый мономолекулярный слой. При малых концентрациях (с) в области, далекой от насыщения, углеводородные цепи, вытолкнуты в воздух, «плавают» на поверхности воды, тогда как полярная группа погружена в воду (рис. 5, а); такое положение возможно из-за гибкости углеводородной цепи.
|
Рис. 5. Схема образования мономолекулярного слоя |
С ростом концентрации (с) число молекул в поверхностном слое увеличивается, цепи поднимаются и в пределе приобретают вертикальное положение (рис. 5, б). В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой углеводородными цепями; значение поверхностного натяжения () при этом уменьшается, приближаясь к значению, характерному для чистого жидкого ПАВ на границе с воздухом.
Существование такого мономолекулярного слоя, обладающего плотнейшей «упаковкой» («молекулярного частокола») хорошо согласуется с фактом постоянства предельной адсорбции (Г∞), для всех членов ряда. Действительно, только при вертикальной ориентации изменение длины цепи не изменяет площади, занятой молекулой в поверхностном слое, и, следовательно, не изменяет числа молекул, приходящихся на единицу площади, пропорционального (Г∞). Представления Лэнгмюра о структуре поверхностных слоев были в дальнейшем подтверждены рентгенографически.
Мицеллообразование
Все дифильные поверхностно-активные вещества относительно поведения их в воде делят на истинно растворимые и коллоидные.
К первой группе относится большой класс растворимых в воде дифильных органических соединений с небольшим углеводородным радикалом, например низшие спирты, фенолы, кислоты и их соли, амины. Вещества этого типа в растворе находятся в молекулярно-дисперсном состоянии вплоть до концентраций, соответствующих их насыщенным растворам и разделению системы на две сплошные фазы.
Особый интерес представляют коллоидные поверхностно-активные вещества. Именно они в первую очередь понимаются под термином ПАВ. Главной отличительной особенностью этих веществ является способность образовывать термодинамически устойчивые (лиофильные) гетерогенные дисперсные системы (ассоциативные или мицеллярные коллоиды). К основным свойствам коллоидных ПАВ, обусловливающим их ценные качества и широкое применение, относятся:
высокая поверхностная активность;
способность к самопроизвольному мицеллообразованию;
способность к солюбилизации;
высокая способность стабилизировать различные дисперсные системы.
Мицеллообразование – образованию лиофильных коллоидных растворов при концентрации ПАВ выше некоторого определенного значения, называемого критической концентрацией мицеллообразования (ККМ).
Критическая концентрация мицеллообразования ККМ – минимальная концентрация ПАВ, при которой образуются мицеллы (супрамолекулярные ансамбли).
ККМ лежит в пределах 10-5–10-2 моль/л.
Растворы коллоидных ПАВ являются классическим примером лиофильных гетерогенных систем – самопроизвольно образующихся равновесных систем с минимумом энергии Гиббса, несмотря на огромную межфазную поверхность.
Под мицеллой ПАВ понимают ассоциат дифильных молекул, лиофильные группы которых обращены к соответствующему растворителю, а лиофобные группы соединяются друг с другом, образуя ядро мицеллы. Число молекул, составляющих мицеллу, называют числом ассоциации, а общую сумму молекулярных масс молекул в мицелле, или произведение массы мицеллы на число Авогадро – мицеллярной массой. Лиофильные мицеллярные системы являются обратимыми, то есть при разбавлении растворов мицеллы распадаются на молекулы или ионы, и система переходит в истинный раствор.
|
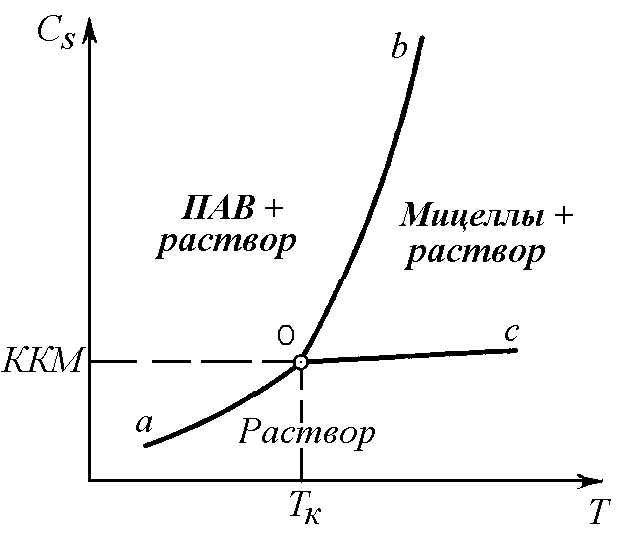
Рис. 5. Фазовая диаграмма раствора коллоидного ПАВ. СS — растворимость ПАВ в воде
Если величина ККМ характеризует нижний предел концентрационной области существования мицеллярных растворов, то (ТК) – нижний температурный предел. |
Многие ПАВ с большими углеводородными радикалами из-за плохой растворимости не образуют мицеллярных растворов. Однако при изменении температуры растворимость ПАВ может увеличиваться и обнаруживается мицеллообразование. Температуру, при которой резко увеличивается растворимость ПАВ вследствие образования мицелл, называют точкой Крафта (1896 г.). Как следует из определения, точка Крафта ТК отвечает ККМ на фазовой диаграмме коллоидного ПАВ (рис. 6.7).
Кривая (оа) на фазовой диаграмме соответствует температурной зависимости истинной растворимости ПАВ, которая медленно растет до точки Крафта. Эта кривая отвечает равновесию между чистым ПАВ (или его гидратом) и истинным раствором ПАВ. Кривая (оb) показывает зависимость мицеллярной растворимости от температуры (равновесие между чистым ПАВ и его мицеллярным раствором). Участок (ос) отвечает изменению ККМ от температуры (равновесие между мицеллами и мономерами ПАВ). Таким образом, точка Крафта (ТК) является тройной точкой на фазовой диаграмме ПАВ–растворитель/вода. В этой точке существует равновесие между тремя фазами: чистое ПАВ–мицеллярный раствор–истинный раствор ПАВ. Точка Крафта снижается с уменьшением углеводородного радикала, его разветвлением, при наличии кратных связей, с введением полярных групп, то есть с увеличением растворимости ПАВ.
Обратимость лиофильных мицеллярных систем заключается в том, что при разбавлении растворов мицеллы распадаются на молекулы или ионы, и система переходит в истинный раствор.
Наиболее резко точка излома выявляется на изотерме, построенной в координатах ( – lg c) (для неионогенных ПАВ) или ( – lg c) (для ионогенных ПАВ) (рис. 6). При полном заполнении монослоя (Г∞), постоянному значению поверхностного натяжения () соответствует постоянное значение химического потенциала ПАВ в растворе, что определяет процесс мицеллообразования как процесс образования новой фазы.
|
Рис. 6. Изотерма поверхностного натяжения коллоидных ПАВ, иллюстрирующая начало мицеллообразования в точке ККМ |
Установлено, что мицеллообразованию предшествует ассоциация молекул ПАВ в димеры, тримеры и так далее. Однако для водных растворов ПАВ наличие резких изломов в области ККМ на кривых физико-химическое свойство – концентрация служит достаточным основанием принимать во внимание только два состояния ПАВ в растворе. Это мономерное и мицеллярное состояния ПАВ.
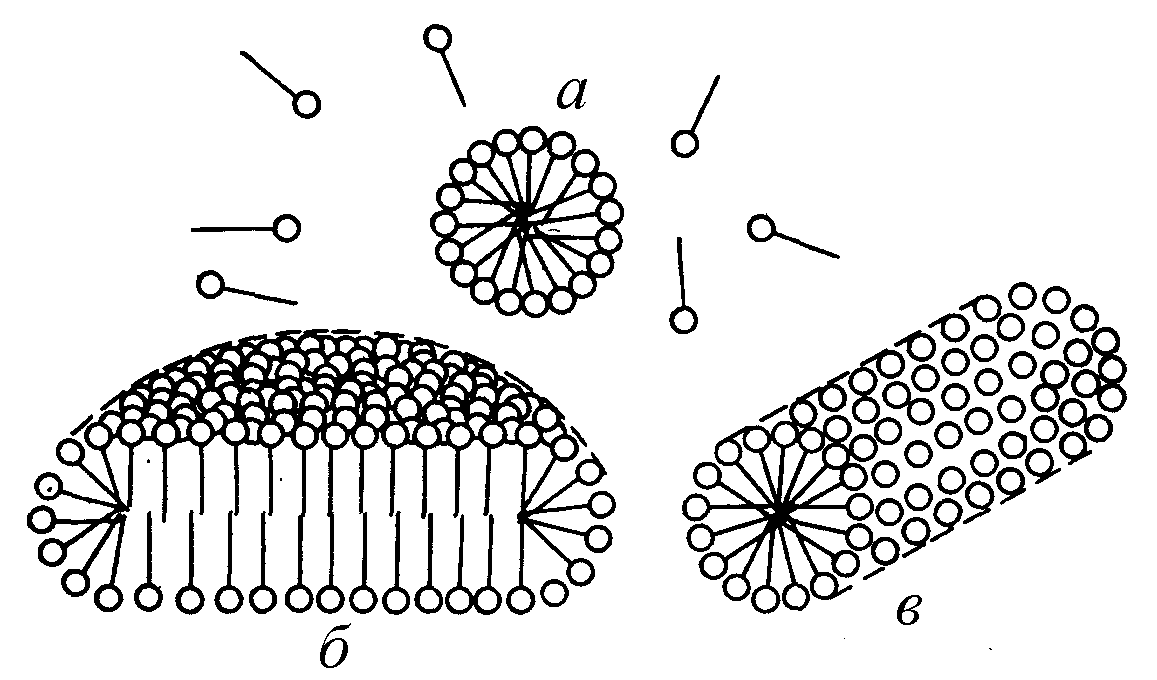
При увеличении концентрации ПАВ мицеллярная система проходит ряд равновесных состояний, различающихся по числам ассоциации, размерам и форме мицелл. При достижении определенной концентрации сферические мицеллы начинают взаимодействовать между собой, что способствует их деформации. Мицеллы стремятся принять цилиндрическую, дискообразную, палочкообразную, пластинчатую форму (рис. 7). Существование пластинчатых мицелл доказано Мак-Беном.
|
|
Рис. 7. Образование структур по мере роста концентрации ПАВ в растворе. Мицеллы сферические (а), дискообразиые (б) и цилиндрические (в) |
|
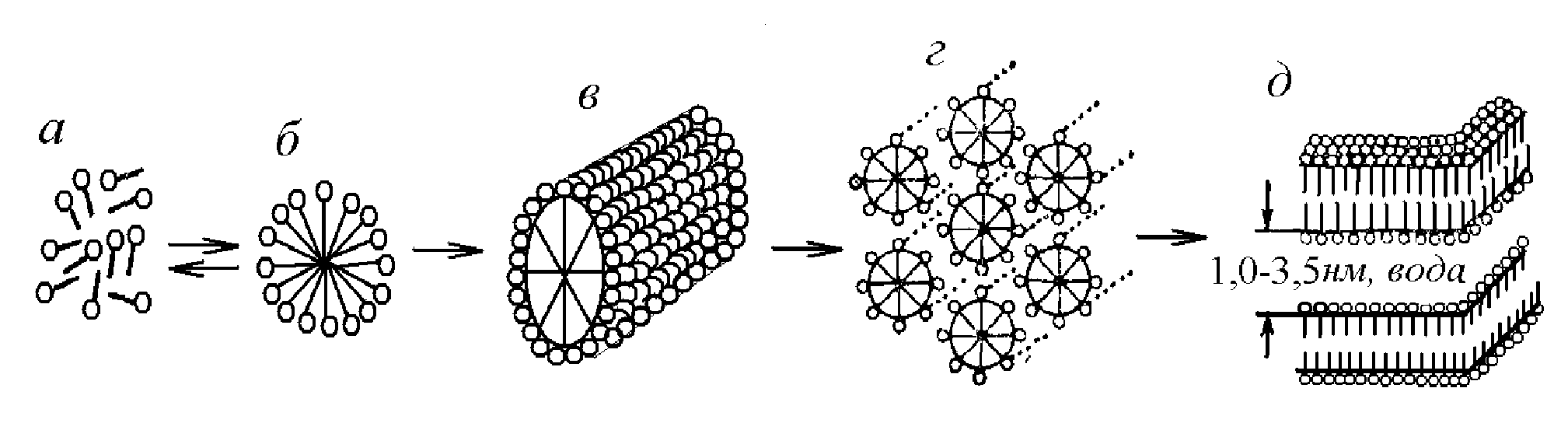
C увеличением концентрации ПАВ возрастает колличество мицелл, при дальнейшем росте концентрации сферические мицеллы объединяются в палочкообразные (рис. 7, в), при этом вязкость системы резко возрастает. Эти вытянутые мицеллы далее организуются в двумерно-гексагональную сплошную структуру во всем объеме раствора (рис. 6, г), это так называемая «средняя» (middle) мезоморфная фаза. С дальнейшем ростом концентрации образуется пластинчатая или ламеллярная (lamellar) мезоморфная фаза, сплошная структура образована в ней параллельной упаковкой протяженных гибких бимолекулярных слоев, с прослойками воды (рис. 7, д). Такие мезоморфные фазы представляют собой оптически анизотропные системы, называемые жидкими кристаллами (ЖК). Последней стадией агрегации при дальнейшем удалении воды из системы является образование гелеобразной структуры и твердого кристаллического ПАВ.
При концентрациях ПАВ в водном растворе, несколько превышающих ККМ, согласно представлениям Гартли образуются сферические мицеллы (рис. 7а). Эти мицеллы обычно называют мицеллами Гартли. Внутренняя часть мицелл Гартли состоит из переплетающихся углеводородных радикалов, полярные группы молекул ПАВ обращены в водную фазу. Диаметр таких мицелл равен удвоенной длине молекул ПАВ. Число молекул в мицелле быстро растет в пределах узкого интервала концентраций, а при дальнейшем увеличении концентрации практически не изменяется, а увеличивается число мицелл. Сферические мицеллы могут содержать от 20 до 100 молекул и более. Например, по результатам измерения светорассеяния, мицелла додецилсульфата натрия состоит в среднем из 73 молекул.
Большое значение мицеллообразование имеет в живой природе. Биологические мембраны – сложные бислои с гидрофобным ядром и гидрофильным окружением; специфичность многих биохимических процессов требует соответствующей структурной организации.
Гидрофильно-липофильный баланс
Кроме поверхностной активности, непосредственно определяющей адсорбционную способность ПАВ, другой важной количественной характеристикой коллоидных ПАВ является гидрофильно-липофильный баланс (ГЛБ). Соотношение между гидрофильными свойствами полярной группы и липофильными (липос – жир) свойствами углеводородного радикала, зависящими от его размера, характеризуется числами ГЛБ. Числа ГЛБ определяются путем сравнения способности различных ПАВ к мицеллообразованию, стабилизации эмульсий и др.
Физический смысл эмпирических чисел ГЛБ состоит в том, что они определяют отношение работы адсорбции молекул ПАВ на границе раздела из фазы «масло» к работе адсорбции на той же границе из фазы «вода».
Таким образом, числа ГЛБ линейно связаны с поверхностной активностью. Именно эти параметры должны быть критериями оценки ПАВ. Однако на практике обычно качество ПАВ оценивают по числам ГЛБ. Так, для получения устойчивых прямых эмульсий (масло в воде) используют ПАВ с числами ГЛБ от 10 до 16 (в зависимости от природы масла), для получения обратных эмульсий (вода в масле) – от 3 до 5; при ГЛБ 7-8 наблюдается переход эмульсий от прямых к обратным; числа ГЛБ составляют для смачивателей 7-9, моющих средств 13-15, солюбилизаторов в водных растворах – 15-16.
Солюбилизация.
Явление растворения веществ в мицеллах ПАВ называется солюбилизацией. В водных мицеллярных системах солюбилизируются вещества, нерастворимые в воде, например, бензол, органические красители, жиры. Это обусловлено тем, что ядро мицеллы проявляет свойства неполярной жидкости. В органических мицеллярных растворах, в которых внутренняя часть мицелл состоит из полярных групп, солюбилизируются полярные молекулы воды, причем количество связанной воды может быть значительным. Явление солюбилизации подтвердило представление о жидкой природе углеводородного ядра мицеллы ПАВ в водном растворе.
Вещество, солюбилизированное раствором ПАВ, называют солюбилизатом, а ПАВ – солюбилизатором.
Методы определения ККМ
Один из методов расчета ККМ основан на определении поверхностного натяжения (см. выше), по методике отрыва кольца (самостоятельно).
По широте применения и точности среди прочих методов определения ККМ особенно выделяется кондуктометрический метод, основанный на измерении электропроводности водных растворов ПАВ.
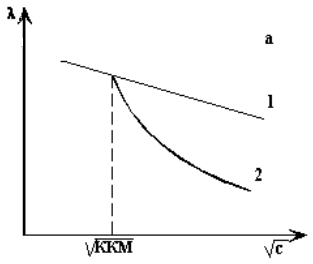
На кривой концентрационной зависимости эквивалентной электропроводности (λ) водных растворов ПАВ в связи с изменением строения растворов по мере увеличения концентрации четко фиксируются три области (рис. 7а): постепенное линейное снижение электропроводности до ККМ, затем выше ККМ более резкое падение ее до минимума и последующее возрастание электропроводности (на рисунке не изображено).
Коллоидные ионогенные
ПАВ в отношении электропроводности в
разбавленных растворах ведут себя как
обычные электролиты, подчиняясь уравнению
Онзагера (до ККМ):
![]() ,
где λ – эквивалентная проводимость,
,
где λ – эквивалентная проводимость,
![]() –
эквивалентная электропроводность при
бесконечном разбавлении, А – константа,
зависящая от температуры, вязкости и
диэлектрической проницаемости среды.
Понижение эквивалентной электропроводности
до ККМ связано с усилением межионного
взаимодействия.
–
эквивалентная электропроводность при
бесконечном разбавлении, А – константа,
зависящая от температуры, вязкости и
диэлектрической проницаемости среды.
Понижение эквивалентной электропроводности
до ККМ связано с усилением межионного
взаимодействия.
Крутой излом связан с тем, что мицеллы ПАВ хотя и переносят ток, но менее подвижны в электрическом поле. Электропроводность мицеллярных растворов уменьшается вследствии электростатического связывания части противоионов. При этой концентрации начинается формирование ионных мицелл, сопровождающееся образованием облаков из противоионов, связанных с мицеллами. Подвижность поверхностно-активных ионов, общее число и заряд проводящих частиц в системе при этом падают, и электропроводность понижается при возрастании концентрации резче, чем до ККМ. Последующее возрастание электропроводности после минимума на кривой (c) для коллоидных электролитов объясняется освобождением части противоионов в результате перекрывания ионных атмосфер при сближении мицелл и увеличения их размеров с ростом концентрации ПАВ.
|
|
Рис. 8 Зависимость электропроводности от концентрации |
|
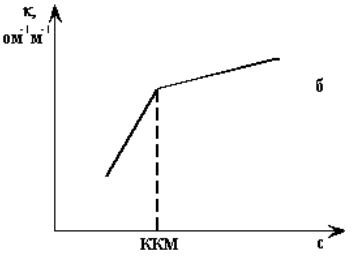
Графическая обработка результатов измерений электропроводности водных растворов мыл показывает, что точка излома (ККМ) особенно резко выражена на графике зависимости удельной электропроводности от концентрации. Излом связан с уменьшением электропроводности в связи с образованием мицелл. Начало мицеллообразования вызывает резкий излом кривых (рис. 8б).