
- •Пропріорецепція
- •Температурна чутливість
- •Больова чутливість Рецептори і провідні шляхи
- •Глибокий біль
- •М'язовий біль
- •Вісцеральний біль
- •Подразнення больових волокон
- •Спазм та заціпеніння м'язів
- •Іррадійований біль
- •Правило дерматологів
- •Ефекти полегшення
- •Центральне гальмування та відволікальні засоби
- •Дія морфіну та енкефалінів
- •Синдроми хронічного болю
- •Розрізнення двох точок
- •Стереогнозис
Центральне гальмування та відволікальні засоби
Добре відомо, що солдати, поранені у розпалі битви, можуть не відчувати болю аж до ії завершення (стресова анальгезія). Багато хто з власного досвіду знає, що доторкування або струшування місця поранення зменшує біль від нього. Стимулювання електровібратором больової точки також дає певне полегшення. Акупунктуру використовували протягом 4 000 років для знеболення або полегшення болю, проте в окремих випадках цей метод як єдиний засіб анестезії дає змогу робити навіть великі операції. Ці та інші спостереження свідчать, що передавання і сприйняття болю можуть гальмуватися, як і полегшуватися, у ЦНС.
Гальмуванням центральних чутливих шляхів можна пояснити ефективність відволікальних засобів. Стимулювання шкіри над ділянкою запалення зумовлює полегшення болю від уражених внутрішніх органів. На цьому принципі грунтується ефективність стародавніх гірчичників.
Дія морфіну та енкефалінів
Морфін зменшує біль. Він особливо ефективний у разі введення в пряму кишку. Рецептори, які зв 'язують морфін, а також "внутрішні морфіни організму"- опіоідні пептиди
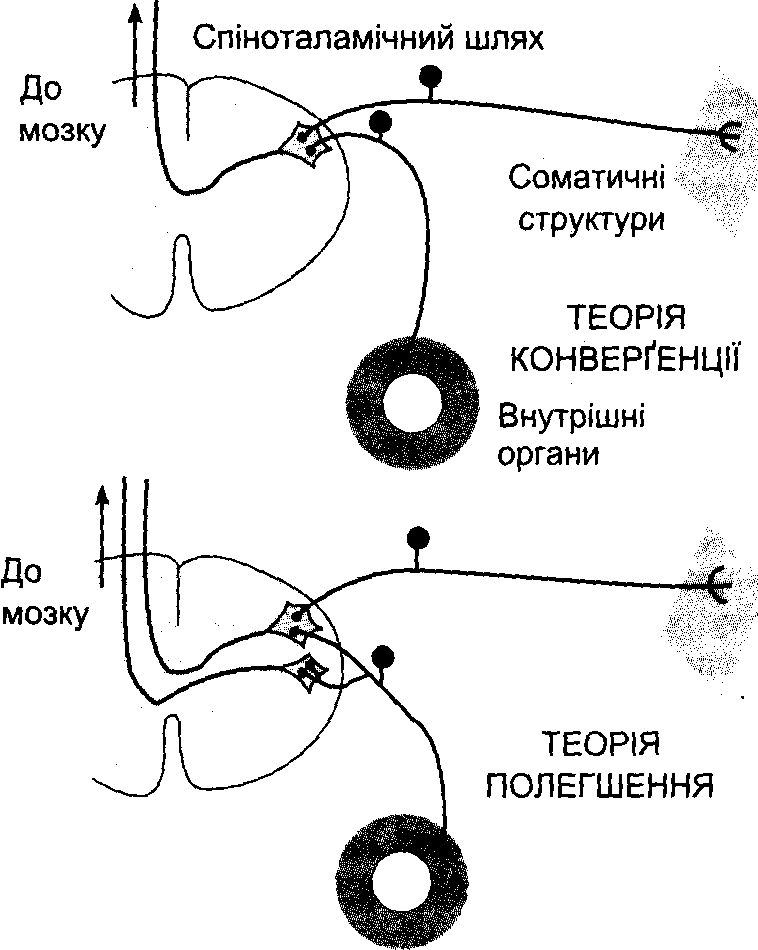
Рис. 7-8. Ілюстрації до теорій конверґенції та полегшення у механізмі виникнення іррадійованого болю.
Є принаймні три точки в організмі, діючи на які, опіоїди можуть спричинити анальгезію: периферійне - у місці поранення; у ділянці "воріт" задніх рогів, де ноцицепторні волокна утворюють синапси з клітинами спинномозкових гангліїв; у ділянках мозкового стовбура, ближчих до головного мозку. Опіоїдні рецептори утворені клітинами спинномозкових гангліїв і мігрують по їхніх відростках як до центра, так і на периферію.
На периферії запалення спричинює продукування клітинами імунної системи опіоїдних пептидів, які, вірогідно, діють на відповідні рецептори аферентних нервових волокон, зменшуючи біль. У ділянці задніх рогів опіоїдні рецептори можуть діяти на пресинаптичному рівні, зменшуючи вивільнення речовини Р, хоча відповідні преси-наптичні нервові закінчення не були ідентифіковані. Нарешті, ін'єкція морфіну у навколоводопровідну сіру речовину середнього мозку зменшує біль шляхом активування низхідних шляхів, які пригнічують первинне аферентне передавання у задніх рогах. Є докази того, що це активування відбувається через проекції з навколоводопровідної сірої речовини до сусіднього ядра великого шва і що гальмівну активність мають низхідні серотонінергічні волокна з цього ядра. Тонкий механізм інгібіторного впливу серотоніну на передавання імпульсів у задніх рогах не з'ясований.
Плацебо здатне зумовити продукування ендогенних опіоїдів, які зменшують біль. Їхню дію частково пригнічують антагоністи морфіну, зокрема, налоксон. Акупунктура ділянок, віддалених від джерела болю, також спричинює виділення ендорфінів. Акупунктура больової точки діє приблизно так само, як дотик або струшування (див. вище). Ендогенні опіоїди також беруть участь у виникненні стресової аналгезії, оскільки в експерименті на тваринах доведено, що налоксон здатний блокувати деякі її форми. На виникнення інших форм стресової аналгезії налоксон не впливає, що свідчить про залучення інших компонентів.
Ацетилхолін
Епібатидин, холінергічний агоніст, уперше ізольований зі шкіри жаби, є сильним неопіоїдним анальгетичним засобом, синтетичні похідні якого мають ще вищу болезаспокійливу активність. Їхню дію блокують холінергічні блокатори; досі не отримано доказів того, що вони спричинюють звикання. Анальгетична дія нікотину, навпаки, менш виражена у мишей з дефіцитом 2- та 2-субодиниць холінергічних рецепторів нікотину. Ці спостереження доводять, що нікотинхолінергічний механізм бере дієву участь у регулюванні больових відчуттів, хоча тонкий механізм цього регулювання ще потребує дослідження.
Канабіноїди
Як зазначено у Розділі 4, анандамід канабіноїдів та ПЕА продуковані ендогенне і пов'язані, відповідно, з рецепторами СВ, та СВд. Для анандаміду характерна виражена анальгетична активність, а у складі навколоводопровідної сірої речовини та інших ділянок мозку, пов'язаних з відчуттям болю, виявлені анандамісткі нейрони. ПЕА у разі використання впливає на периферії, посилюючи аналь-гетичну дію анандаміду. Ноцицептин
У процесі клонування опіатних рецепторів (і, к і 8 ідентифіковано орфан-рецептор (від англ. огіап — сирота), ОКІ-і (для опіоїдоподібного рецептора 1), який не зв'язувався з жодним із опіоїдів високим ступенем спорідненості. Нещодавно ідентифіковано природний ліганд цього рецептора. Ним виявився поліпептид, що складається з 17 амінокислот і нагадує динорфін-17 (див. Розділ 4). У випадку внутрішньомозкової ін'єкції експериментальним тваринам він зумовлював гіпералгезію. З цієї причини його названо ноцицептином. Ноцицептин та його рецептори наявні у багатьох ділянках мозку, в тім числі в гіпоталамусі, мозковому стовбурі та задніх рогах. У складі молекули білка-попередника ноцицептину є також ноци-статин, поліпептидний антагоніст ноцицептину. Механізм взаємодії цих поліпептидів остаточно не з'ясований, однак правдоподібно, що вони обидва беруть участь у передаванні болю.
