
1-аминобутан(Бутиламин)
2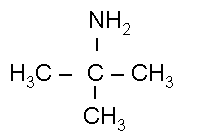 .
Изомеры:
.
Изомеры:
C4H9 – NH2 первичные амины:
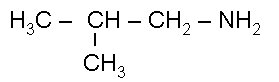
1-амино-2-метил
пропан
2-амино-2-метил
пропан(Изобутиламин)
(Изобутиламин)
Вторичные амины:
![]()
![]()
Метилпропиламин
Диэтиламин
Т
Диметилэтиламин
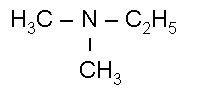
Аминам характерна структурная изомерия, изомерия положения функциональной группы, метамерия.
3 . Основные свойства аминов усиливаются в ряду:
C6H5 – NH2, NH3, C4H9 – NH2, ,
4
+
–
а) Реакция солеобразования:
C
Иодид бутиламмония
б) Реакция алкилирования:
C
Иодид бутилметилммония
в )
Взаимодействие с азотистой кислотой:
)
Взаимодействие с азотистой кислотой:
1 ) C4H9 – NH2 + HO – NO C4H9 – OH + N2 + H2O

2)
нитрозодиэтиламин
3) Третичные амины с HNO2 не взаимодействуют.
ИНДИВИДУАЛЬНАЯ РАБОТА № 10
ТЕМА: «Аминокислоты»
1. Предложите схему получения аминокислоты из исходного алкана. Запишите уравнения химических реакций.
2. Напишите структурные формулы изомеров для полученной аминокислоты. Какие виды изомерии характерны для аминокислот?
3. Запишите химические реакции, отражающие свойства полученной аминокислоты.
а) по карбоксильной группе.
б) по аминогруппе.
в) амфотерность аминокислот.
.
ВЫПОЛНЕНИЕ:
1 . Схема получения альфа-аминомасляной кислоты из бутана.
C 4H10 C4H9Cl C4H9OH C3H7 –
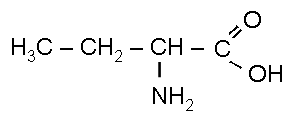
Химические реакции:
hv
С 4Н10 + Сl2 C4H9Cl + HCl
C 4H9Cl + NaOH C4H9OH + NaCl
C4H9OH + [O] C3H7 –
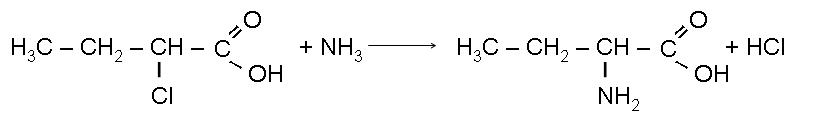
α-аминомасляная кислота
2. Изомерия:
а) по положению функциональной группы:

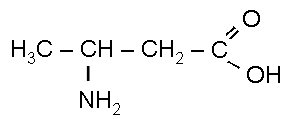
2-аминобутановая кислота
(α-аминомасляная кислота)
3-аминобутановая кислота
(β-аминомасляная кислота)
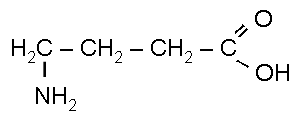
4-аминобутановая кислота
(γ-аминомасляная кислота)
б
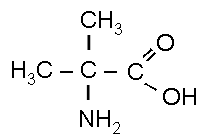
2-метил-2-аминопропановая
кислота (α-аминоизомасляная кислота)
в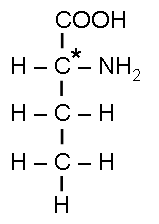
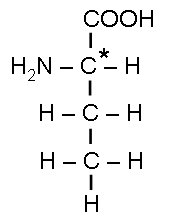 )
Зеркальная изомерия:
)
Зеркальная изомерия:
D(-)-оксимасляная
кислота
L(+)-оксимасляная
кислота
Для аминокислот характерны: структурная изомерия, изомерия положения аминогрупп, оптическая изомерия.
3. По карбоксилу:
I) Реакция декарбоксилирования:
1-аминобутанБутиламин
I
+
Н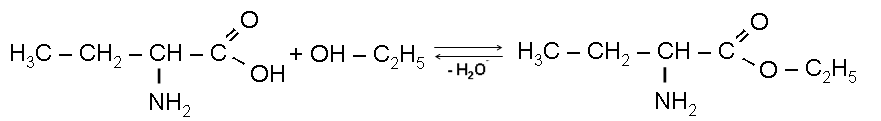
HO
Этиловый эфир
2-аминобутановой кислоты
б) Реакции по аминогруппе.
I) Взаимодействие с формальдегидом (реакция Зеренсена):
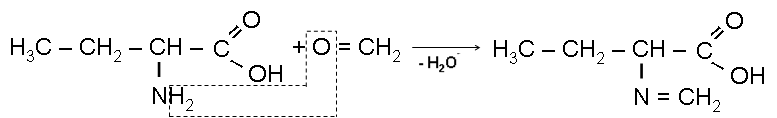
II) Действие азотистой кислоты (Реакция Слайка):
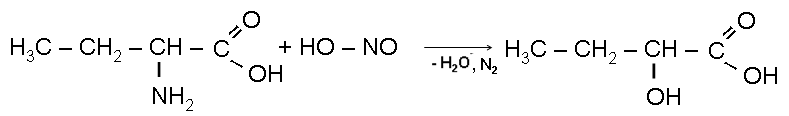
в) Амфотерность.
I) Образование внутренней соли:
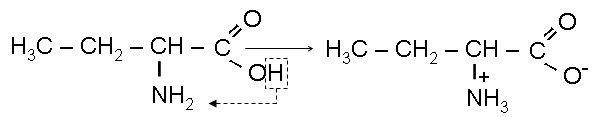
д )
Образование дипептида:
)
Образование дипептида:
Дипептид
+
ИНДИВИДУАЛЬНАЯ РАБОТА № 11
ТЕМА: «Водородный показатель. Осмос»
Задание №1
Вычислить рН и рОН 0,001 н раствора кислоты (основания) предложенного вам преподавателем, считая ее полностью продиссоциированной на ионы
Пример задания №1
Вычислить рН и рОН 0,001 н раствора азотной кислоты, считая ее полностью продиссоциированной на ионы.
Решение:
НNО3 – сильный электролит, допустим что она полностью диссоциирует на ионы. Уравнение диссоциации:
НNО3 ↔Н+ + NО3-
Концентрация ионов водорода в растворе равна концентрации кислоты, т. к. азотная кислота является одноосновной. [Н+]=0,001 моль/л. Из уравнения ионного произведения воды найдем концентрацию ОН- ионов:
10-14/10-3 =10-11 моль/л
Определим рН раствора кислоты по формуле:
рН = -lg [Н+]
Тогда рН раствора кислоты равен:
рН = -lg10-3 , рН= 3
рОН находят из формулы:
рН + рОН = 14
Следовательно, рОН = 14 -3, рОН = 11
Ответ: рН раствора азотной кислоты равен 3, а
рОН равен 1.
Задание №2
2. Определение осмотического давления раствора, если в исходном объеме его содержится определенное число грамм соли при стандартной температуре. (α=1)
Пример задачи №2:
Определить осмотическое давление раствора, если в 500 мл его 14,2 грамм сульфата натрия при 250С (α=1).
Выполнение:
Дано:
Vр-ра=500 мл
m(Nа2SО4)=14,2 г
α=1
t=250С
R=8,315 Дж/моль К
__________________
Определить Р-?
Решение:
Согласно уравнению Вант-Гоффа, осмотическое давление для растворов электролитов может быть найдено по формуле:
Р= m/M∙RTi
m - масса растворенного вещества в 1 литре раствора,
М – молекулярная масса растворенного вещества,
R – универсальная газовая постоянная,
Т – температура в градусах Кельвина,
I – Изотонический коэффициент Вант - Гоффа.
Т = t0+273=25 +273=2980 К
i= 1+α (n – 1), где α- степень электролитической диссоциации; n – число ионов на которое диссоциирует электролит. В случае соли сульфата натрия уравнение диссоциации будет:
Nа2SО4↔ 2Nа+ + SО42- , т. е. n = 3, тогда i= 1+1 (3 – 1) = 3
М(Nа2SО4) = 142 г/моль, т.к. в 500 мл раствора содержится 14,2 г Nа2SО4, то в 1 литре растворено 28,4 г соли (14,2∙2=28,4).
Определим осмотическое давление раствора:
Р = m/M∙RTi
Р = 28,4/142∙8,324∙298∙3=1,386 КПа
Ответ: осмотическое давление раствора Nа2SО4 равно 1,386 КПа
Индивидуальное задание №11
Тема: «Мицелообразование».
Задание №1:
Из данных преподавателем веществ составить схему образования коллоидной частицы.
Пусть необходимо показать образование золя и строение его частиц на примере образования хлорида серебра при взаимодействии водных растворов NaCl и AgNO3.
Пример выполнения:
Рассмотрим образование золя и строение его частиц на примере хлорида серебра AgCl. Этот золь образуется при медленном приливании водного раствора хлорида натрия NaCl к водному раствору нитрата серебра AgNO3, взятому в избытке. Реакция протекает по уравнению:
Ag+ + Cl– = AgCl.
При постепенном приливании раствора NaCl в раствор AgNO3 в первый момент из ионов Ag+ и Cl– образуется агрегат (AgCl)n, в котором ионы расположены в том же порядке, что и в кристаллической решетке AgCl.
Далее агрегат (AgCl)n адсорбирует на своей поверхности преимущественно те ионы, которые входят в его состав (или изоморфны по типу кристаллической решетки) и находятся в растворе в избытке. Этим условиям в данном случае отвечают ионы серебра. В результате адсорбции ионов Ag+ агрегат из хлорида серебра со слоем ионов серебра приобретает положительный заряд.
Ионы, адсорбирующиеся на поверхности агрегата, придают частице заряд и называются потенциалопределяющими. Наличие одноименных зарядов на агрегатах препятствует их объединению и росту кристалла AgCl. Таким образом агрегаты AgCl с адсорбированными на них ионами приобретают состояние агрегативной устойчивости.
Агрегат (AgCl)n вместе с потенциалопределяющими ионами Ag+ составляет ядро. К заряженному ядру притягиваются ионы противоположного заряда – противоионы. В данном случае такими ионами будут ионы, содержащиеся в растворе (но не входящие в состав агрегата), – нитрат-ионы NO3–. Противоионы, непосредственно примыкающие к ядру, образуют адсорбционный слой противоионов.
За адсорбционным слоем противоионов следует диффузный слой тех же противоионов. Количество противоионов диффузного слоя постепенно понижается по мере удаления от ядра. Противоионы диффузного слоя ориентируют вокруг себя полярные молекулы растворителя, создавая дополнительную сольватную (гидратную) оболочку.
Ионы адсорбционного слоя сравнительно прочно связаны с агрегатом, а противоионы диффузного слоя находятся под действием двух факторов: электростатического притяжения ионами противоположного заряда, которое удерживает их вблизи ядра, и броуновского движения, стремящегося распределить их в дисперсионной среде.
Ядро вместе с противоионами адсорбционного слоя составляет коллоидную частицу, или гранулу. Гранула с противоионами диффузного слоя называется мицеллой. Следует иметь в виду, что знак заряда гранулы соответствует знаку заряда потенциалопределяющих ионов. Мицелла в отличие от гранулы электронейтральна.
Формулу мицеллы гидрозоля хлорида серебра записывают так:
{n(AgCl), mAg+, (m – x)NO3–}x+xNO3–.
В фигурные скобки заключена гранула. Ионы, указанные за фигурными скобками, составляют внешнюю часть мицеллы. Подобный механизм мицеллобразования относится к лиофобным коллоидам.
Литература:
1. Грандберг И.И. Органическая химия / Учебник для студентов ВУЗов. – М.: Дрофа, 2004.
2. Заплишный В.Н. Органическая химия / Учебник для ВУЗов. – Краснодар, 2004.
3. Грандберг И.И., Нам Н.Л. Органическая химия / Учебник для студентов ВУЗов. – М.: Дрофа, 2009.
4. Цыренова С.Б., ЧебунинаЕ.И., Болдынов Ф.П. Руководство по решению примеров и задач по физколлоидной химии/ Улан-Удэ: ВСГТУ,2000.
