
Министерство по здравоохранению и социальному развитию ГБОУ ВПО
Челябинская государственная медицинская академия
Кафедра фармацевтической химии
Курсовая работа
По дисциплине: фармацевтическая химия
По специальности: фармация
Тема курсовой: «Разработка НД на ЛФ кислоты соляной 4,4-100,0 и натрия хлорида 5,2».
Работу выполнила: Курындина В.В.
Факультет фармацевтический форма обучения очная
Курс 5 группа №591
Руководитель курсовой работы: Симонян Е.В.
Преподаватель: Ножкина Н.Н.
Оценка___
Челябинск 2011г.
Содержание
1.Введение……………………………………………3стр.
2.Теоритическая часть………………………………4стр.
3.Экспериментальная часть………………………..20стр.
4.Заключение…………………………………………22стр.
5.Литература………………………………………….23стр.
Введение.
На современном фармацевтическом рынке существует множество лекарственных препаратов для лечения и профилактики избыточной кислотности желудочного сока: антациды, ингибиторы протонной помпы, блокаторы Н2-рецепторов. Но необходимо учитывать что существуют заболевания связанные с пониженной кислотностью желудочного сока, которая возникает из-за недостатка хлористоводородной (соляной) кислоты, вырабатываемая обкладочными клетками слизистой ЖКТ. Для заместительной терапии данных заболеваний применяются препараты, выше указанной соляной кислоты, и пепсина.
Цель данной работы провести полный химический анализ лекарственной формы, в состав которой входит соляная кислота и натрия хлорид, то есть провести качественный и количественный анализ данных веществ, привести их описание, и лекарственной формы в частности ,указать физические и химические свойства, что докажет эффективность, подлинность и безопасность лекарственного средства.
Теоретическая часть.
Состав ЛФ:
Кислоты соляной 4,4-100,0.
Натрия хлорида 5,2.
В рецепте не указанна концентрация кислоты, поэтому по правилам при расчетах за 100% берем концентрацию кислоты соляной 8,3%.
8,3-100
Х-4,4
Х=0,3652
Такое количество кислоты с концентрацией 8,3% необходимо для получения данной ЛФ.
Получение соляной кислоты:
Соляную кислоту получают следующими способами - сульфатным, синтетическим и из абгазов (побочных газов). Производство соляной кислоты заключается в получении HCL с последующей его абсорбцией водой. В зависимости от способа отвода теплоты абсорбции процессы разделяются на изотермические, адиабатические и комбинированные.
Сульфатный метод основан на взаимодействии NaCl с концентрированной H2SO4 при 500-550 °С. Реакционные газы содержат от 50-65% НСl (муфельные печи) до 5% НСl (реактор с кипящим слоем). Предложено заменить H2SO4 смесью SO2 и О2 (температура процесса около 540 °С, катализатор-Fе2О3).
В
основе прямого синтеза НСl лежит цепная
реакция горения:
Н2
+ Сl2![]() 2НСl+184,7кДж
Константа
равновесия
Кр
рассчитывается по уравнению: lgKp
= 9554/T- 0,5331g T+ 2,42.
2НСl+184,7кДж
Константа
равновесия
Кр
рассчитывается по уравнению: lgKp
= 9554/T- 0,5331g T+ 2,42.
Реакция инициируется светом, влагой, твердыми пористыми (древесный уголь, пористая Pt) и некоторыми минеральными веществами (кварц, глина). Синтез, ведут с избытком Н2 (5-10%) в камерах сжигания, выполненных из стали, графита, кварца, огнеупорного кирпича. Наиболее современный материал, предотвращающий загрязнение НСl,-графит, импрегнированный феноло-формальдными смолами. Для предотвращения взрывного характера горения реагенты смешивают непосредственно в факеле пламени горелки. В верхней зоне камер сжигания устанавливают теплообменники для охлаждения реакционных газов до 150-160°С. Мощность современных графитовых печей достигает 65 т/сут (в пересчете на 35%-ную соляную кислоту). В случае дефицита Н2 применяют различные модификации процесса; например, пропускают смесь Сl2 с водяным паром через слой пористого раскаленного угля:
2Сl2 + 2Н2О + С : 4НСl + СО2 + 288,9 кДж
Температура процесса (1000-1600 °С) зависит от типа угля и наличия в нем примесей, являющихся катализаторами (например, Fe2O3). Перспективно использование смеси СО с парами воды:
СО + Н2О + Сl2 : 2НСl + СО2
Более 90% соляной кислоты в развитых странах получают из абгазного НСl, образующегося при хлорировании и дегидрохлорировании органических соединений, пиролизе хлороргонических отходов, хлоридов металлов, получении калийных нехлорирированных удобрений и др. Абгазы содержат различные количествава НС1, инертные примеси (N2, H2, СН4), малорастворимые в воде органические вещества (хлорбензол, хлорметаны), водорастворимые вещества (уксусная кислота, хлораль), кислые примеси (Сl2, HF, О2) и воду. Применение изотермической абсорбции целесообразно при низком содержании НС1 в абгазах (но при содержании инертных примесей менее 40%). Наиболее перспективны пленочные абсорберы, позволяющие извлекать из исходного абгаза от 65 до 85% НСl.
Наиб. широко применяют схемы адиабатические абсорбции. Абгазы вводят в нижнюю часть абсорбера, а воду (или разбавленную соляную кислоту)-противотоком в верхнюю. Соляная кислота нагревается до температуры кипения благодаря теплоте растворения НСl. Изменение температуры абсорбции и концентрации НСl дано на рис. 1. Температура абсорбции определяется температурой кипения кислоты соответствующей концентрации (макс. температура-температура кипения азеотропной смеси-около 110°С).
На рис. 2 дана типовая схема адиабатической абсорбции НСl из абгазов, образующихся при хлорировании (например, получение хлорбензола). НСl поглощается в абсорбере 1, а остатки малорастворимых в воде органических веществ отделяют от воды после конденсации в аппарате 2, доочищают в хвостовой колонне 4 и сепараторах 3, 5 и получают товарную соляную кислоту.
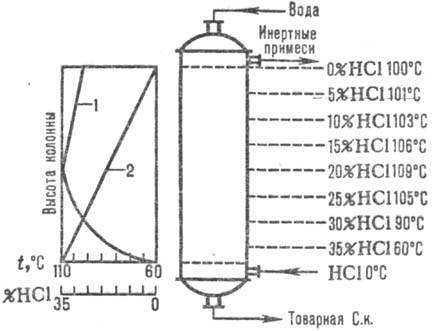
Рис. 1. Схема распределения температур (кривая 1) и концентрации (кривая 2) НСl по высоте адиабатического абсорбера.
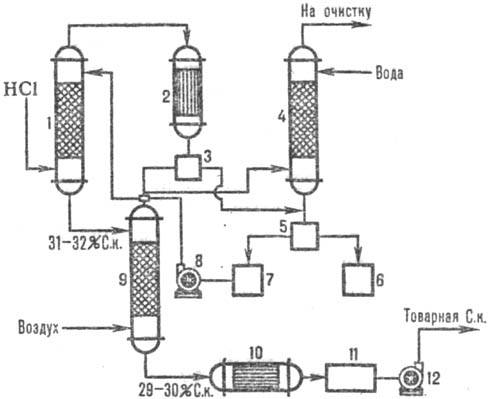
Рис.2. Схема типовой адиабатической абсорбции НСl из абгазов: 1-адиабатический абсорбер; 2 - конденсатор; 3, 5-сепараторы; 4-хвостовая колонна; 6-сборник органической фазы; 7-сборник водной фазы; 8, 12-насосы; 9-отдувочная колонна; 10-теплообменник; 11-сборник товарной кислоты.
На рис. 3 дана типовая схема получения соляной кислоты из абгазов с использованием комбинированно схемы абсорбции. В колонне адиабатической абсорбции получают соляную кислоту пониженной концентрации, но свободную от органических примесей соляную кислоту с повышенной концентрацией НСl производят в колонне изотермической абсорбции при пониженных температурах. Степень извлечения НС1 из абгазов95-99% (при использовании в качестве абсорбента разбавленных кислот) и практически полная-при использовании чистой воды.
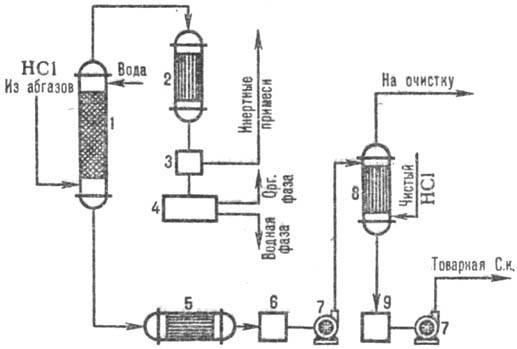
Рис. 3. Схема типовой комбинированной абсорбции НСl из абгазов: 1 - колонна адиабатической абсорбции; 2 - конденсатор; 3-отделитель газов; 4-сепаратор; 5-холодильник; 6, 9-сборники кислоты; 7-насосы; 8-изотермический аброрбер.
Соляная кислота (в стакане)
Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород получают сжиганием водорода в хлоре. В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии крепкой серной кислоты на поваренную соль:
NaCl + H2SO4(конц.) (150 °C) → NaHSO4 + HCl↑
При температуре выше 550 °C и избытке поваренной соли возможно взаимодействие:
NaCl + NaHSO4 (>550 °C) → Na2SO4 + HCl↑
Физические свойства:
Бесцветная прозрачная летучая жидкость с резким запахом, кислого вкуса. Смешивается с водой и спиртом во всех соотношениях, образуя растворы сильно кислой реакции. Плотность 1,122-1,124.


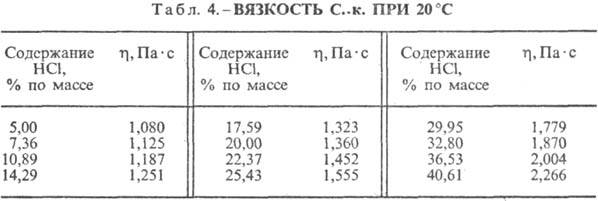
Химические свойства:
Чистый сухой HCL начинает диссоциировать выше 1500⁰С , химически пассивен, многие металлы, C, S, P не взаимодействуют даже с жидким HCL. С нитридами, карбидами, боридами, сульфидами реагирует выше 650⁰С , с гидридами Si, AlCl₃, с оксидами переходных металлов при 300⁰С и выше. Окисляется О₂ и HNO₃ до CL₂, с SO₃ дает CLSO₃H.
Соляная кислота химически весьма активна. Растворяет с выделением Н₂ все металлы, имеющие отрицательный нормальный потенциал, со многими оксидами и гидроксидами металлов образует хлориды, выделяет свободные кислоты из таких солей, как фосфаты, силикаты, бораты и др.
Немного из истории.
Соединения хлора, прежде всего поваренная соль и нашатырь, известны очень давно. К более позднему времени относится знакомство с соляной кислотой. В конце xvıв. (1595) о ней упоминает в своей «Алхимии» Либавиус, чуть позже Василий Валентин. Тогда соляную кислоту в небольших количествах получали для алхимических и ремесленных целей путем перегонки смеси поваренной соли, железного купороса, квасцов и т.д. Более подробно соляная кислота описана Глаубером, разработавшим способ получения чистой кислоты из смеси поваренной соли с серной кислотой. Глаубер дает рекомендации по применению соляной кислоты в частности, в качестве приправы к кушаньям вместо уксуса.
Применение.
Применяют в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при паянии и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. В смеси с ПАВ используется для очистки керамических и металлических изделий (тут необходима ингибированная кислота) от загрязнений и дезинфекции.
В пищевой промышленности зарегистрирована в качестве регулятора кислотности, пищевой добавки E507. Применяется для изготовления зельтерской (содовой) воды.
Составная часть желудочного сока; разведенную соляную кислоту назначают внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сока. Применяют внутрь в каплях и микстурах. Так же назначают при гипохромных анемиях вместе с препаратами железа, она способствует улучшению всасывания и использования железа.
Разведенную кислоту соляную назначают взрослым по 10-15 капель 2-3-4 раза в день во время или до еды (в 0,5 стакана воды).
Высшие дозы для взрослых внутрь: разовая 2мл (40 капель), суточная 6мл (120 капель).
Хранение.
В склянках с притертыми пробками.
Получение натрия хлорида.
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах:
на катоде как побочный продукт выделяется водород вследствие восстановления ионов H +, образованных в результате электролитической диссоциации воды:
H2O ⇆ H+ + OH−
2 H+ + 2 e− → H2↑
поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа:
NaCl → Na+ + Cl−
2 Cl− − 2 e− → Cl2↑
суммарная реакция:
2 NaCl + 2 H2O → 2 NaOH + Cl2↑ + H2↑
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор сжижается на жёлтую жидкость уже при обычной температуре.
Если между анодом и катодом нет диафрагмы, то растворенный в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO:
2 NaOH + Cl2 → NaCl + NaClO + H2O
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подается в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH ничтожно мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия:
Na+ + e− → Na(Hg)
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
2 Na(Hg) + 2 H2O → 2 NaOH + H2↑
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Физические свойства.
Белые кубические кристаллы или белый кристаллический порошок соленого вкуса, без запаха. Растворим в воде (1:3), мало растворим в спирте.
Химические свойства.
Поскольку хлорид натрия в водном растворе почти полностью диссоциирован на ионы: NaCl → Na+ + Cl−, его химические свойства в водном растворе определяются соответствующими химическими свойствами катионов натрия и хлорид-анионов.
Немного из истории.
Название "натрий" (англ. и франц. Sodium, нем. Natrium) происходит от древнего слова, распространенного в Египте, у древних греков (vixpov) и римлян. Оно встречается у Плиния (Nitron), у других древних авторов и соответствует древнееврейскому нетер (neter). В древнем Египте натроном, или нитроном, называли вообще щелочь, получаемую не только из природных содовых озер, но и из золы растений. Ее употребляли для мытья, изготовления глазурей, при мумификации трупов. В средние века название нитрон (nitron, natron, nataron), а также борах (baurach), относилось и к селитре (Nitrum). Арабские алхимики называли щелочи alkali. С открытием пороха в Европе селитру (Sal Petrae) стали строго отличать от щелочей, и в XVII в. уже различали нелетучие, или фиксированные щелочи, и летучую щелочь (Alkali volatile). Вместе с тем было установлено различие между растительной (Alkali fixum vegetabile - поташ) и минеральной щелочью (Alkali fixum minerale - сода). В конце XVIII в. Клапрот ввел для минеральной щелочи название натрон (Natron), или натр и для растительной - кали (Kali), Лавуазье не поместил щелочи в "Таблицу простых тел", указав в примечании к ней, что это, вероятно, сложные вещества, которые когда-нибудь будут разложены. Действительно, в 1807 г. Дэви путем электролиза слегка увлажненных твердых щелочей получил свободные металлы - калий и натрий, назвав их потассий (Potassium) и содий (Sodium). В следующем году Гильберт, издатель известных "Анналов физики", предложил именовать новые металлы калием и натронием (Natronium); Берцелиус сократил последнее название до "натрий" (Natrium). В начале XIX в. в России натрий называли содием (Двигубский, 182i; Соловьев, 1824); Страхов предлагал название содь (1825). Соли натрия назывались, например, сернокислая сода, гидрохлоровая сода и одновременно уксусный натр (Двигубский, 1828). Гесс, по примеру Берцелиуса, ввел название натрий.
Древние приписывали соли священные свойства, связывали ее с добрыми духами. В ряде стран сохранился обычай ставить перед гостями или подавать соль как символ дружбы и гостеприимства. Просыпать соль считалась навлечь гнев богов.
В Эфиопии еще в XIX в. были в ходу соляные деньги - стандартные бруски каменной соли. В Китае изготавливались соляные монеты, на которые ставилось клеймо богдыхана. Солью вместо денег платили жалование римским воинам и крестоносцам.
Приминение.
В пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывании соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах,%:
экстра — не менее 99,5;
высший — 98,2;
первый — 97,5;
второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10 −4 %, фтора (25,0 ± 5,0) × 10 −3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15 % содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы используют как вспомогательный осмотический диуретик при лёгочных, желудочных и кишечных кровотечениях для обеспечения форсированного диуреза, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием.
Хранение.
В хорошо укупоренной таре.
Реакции идентификации.
Реакции на ион хлора:
реакция с нитратом серебра.
К 10-15 каплям раствора добавляем 3-4 капли азотной кислоты, нагреваем и добавляем серебра нитрат, выпадает белый творожистый осадок.
Взаимодействие с сильными окислителями.
К исследуемому раствору добавляем несколько капель концентрированной серной кислоты и немного твердого калия перманганата, нагреваем. Выделяется газообразный хлор (запах, посинение йодкрахмальной бумаги).
К исследуемому раствору добавляем бихромат калия (1:3) и немного концентрированной серной кислоты, помещаем данную смесь в пробирку с газоотводной трубкой, пробирку закрываем пробкой. Другой конец газоотводной трубки опускаем в пробирку, содержащую 1-2мл разбавленного аммиака. При этом не следует погружать конец трубки в аммиак, так как его может втянуть в пробирку с испытуемой смесью, в результате чего может произойти взрыв. Пробирку с реакционной смесью слегка нагреваем, все время следя за правильным положением газоотводной трубки.
По окончании опыта хромат открывают реакцией образования надхромовой кислоты, после подкисления раствора серной кислотой. Описанный опыт требует весьма тщательного выполнения, так как если в пробирку с аммиаком попадет калия бихромат из реакционной смеси, то ион хлора будет «переоткрыт».
Реакции на ион натрия.
Реакция с цинкуранилацетатом
(микрокристаллоскопическая).
Поместив на предметное стекло каплю исследуемого раствора, осторожно выпариваем ее до суха. Сухой остаток по охлаждении обрабатываем каплей раствора цинкуранилацетата, и через несколько минут рассматриваем кристаллы под микроскопом. Они представляют собой правильные тетраэдры или октаэдры.
(люминесцентная)
На предметное стекло помещаем каплю исследуемого раствора, добавляем каплю уксуснокислого раствора цинкуранилацетата. Просматривая в ультрафиолетовом свете наблюдаем зеленое свечение.
Окрашивание пламени горелки.
Соли натрия окрашивают пламя газовой горелки в ярко желтый цвет.
Количественное определение.
Титрование сильной кислоты щелочью.
В процессе титрования (нейтрализации) концентрация водородных ионов и соответственно рН среды будет изменяться. Для случая 0,1М раствора соляной кислоты концентрация водородных ионов с прибавлением едкого натра будет изменяться, вначале постепенно и достигает значения рН=4, когда нейтрализовано 99,9% кислоты. При дальнейшем прибавлении едкого натра концентрация водородных ионов падает скачком: на нейтрализацию последних количеств кислоты (0,1%) и при добавлении такого же избытка едкого натра (0,1%) приходится изменение концентрации водородных ионов от 10ˉ4 до 10ˉ10, что соответствует изменения рН на 6 единиц.
В небольшую коническую колбу с притертой пробкой наливаем 10мл воды и точно взвешиваем, затем добавляем 3мл исследуемого раствора, хорошо перемешиваем, закрываем пробкой и снова точно взвешиваем. Содержимое колбы титруем 0,1М раствором едкого натра.
Окончание титрование определяется потенциометрически или с помощью индикатора фенолфталеина, который в щелочной среде окрашивает раствор в розовый цвет.
Аргентометрия.
К 0,5мл исследуемого раствора добавляем 1мл воды,1-2 капли раствора бромфенолового синего, по каплям разведенную уксусную кислоту до зелено-желтого окрашивания и титруем 0,1М раствором серебра нитрата до фиолетового окрашивания.
10мл исследуемого раствора переносим в колбу для титрования, добавляем 2 капли хромата калия и титруем 0,1М раствором серебра нитрата до оранжево- желтого окрашевания.
Экспериментальная часть.
- реакция с серебра нитратом.
К 10-15 каплям раствора добавляем 3-4 капли азотной кислоты, нагреваем и добавляем серебра нитрат, выпадает белый творожистый осадок.
- взаимодействие с окислителями.
К 2мл исследуемого раствора добавляем несколько капель концентрированной серной кислоты и немного твердого калия перманганата, нагреваем. Выделяется газообразный хлор (запах, посинение йодкрахмальной бумаги).
Количественное определение суммы хлоридов.
10мл исследуемого раствора переносим в колбу для титрования, добавляем 2 капли хромата калия и титруем 0,1М раствором серебра нитрата до оранжево- желтого окрашевания. 1мл раствора серебра нитрата соответствует 0,005844г натрия хлорида и 0,03646г соляной кислоты соответственно.
Количественное определение соляной кислоты методом нейтрализации.
В небольшую коническую колбу для титрования с притертой пробкой наливаем 10мл воды и точно взвешиваем, затем добавляем 3мл исследуемого раствора, хорошо перемешиваем, закрываем пробкой и снова точно взвешиваем. Содержимое колбы титруем 0,1М раствором едкого натра до розового окрашевания.
Заключение.
В ходе выполнения данной курсовой работы мы изучили все возможные методы химической оценки качества ЛФ, то есть способы качественного и количественного анализа. Так же воспроизвели возможные реакции и методы, в результате которых мы можем сделать вывод о том, что ЛФ соответствует требованиям НД.
Литература.
"Справочник химика" т.3, Л.-М.: Химия, 1965 стр. 289-302
"Справочник химика" т.5, Л.-М.: Химия, 1966 стр. 94-95
Беликов В.Г. "Учебное пособие по фармацевтической химии" М.: Медицина, 1979 стр. 18
Девяткин В.В., Ляхова Ю.М. "Химия для любознательных, или о чем не узнаешь на уроке" Ярославль:Академия Холдинг, 2000 стр. 30, 65-70, 76
Иванов В.М., Семененко К.А., Прохорова Г.В., Симонов Е.Ф. "Натрий" М.:Наука, 1986 стр. 239
Рабинович В.А., Хавин З.Я. "Краткий химический справочник" Л.: Химия, 1977 стр. 86
Машковский М.Д. «Лекарственные средства»М.:Медицина,1978,том 2,стр. 78 и 72.
Государственна фармакопея СССР. М.:Медицина 1968, стр.55 и 442.
