
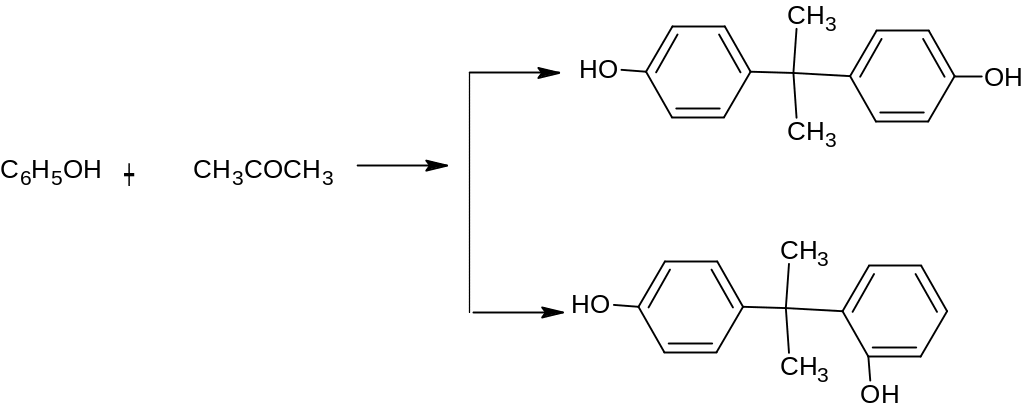
Дифенилолпропан
Или технический продукт структурная формула следующая. Это бесцветные кристаллы с tпл= 156-167 °С растворимы в метилово, этиловом изопроиловом и бутиловых спиртах, уксусной кислоте, ацетоне, диэтиловом эфире. Эдфенилолпропан широко применятся в качестве исходного продукта для получения эпоксидных смол, фенолсмол поликарбонатов антиоксидантов, гербецидов, Был получен Дианиным в 1891 г.
Способы получения
1. Конденсация фенола ацетном в присутствии серной и соляной кислоты или же хлористого водорода, что дает более чистый продукт
2. Из гидропероксида кумаола в присутствии серной кислоты
3. На основе реакции изопропенилацетата и фенола.
Реакция альдегидов и кетонов с ароматическими соединениями сходн с реакциями алкилирования и принадлежит к реакциям электрофильного замещения.
Остановимся на 1-ом способе: пара-пара’-бис-2,2- гидроксифенилпропан.
Реакция может быть записана следующим образом:
В этом случае образуется многочисленные
побочные продукты. В первую очередь в
результате реакции конденсации образуется
окись мезитила

Во-вторую очередь образуется пропенилфенол:

Это продукт дегидратации первоначально образующиегося гидроксипроизводного, а также образуются многоядерные фенолы продукты конденсации и циклизации образующихся оксимезитила и изопропенилфенола с фенолом, изомеризации дифенилолпропана и т.д. Для подавления побочных процессов используют избыток фенола, мольное соотношение фенол-ацетон поддерживают в пределах 3:1÷10:1. Различают 3 варианта осуществления этого способа:
1 Вариант: в качестве катализатора используют 70-76% серная кислота с тиогликолевой кислотой в качестве промоутер, температура 30-40 °С. Недостаток этого варианта:
1) Избыток серой кислоты из-за разбавления образующейся водой
2) Необходима регенерация кислоты
3) Побочное сульфирование фенолов
4) Образование большого количества сточных вод
В качестве катализатора используется безводный HCl, c промоутером H2S, тиогликолевая кислота, меркаптаны, t= 50-60 C. Процесс ведут насыщенная смесь фенола с ацетоном безводным HCl вместе с промутером. Этот вариант имеет ряд преимуществ по сравнению с первым. Но также недостатки как сильная коррозия аппаратуры и образование кислых вод сохраняется.
В качестве катализаторов используются сульфокатиониты активность которых растет при их дополнительной просушке. На активность катионитов существенно влияют промоутеры. Меркаптаны вводят в сульфокатионит или добавляют в небольшом количестве меркаптаны в исходное сырье. Температура процесса 60-90 °С, время реакции от 0,5-3 часов. Но проведение процесса при максиальных значениях температуры и времени ведет в повышению побочных веществ и снижению селективности, поэтому процесс ведут при t=75 C и времени 1 ч.
Технологическая схема дифенилпроан рис. 37. Фенол и ацетон в мольном соотношении 5:1 смешивают с меркаптаном и подогревают до 75 С. Смесь поступает в верхнюю часть реактора 2, представляющего собой колону заполненную катионитом. Реагенты подают с такой скоростю что бы время пребывания жидкости в аппарате составляло 1 ч. Полученную массу направляют в ректификационную колону 3, где отгоняют легкая фракция содержащая промоутер, непревращенный ацетон, воду и часчть фенола. В системе ректификационнфх колон 4 из этой фракции отгоняют ацетон плюс промоутер и воду. Оставляя в кубе фенол. Воду выводят на очистку, а ацетон и фенол возвращают на реакцию. Кубовый остаток колоны 3 содержит фенол, дифенилолпропан и побочные вещества. Фенол отгоняют в вакуум-ректифиационной колоне поз.5. и возвращают в реактор. Дефинилолпропан выделяют перекристаллизацией из органического растворителя. Смесь растворяют, в аппарате 6 и кристаллизуют при охлаждении в кристаллизаторе 7. Выпавшие кристаллы дефинилолпроана отделяют на центрифуге 8. Из маточного раствора в ректификационной колоне 9 регенириурют растворитель возвращаемый на стадию перекристаллизации. Кубовый остаток колон 9 содержащий значительное количество дифенилолпроана и побочных веществ направляют на дополнительную обработку в блок 10, откуда дифенилолпропан возвращают на перекристаллизацию, а тяжелые примеси на сжигание. Выход дифенилолпроана 90%
Мономеры для силаксановых каучуков.
Для синтеза силаксановых каучуков
используется диалкил или алкиларил
дихлорсиланы. Наибольшее примение
получили
 - диметилдихлорсилан. Диэтилдихлор
силан
- диметилдихлорсилан. Диэтилдихлор
силан ,
винилметилдихлорсилан
,
винилметилдихлорсилан
 .Способы
получения:
.Способы
получения:
Синтез с помощью металлорганических соединений
Взаимодействие хлорпроизводных с кремнием
Замещение в гидридхлорсиланах водорода на органические радикалы.
Метод 1
Это первый промышленный метод синтеза алкиларилхлорсиланов. Для проведения этих реакций можно использовать ртуть, цинк, натрий, литий, алюминий, и магний – органическией синтез или реакцию Гриньяра.
R-Hal + Mg R-Mg-Hal
Где R – этил, метил, фенил Hal чаще всего хлор.
Вторая стадия:
SiCl4 +R-Mg-Hal R-Si-Cl3+MgCl2
Затем эта реакция последовательно параллельна:
RSiCl3 +RMgCl R2SiCl2 + MgCl2
R2SiCl2 + RMgCl R3SiCl + MgCl2
R3SiCl + RMgCl R4Si + MgCl2
Получаем смесь алкилхлорсиланов.
Путем изменения соотношений исходных реагентов и условий процесса можно смещать реакцию в направлении образования определнного мономера. Реакция протекает с выделением большого количества теплоты, поэтому проводятися в разбавленных растворах и с большими предосторожностями.
Достоинства: гибкость, т.е одинаково пригоднсть для получения мономеров ралзной степени алкилирования. Выход 70% от теоретического.
Недостаток:
взрыво и пожароопасность
трудность регулирования процесса
Используется в основном для синтеза органохлорсиланов с разными радикалами у атома кремения, а именно для получения метилфенилдихлорсилана, этилфенилдихлорсилан и т.д.
Второй метод является основным промышленными методом получения кремний органических мономеров.
Используются галогеналкилы и кремний:
2 CH3Cl + Si (CH3)2SiCl2
2 C6H5Cl + Si (C6H5)2SiCl2
Побочная реакция:
4 CH3Cl + Si CH3SiCl3 + (CH3)3SiCl
Кроме того получается тетраметилсилан, тетрахлорсилан и т.д. Выход по этом методу 80%. Катализаотр используемая металлическая медь t= 300 C и выше. Процесс осуществляют в аппаратах с механическим перемешиванием или кипящим слоем.
Без катализатора процесс проводят при значительно более высокой температуре в результате образуется большое количество побочных продуктов. Прятомй синтез используют для получения метил, этил, фенил, хлор силанов.
Достоинства:
1) одностадийность процесса
2) нет растворителя
3) используется более дешевое сырье
3 Метод:
В качестве сырья используют гидрохлорсиланы и алкены
CH2=CHR + HSiCl3 RCH2CH2SiCl3
В результате получая алкил трихлорсилан
CH2=CHR + R’SiHCl2 RCH2CH2Si(R)Cl2
где R – органический радикал или функциональная группа CN, Cl. Карбоксильная группа аминогруппа.
Этот метод представляет интерес для синтеза кремний органических соединений с разными радикалами у атоми кремния. Выделения кремния органических мономеров в чистом виде представляет значительные трудности, тк. температуры кипеня продуктов лежат в узком интервале температур. Ректификация алкилхлорсиланов осуществляют в колоннах с большим флегмовым числом. Все алкиларилхлорсиланы – жидкости легко гидролизующиеся водой и влагой воздуха с выделением HCl. Ониобададют резким специфическим запахом, хорошо растворяются в обычных органических растворителях. Фенил хлорсиланы и метилхлор слан имеют высокую термическую стабильность.
