
Акрилонитрил.
Акрилонитрил – структруная формула следующая CH2=CH-CN. Это жидкость с температурой кипения 77,3°С ограниченно растворима в воде. Акрилонитрил важный мономер для производства синтетических волокн, каучуков и пластмасс. Акрилонитрил получают следующим методами Окислительный аммонолиз пропилена
CH2=CH-CN+NH3+1.5 O2 -> CH2=CH-CN + 3 H2O
на основе этиленоксида и синильной кислоты.
![]()
Из ацетилена и синильной кислоты:
![]()
Наибольшеен значение имеет первый метод. Его преимущества: одностадийность процесса, дешевезна и доступность сырья.
2) Пропилен вместо ацетилена и этиленоксида
3) Низкий расход энергии, воды, пара.
Пар генерируется при отводе тепла реакции.
В качестве сырья применяются пропилен и аммиак и воздух или технологический кислород. Для разбавления реакционной смеси применяется водяной пар, температура процесса 450-500 °С. В качестве катализатора используется оксды молибдена, висмута, кобальта, ванадия, олова, сурьмы на носителе. Наибольшее распространенными катализаторами являются молибдаты висмута Bi2Mo2O3 и их композиции с другими металлами. Многокомпонентные катализаторы обладают повышенной активностью.
Требования к сырью:
1) пропилен не должен содержать сернистых соединений отравляющих катализатор.
2) пропилен не должен содержать метан, который образует синильную кислоту
3) пропилен не должен содержать непредельные углеводороды образующие другие нитрилы
Побочные реакции:
CH2=CH-CH3 + 2 NH3 +2 O2 -> CH3CN + HCN + H2O
При взаимодействии пропилена с аммиаком в соотношении
CH2=CH-CH3 + NH3 +0,5 O2 -> CH3CN + CH4 + H2O
Помимо этого пропилен окисляется в акролеин
CH2=CH-CH3 + O2 -> CH2=CH-COH + H2O
CH2=CH-CH3 + 4,5 O2 -> 3 CO2 + 3 H2O
Кроме того образуются полимеры, и следы альдегидов.
Упрощенный механизм реакции запишем следующим образом. Сначала происходит окисление
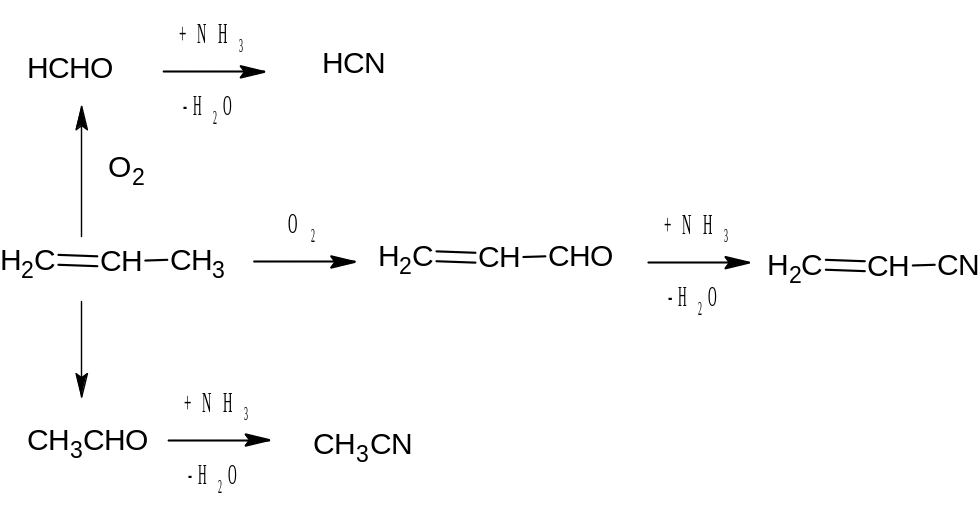
Лимитирующей стадией является окисление пропилена в альдегиды. Процесс окислительного аммонолиза, проводят при высоких температурах. Оптимальная температура 450-500 °С. Разбаление сырьевой смеси водяным паром благоприятно влияет на процесс окислительного аммонолиза. Соотношение кислорода и пропилена берется равным 1.5÷3:1 при более низкой концентрации кислорода активность катализатора снижается, мольное соотношение аммиака и пропилена, составляет 0,5÷1:1.
При снижении концентрации аммиака снижается выход акрилонитрила. Эта реакция имеет первый порядок по пропилену и нулевой порядок по кислороду и аммиаку. Конверсия пропилена на современных установках достигает 80-90% при селективности 80-85%. При такой конверсии пропилена можно обойтись без рециркуляции непрореагировашего пропилена. Что упрощает процесс.
Принципальная схема процесса:

Пропилен, воздух и аммиак поступают в реактор 1 с псевдожиженным слоем катализатора. Температура в реакторе до 510 °С давление 0,3 МПа. Теплореакции отводится при помощи охлаждающих змеевиков с циркулирующей под давлением водой, которая испарятеся образуя пар, используемый в технологическом процессе. Контактный газ направляется на дистилляцию в колону 2. В колоне 3 акрилонитрил отделяетя от ацетонитрила который отгоняется от воды и тяжелых примесей. В колоне 4 акрилонитрил сырец отделяется от синильной кислоты в колоне 5, от тяжелых остатков в колоне 6. Более подробно техн. схема приведена в альбоме на стр. 122. в мтет стр 66.
Окислительный аммонолиз пропилена может производится в трубчатых реакторе со стационарным слоем катализатора или в псевдоожиженном слое. В трубчатом реакторе процесс может идти в трубках 20-30 мм в качетсве охлаждающего агента прменятется нитрат-нитратные соств или кипящая вода. В трубках диаметром более 30 мм возможны местные перегревы. Трубчатые реакторы обладают ограниченной производительностью. Псевдоожиженном слое легче обеспечить изотермичнсоть процесса и организовать отвод тепла, однако селективность процесса в псевдоожиженом слое снижается вследствии внутри реакторного перемешивания и проскока газовых пузырей. Секционированные реактора решетками провального типа позволяетс приблизить показатели процесса к полученным в реакторе идеального вытестнения. Теплореакции можно отводить погруженным в псевдоожиженный слой змеевиком охлаждаемым изнутри испаряющейся под давлением водой. В промышленности преимущественно используют реакторы с псевдоожиженным слоем:
Винилацетат
Винилацетат: CH3=CH-OCOCH3
Это жидкость бесцетна с температурой кипения 73 °С. В воде при 20 °С растворяется 2,5% ВА. ВА применяется для получения поливнилацетатных клеев, эмульсий, спирта, полиацеталей, а также в производстве сополимеров с акрилонитролом, винилхлоридом и т.д.
Из ацетилена и уксусной кислоты, т.е. реакции винилирования:
С2H2 + CH3COOH CH3COOCH=CH2
Окисление этилена в присутствии хлорида палладия и уксусной кислоты. В этом случае вместо ацетилена используюется более дешевый этилен. Различают два варианта осуществления этого способа – это гомогенный каталитический процесс в жидкой фазе и второе гетерогенно каталитический процесс в газовой фазе. Более подробно остановимся на первом варианте:
Окисление этилена в винилацета в присутствии уксусной кислоты и растворимого катализатора хлорида палладия и ацетат натрия в катализаторе:
C2H4 +CH3COOH + PdCl2 CH3COOCH=CH2 + Pd + 2 HCl
Pd + 2 CuCl2 PdCl2 + 2 CuCl + H2O
2CuCl +2 HCl +0,5 O2 2 CuCl2 + H2O
Непрерывность процесса обеспечивается одноверменной или поперемнной подачей в реакционную массу этилена и воздуха.
Побочные реакции:
Образование этилена диацетата:
CH3COOCH=CH2 + CH3COOH CH3CH2(OCOCH3)2
Образование ацетальдегида в результате взаимодействия этиленового комплекса хлорида палладия с водой.
2 C2H2 + 2 PdCl2 + 2 H2O 2 CH3CHO + 2 Pd + 4 HCl
3. Процесс образования ацетальдегида при гидролизе винилацетата
CH3COOCH=CH2+ H2O CH3CHO + CH3COOH
Кроме того образуется хлорпроизводные щавелевой кислоты, в небольших количествах, сложные эфиры и муравьиная кислота от 3-7% этилена окисляется до диоксад углерода.
Температура процесса 100-130 °С давление 3 МПа, конценрация этилена должна быть 94,5% и кислорода 5,5%. При более низкой конценрации хлорид меди выпадает в осадок. Допустимая конценрация воды составляет от 4 до 10% от общего количества реагентов во избежании гидролиза винилацетата в ацетальдегди содержание ионов палладия в растовре катализатора должно составлять от 30 до 50 мг/л. Повышенное парциальное давление этилена способствует растворению этилена в жидкой фазе, что приводит к увеличению скорости реакции, но в тоже время влечен за собой и трудности связанные с необходимостью быстрого удаления винилацетата из реакционной зоны. При добавлении в раствор уксусной кислоты таких соединений как мочевина , амиды образование этилилдендиацетата значительно снижается. В промышленности наибольшее распространение получил газофазный процесс производства винилацетата окислением этилена на твердом металлическом катализаторе. 0,1-,2% Pd на оксиде алюминия или силикагле. В циркулирующую уксусную кислоту добавляют ацетат щелочного металла. Обычно процесс проводят в реакторе со стационарным слоем катализатора, но можно проводить его и в движуемся и в псевдожиженном слое катализатора. Реакция протекает с высокой селективностью практически без образования побочных продуктов и полимеров. Это упрощает и облегчает разделение реакционной смеси и очистку винилацетата, температура процесса 160 °С, давление 0,6 МПа. Пропускают этилен, пары уксусной кислоты и кислоту через слой катализатора. Высота которого от 5-15 м. В вертикальном реакторе охлаждаемом испаряющейся водой. Превращение за один проход составляет 10-15% по этилену, по 15-30% по уксусной кислоте и 60-90% по кислороду. Техноогическая схема выглядит следующим образом:
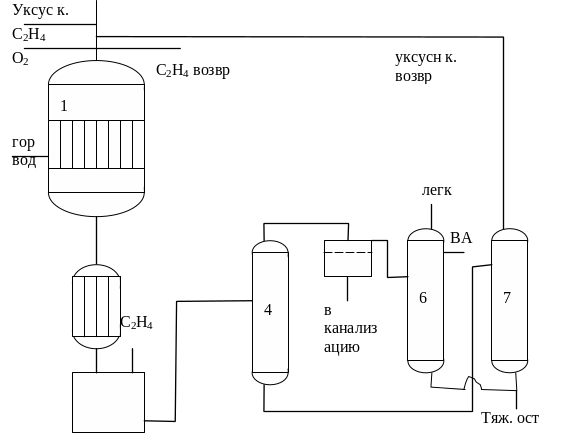
Свежий этилен, кислород и циркуляционные газы вводятся в вертикальный трубчатый реактор поз.1. Трубы реактора заполнены катализатором. В межтрубном пространстве циркулирует горячая вода на выходе из реактора подается холодная вода. Продукты охлаждаются в холодильнике 2 до 0 °С и конденсат отделяется от газов в сепараторе 3. Несконденсировавшеся газы направляются на разделение. Этилен отделенный или выделенный возвращается в реактор на окисление. Жидкая реакционная масса направляется в реатификационную колону 4. В колоне 4 отгоняется легкие продукты винилацетат и вода. Отгон поступает в отстойник 5, где вода и органические продукты разделяются на две фазы.
Органический слой поступает в ректификционную колону в которой отгоняются не большие количества низкокипящих компонентов. В остатоке остаются тяжелые примеси, а чистый винилацетат отбирается как боковой погон. Остаток из колоны 4 направляется в колону 7 сверха которой отгоняется рециркулирующая уксусная кислота, а снизу собирается не значительное количество высококипящих побочных продуктов.
Достоинства:
селективность
чистота винилацетата
Получение состоит во взаимодействии ацетилена с уксусной кислотой. В качестве катализатора используют ацетат цинка нанесенный на активированный уголь. Реакция протекает в газовой фазе при температуре 170-220 °С Побочные реакции:
Основнаые
С2H2 + CH3COOH CH3COOCH=CH2
Побочная
CH3COOCH=CH2 + CH3COOH CH3CH (OCOCH3)2
Образование ацетальдегида:
С2H2 + H2O CH3COH
Образование ацетона:
CH3COOH CH3COCH3 + CO2 + H2O
n CH2=CH-OCOCH3 [-CH2=CH(OCOCH3)-]
Чтобы подавить первую побочную реакцию этиледендиацетата, необходим избыток ацетитлена по отношению к уксусной кислоте 3.5÷1 : 5÷1.
Для подавления остальных реакций и повышения производительности реактора необходимо поддерживать сравнитлельно невысокую степень конверсии уксусной кислоты, приблизительно 60 %. Выход винилацетата достигает 95-98 % по уксусной кислоте и 92-95 % по ацетилену. Синтез проводят при атмосферном давлении в трубчатом реакторе генерируемым при этом пар используется на других стадиях. Упрощенная технологическая схема рис.32.
Парогазовая смесь исходных веществ подогревается в теплообменнике 1 горящиими реакционноыми газами и подают в реактор 2 выходящая из него смесь последовательно охлаждается в теплообменнике 1 отдавая тепло исходыой смеси и система водяных и рассольных холодильников поз. 3. где конденсируются все жидкие вещества и прореагироваший ацетилен, возвращают на приготовление исходной смеси после сепаратоа поз. 4. с помощью компрессао 6. А жидкость направляют на разделение в систему ректификационных колон 5, где отгоняют легкие фракции, винилацетат, уксусную кислоту возращают на синтез и ацецилендиацетат, тяжелые остаток направляют на сжигание.
