
Реферат
Дана курсовая робота займає 32 листа і містить в собі 2 ілюстрації ї 2 таблиці.
Було використано 5 основних літературних джерела.
Мета курсової роботи – розрахунок реактора прямого синтезу концентрованої
азотної кислоти,продуктивністю у розрахунку на HNO 5.7 т/годину.
При виконанні курсової роботи проведені матеріальний і тепловий розрахунки,
дані яких зведені в таблицях відповідних балансів. Розроблена принципова
технологічна схема процесу. Виконаний малюнок передбачуваної технологічної
схеми і основного апарату.
Як основний реактор вибраний автоклав безперервної дії тарілчастого типу з
Сітчастими тарілками. При 12 тарілках в автоклаві висота шару рідини на кожній
Тарілці буде 0,12 м. Висота робочої частини автоклава складає 8,5м.
АМІАК,АЗОТНА КИСЛОТА, ОКИСЛЕННЯ, НІТРОЗНИЙ ГАЗ, КОНТАКТНИЙ АПАРАТ, ПЛАТИНОЇДНИЙ КАТАЛІЗАТОР, СТУПІНЬ КОНВЕРСІЇ.
Зміст
Вступ
Характеристика готового продукту і початкової сировини
Фізико-хімічні основи процесу
Технологічна схема процесу
Матеріальний розрахунок контактного вузла
Тепловий розрахунок реактора
Вибір типа реактора і розрахунок його конструктивних розмірів
Розробка заходів щодо охорони навколишнього середовища
Висновки
Література
Вступ
Хімічна технологія – наука про найбільш економічні і екологічно обґрунтовані методи хімічної переробки сирих природних матеріалів в предмети споживання і засоби виробництва. Сучасна хімічна технологія, використовуючи досягнення природних і технічних наук, вивчає і розробляє сукупність фізичних і хімічних процесів, машин і апаратів, оптимальні шляхи здійснення цих процесів і управління ними при промисловому виробництві різних речовин, продуктів, матеріалів, виробів.
Хімічна промисловість одна з провідних галузей народного господарства; їй належить певна роль в прискоренні науково-технічного процесу, матеріального і культурного рівня життя народу. Науковою основою хімічної і суміжних з нею галузей промисловості є хімічна технологія, а базою технічного процесу цих галузей – хімічне машинобудування.
Одною з головних завдань галузей хімічного комплексу є розвитку хімічного матеріалознавства, створення і виробництво нових хімічних матеріалів, розвиток технології їх переробки радикальним чином впливають на підвищення надійності і довговічності машин і устаткування, зниженню їх матеріаломісткості, енергоємності і трудомісткості.
Основні тенденції розвитку сучасної хімічної промисловості зв’язані, перш за все, з вирішенням глобальних проблем людства. До них відносяться: продовольчі ресурси землі, ресурси мінеральної сировини для промисловості, енергетичні ресурси, запобігання забрудненню біосфери. Сучасний рівень хімічної технології і особливо рослинної дозволяє отримувати в промисловому масштабі з нехарчової рослинної сировини моносахариди, етанол, гліцерин, амінокислоти, різні концентрати та інші продукти.
Одній з провідних тенденцій хімічної технології, є створення принципово нового вигляду хімічних технологій, є сировини багатоцільового призначення. Такими продуктами є молекулярний водень, аміак, метанол, метанол, які виконують роль, як хімічних компонентів, так і вторинних енергоносіїв.
Азотна промисловість є важливою галуззю хімічної промисловості, що бурхливо розвивається. Від рівня її подальшого розвитку залежить забезпечення сільського господарства азотними добривами, а промисловості – різноманітними азотовмісними сполуками. Проблема отримання з`єднань азоту є життєво важливою для розвитку людства. Сучасна азотна промисловість є однією з самих передових галузей хімічної індустрії, яка розвивається на базі новітніх досягнень науки і техніки. У виробництві зв`язаного азоту застосовуються низькі температури, складні високоактивні каталізатори, для забезпечення великих швидкостей реакцій.
Азотна кислота є одним з найважливіших і багатотоннажних продуктів хімічної промисловості. Вона займає друге місце за об`ємом виробництва після сірчаної кислоти. Азотна кислота використовується в основному для виробництва мінеральних добрив, а також застосовується для отримання вибухових речовин, фарбників, пластмас, нітролаку, кіноплівки і інших найважливіших продуктів.
1.Характеристика початкової сировини і готової продукції
Азотна кислота є одним з найважливіших багатотоннажних продуктів
хімічної промисловості. Вона займає друге місце об`ємом виробництва після сірчаної кислоти. Азотна кислота широко застосовується для виробництва багатьох продуктів, використовуваних в промисловості і сільському господарстві. Так, близько 40% її витрачається на отримання складних і азотних мінеральних добрив; азотна кислота використовується для виробництва синтетичних фарбників, вибухових речовин, нітролаку, пластичних мас, лікарських синтетичних речовин і інших найважливіших
продуктів. [2]
Азотна
кислота
![]() -
безбарвна рідина з різким запахом,
гігроскопічна, купить при 86
-
безбарвна рідина з різким запахом,
гігроскопічна, купить при 86![]() ,
добре розчинна і воді. Азотна кислота
проявляє всі властивості кислот. Вона
відноситься до одноосновних кислот.
,
добре розчинна і воді. Азотна кислота
проявляє всі властивості кислот. Вона
відноситься до одноосновних кислот.
Концентрована
96-98%- на
червоно-бурого кольору від присутності
в ній
![]()
На
світлі і при нагріванні
розкладається на
![]() .
.
![]() O
+
O
+
![]()
Концентрована азотна кислота – один з найсильніших окислювачів, реагує майже зі всіма металами (за винятком золота, платини, іридію, родію) з утворенням нітратів, при цьому виділяються оксиди азоту. Алюміній, залізо і хром легко взаємодіють з розбавленою азотною кислотою, але практично не реагують з концентрованою кислотою унаслідок освіти на поверхні захисного тонкого шару окислу металу. Азотна кислота взаємодіє з багатьма неметалами, а також органічними сполуками.
Азотна кислота застосовується у виробництві азотних добрив, вибухових речовин,ліків, фарбників, пластичних мас, штучних волокон, як окислювач в реактивних двигунах і ін.
Нітрозі гази, отримані шляхом контактного окислення аміаку містять в основному оксид азоту(П) з якого при подальшому окисленні утворюється вищі оксиди азоту.
По стійкості у ряді термодинамічної стійкості оксиди азоту розташовуються в такій послідовності:
При
213 К –![]()
При
1170 K
- NO![]()
При
охолоджуванні до 294,5 К при атмосферному
тиску
![]() конденсується
в рідину червонувато-бурого кольору;
при 283К ця рідина набуває жовтого кольору,
при 262 К – утворюються безбарвні кристали.
конденсується
в рідину червонувато-бурого кольору;
при 283К ця рідина набуває жовтого кольору,
при 262 К – утворюються безбарвні кристали.
Рідкий
чотири окисел азоту
і вода розчиняється лише обмежено.
Критична температура розчинення рівна
67![]() вона відповідає змісту 89 вагових %
вона відповідає змісту 89 вагових %
![]()
Аміак
![]() – безбарвний
газ з різким характерним запахом, майже
в два рази легше за повітря, легко
стискається (
– безбарвний
газ з різким характерним запахом, майже
в два рази легше за повітря, легко
стискається (![]() ).
Аміак дуже добре розчинимо у воді (при
20
).
Аміак дуже добре розчинимо у воді (при
20![]() в одному об’ємі
в одному об’ємі
![]() розчиняються
700
об’ємів
розчиняються
700
об’ємів
![]() Розчин аміаку у воді називають аміачною
водою або нашатирним спиртом. При
взаємодії аміаку з водою утворюється
гідроокис амонію
Розчин аміаку у воді називають аміачною
водою або нашатирним спиртом. При
взаємодії аміаку з водою утворюється
гідроокис амонію
![]() - слабка підстава, яка існує лише у водних
розчинах. З кислотами аміак дає відповідні
солі амонію.
- слабка підстава, яка існує лише у водних
розчинах. З кислотами аміак дає відповідні
солі амонію.
Атмосферне повітря, вживає у виробництві азотної кислоти, забирається на території заводу або поблизу нього. Перед подачею в реактор повітря очищенню щоб уникнути отруєння каталізаторами [2].
Фізична
властивість кисню: за нормальних умов
кисень – газ без смаку запаху, кольору,
небагато важче за повітря. Розчинний у
воді в 100 об’ємах води розчиняється
близько 5 об’ємів
![]() . Рідкий кисень блакитного кольору, він
втягається в магнітне поле. Твердий
кисень має кристалічну структуру, і
також блакитного кольору.
. Рідкий кисень блакитного кольору, він
втягається в магнітне поле. Твердий
кисень має кристалічну структуру, і
також блакитного кольору.
Кисень реагує зі всіма металами, окрім золота і платини, з утворенням оксидів та пероксидів.
Кисень реагує майже зі всіма неметалами (окрім інертних газів), в більшості випадків – при нагріванні, при цьому також утворюються оксиди. З галогенами кисень не реагує навіть при підвищеній температурі.
Горіння складних речовин в надлишку кисню приводить до утворено оксидів. Під дією кисню повітря сірководень окислюється до вільної сірки. У всіх описаних вище реакціях кисень виступає в ролі окислювача. Процеси, що проходять за участю кисню в природі,- горіння, іржавіння, тління.
2. Фізико-хімічна основи процесу
В даний час азотну кислоту отримують методом контактного окислення аміаку. Технологія виробництва складається з двох основних стадій; окислення аміаку до окислу азоту і переробки її в азотну кислоту. Остання стадія включає окислення азоту вищих оксидів азоту з подальшим поглинанням їх водою.
Стадія окислення аміаку в окисел азоту в загальному вигляді виражає
![]()
Стадія окислення окису азоту к вищі оксиди азоту і переробки в азотну кислоту представить
![]()
![]()
Сумарне рівняння реакцій без урахування побічних, що проходять з утворенням елементарного азоту і інших з’єднань, можна виразити рівнянням:
![]() +421.2
кДж
+421.2
кДж
Окислення
аміаку киснем повітря без каталізатора
можливо тільки до
![]() .
На каталізатори між аміаком і киснем
протікають наступні паралельні реакції:
.
На каталізатори між аміаком і киснем
протікають наступні паралельні реакції:
![]()
![]()
![]() =
- 1328 кДж
=
- 1328 кДж
![]()
Одночасно з цими реакціями можуть протікати (паралельно і послідовно) побічні реакції:
![]()
![]()
![]()
Механізм утворення концентрованої азотної кислоти методом прямого синтезу можна представити у вигляді наступної сумарної реакції:
![]()
Приведені рівняння каталітичного окислення аміаку є сумарними і не відображують дійсного механізму процесу [2].
Реакції окислення аміаку супроводжуються значним спадом вільної енергії, протікають з великою швидкістю, практично необоротно (до кінця). Теплоти, реакції що виділяється в результаті, цілком достатньо, щоб процес протікав авто термічно.
Каталізатори, вживані для окислення аміаку, повинні володіти виморочним властивостями, тобто прискорюючи тільки одну зі всіх можливих реакцій, а саме реакцій (1) окислення аміаку до складу азоту (2). Найбільш селективним і активним каталізатором даної реакції виявився платиноїдний каталізатор, що є сплавом платини з паладієм і родієм. [3]
Каталітичне
окислення аміаку – багатостадійний
гетерогенно-каталітичний процес, що
протікає у зовнішньо дифузійній області
і лімітується дифузією аміаку до поверхні
каталізатора. Ряд гіпотез щодо механізму
окислення аміаку на платиноїдних
каталізаторах зводиться до припущень
про утворення в процесі окислення
![]() нестійких проміжних з’єднань, які в
результаті розпаду і перегруповування
дають оксид азоту (2) і елементний азот.
[2]
нестійких проміжних з’єднань, які в
результаті розпаду і перегруповування
дають оксид азоту (2) і елементний азот.
[2]
Абсорбція діоксину азоту.
Всі
види сполук азоту за винятком NO,
взаємодіють з водою з утворенням азотної
кислоти. Поглинання оксидів азоту
пов’язане з розчиненням в ній
![]() і утворенням азотної і азотистої кислоти
і утворенням азотної і азотистої кислоти
![]()
![]()
Вплив температури
Температура
робить найбільше на вихід оксиду азоту
(2). При підвищенні температури вихід NO
зростає, причому існує оптимальна
температура (для чистої платини –
900-920
![]() ),
при якій досягається максимальний
вихід.
),
при якій досягається максимальний
вихід.
Велике значення має температура запалення каталізатора, яка залежить від складу каталізатора і у меншій мірі, від складу аміачно-повітряної суміші.
Вплив тиску
Із зростанням тиску спостерігається зниження виходу оксиду азоту (2). Тому проектування і споруда установок з використанням підвищеного тиску на стадії конверсії аміаку стримується. Разом з тим використання високого тиску при окисленні аміаку дозволяє підвищити продуктивність агрегату, зменшити розміри апаратів. Цей факт у зв’язку з прагненням до збільшення одиничної потужності агрегатів набуває все більшого значення. На сучасних крупних агрегатах виробництва азотної кислоти процес окислення аміаку здійснюється під тиском 0,41-0,73 МПа. [2]
Основною умовою отримання високих виходів NO під тиском вище атмосферного є підвищення температури і часу контакту (збільшення числа сіток).
Каталізатори
Перевага платини по активності і селективності над всіма іншими видами каталізаторів була показана в 1902 році Освальдом. Характерно, що активність до реакції окислення аміаку проявляє переважна більшість металів і їх з’єднань, але високий вихід NO (вище 90%) забезпечують дуже небагато з них.[3]
Володіючи високою активністю і селективністю, платина має низьку температуру запалення 200 , хорошу пластичність, тягучість. Недолік платини – її швидке руйнування при високих температурах під впливом великих швидкісних потоків реагування і каталізаторних отрут . Це приводить до втрат дорогого каталізатора і зниження виходу NO, що і з’явилося причиною пошуків каталітично
активних сплавів платини з іншими металами. [2]
Проведені промислові випробування показали стабільну роботу каталізаторів з платини з добавками паладію, а також з постійною сплаву Pt-Rh-Pd. Найбільшого поширення набули наступні каталізатори окислення аміаку : Pt+4%Pd+3,5Rh- для роботи при атмосферному тиску і Pt+7,5%Rh – при підвищеному тиску.
3. Технологічна схема виробництва
Принципова технологічна схема процесу приведена на малюнку 1. Повітря забирають з атмосфери через трубку 25, очищають від пилу у фільтрі 24, стискають повітряним компресором 23 до 0,42 МПа і розділивши на два потоки, подають в контактний апарат і підігрівач аміаку. Рідний аміак (паро рідинна суміш) через ресивер 1 поступає у випарник 2, де випаровується при тиску 0,6 Мпа. Після випарника газоподібний аміак очищають від масла і механічних домішок у фільтрі 3 і направляють в підігрівач аміаку 4, де він нагрівається до 80-120 повітрям.
Очищене
повітря і аміак поступають в камеру
змішувача 22 контактні апарати 20.
Аміачно-повітряна суміш вмішує 9,6-10,0%
![]() що утворюється. Пройшовши тонке очищення
у фільтрі, вбудованому в контактний
апарат, аміачно-повітряна суміш поступає
на двохступінчатий каталізатор, що
складається з трьох платиноїдних сіток
і шару не платинового каталізатора.
що утворюється. Пройшовши тонке очищення
у фільтрі, вбудованому в контактний
апарат, аміачно-повітряна суміш поступає
на двохступінчатий каталізатор, що
складається з трьох платиноїдних сіток
і шару не платинового каталізатора.
Нітрозні гази при температурі 840-860 поступає в казан-утилізатор 19, розташований під контактним апаратом, де за рахунок їх охолоджування отримують пару тиском 40 МПа з температурною 440 . Казан живлять хімічно очищеною водою, деаерированной в колоні 17. Деаерірованна вода проходить теплообмінник 16, де нагрівається нітроз ними газами до 150 , економайзер 18 і потім поступає в барабан казана-утилізатора.
Нітрозні гази після казана-утилізатора охолоджуються в економайзері 18, віддають свою теплоту в підігрівачі 15 і потім поступають у водяний холодильник 14 для подальшого охолоджування до 55 . При охолоджуванні нітроз них газів відбувається конденсація пари води з утворенням 4-45%-ної азотної кислоти, яка подається в газовий промивач 13. Сюди ж поступають нітрозні гази.
У
промивачі відбувається одночасно з
охолоджуванням промивка нітроз них
газів від нітрит-нітратних солей і
подальша конденсація азотної кислоти.
Кислота з нижньої частини промивача
подається в колону абсорбції 10, а нітрозі
гази стискається в компресорі 12 до
11-12,6 Мпа, нагріваючись при цьому до
210-230
.
У холодильнику 11 другому ступеню до
60-65
і подають в колону абсорбції 10. На
тарілках колони розташовані змійовики
для охолоджування кислоти. Зверху в
колону поступає паровий конденсат (![]() )
з температурою не вище 40
.
Знизу колони виводиться 58-60%-на азотна
кислота; вона поступає в продувочну
колону 9 для видалення розчинених в ній
оксидів азоту і далі прямує в сховищі.
)
з температурою не вище 40
.
Знизу колони виводиться 58-60%-на азотна
кислота; вона поступає в продувочну
колону 9 для видалення розчинених в ній
оксидів азоту і далі прямує в сховищі.
Газ що відходить, з колони абсорбції нагрівається в підігрівачі (топковому пристрої)8, змішується в змішувачі 7 з природним газом і підігрітий до 480 прямує на каталітичне очищення від оксидів азоту в реактор. Каталізатором очищення служить алюмопалладієвий каталізатор АПК-2.
Після каталітичного розкладання вихлопів гази, що містять до 0,008% оксидів азоту при температурі 750 , поступають в турбіну рекуперації 5, що входить до складу газотурбінного агрегату. Тут теплова енергія вихлопних газів перетворюється в механічну з одночасним зниженням тиску газу до 0,95-1,05 МПа. Енергія, що виробляється в газовій турбіні, використовується для приводу компресорів 12 і 23.
4. Матеріальний розрахунок реактора
Розрахунок реактора прямого синтезу концентрованої азотної кислоти зводиться до розрахунку автоклава
У
автоклаві унаслідок взаємодії
![]() ,
,
і
,
,
і
![]() утворюється концентрована
утворюється концентрована
![]() по
рівнянню:
по
рівнянню:
![]()
В результаті реакції отримуємо концентровану кислоту (98,5%). Тоді чистої азотної кислоти без води, отримано:
![]()
Для утворення потрібно води:
![]() =
=![]() =816,97
кг
=816,97
кг
А для отримання 98,5%-ного розчину
![]() =
5800-5718.8=81,2 кг
=
5800-5718.8=81,2 кг
Всього потрібно води:
816,97+81,2=898,17 кг
Кількість ,що вводиться у автоклав складає:
![]() =
=
![]() =4176,63
кг
=4176,63
кг
Загальна кількість , що фактично поступає в автоклав, з урахуванням надлишку (1,72), складає:
![]() =4176.63
=4176.63
![]() 1,78=7432,62
кг
1,78=7432,62
кг
Кількість
в масовому відношенні
![]() :
в
сирій суміші складає (0,32):
:
в
сирій суміші складає (0,32):
![]() =7432,62
=7432,62
![]() 0,31 =2304,1 кг
0,31 =2304,1 кг
Кількість у нітролеумі на виході :
![]() =
5718,8 + 2304,1=8022,9 кг
=
5718,8 + 2304,1=8022,9 кг
На реакцію окислення до потрібно
![]() =
=![]() =726,19
кг
=726,19
кг
Об’ємом кисню складає
![]() =
=![]() =508,3
кг
=508,3
кг
З урахуванням надлишку кисню, який складає 1,49 отримаємо:
![]() 726,19
726,19![]() =1082,0
кг
=1082,0
кг
Об’ємом фактично поданого кисню складає :
![]() =
=![]() =757,4
=757,4
![]()
Оскільки
складає 98,1% об.., а
-1,9% об. Знаходимо спільний об’єм
![]()
V=![]() =
=![]() =768,95
=768,95
Знаходимо
об’єм, який займає
![]()
![]() =768,95
– 757,4=11,55
=768,95
– 757,4=11,55
Маса складатиме
![]() =
=![]() =17,44
кг
=17,44
кг
Вітдувочні
гази складаються з
![]() ,
та
,
та
![]()
![]() =
-
=
-
![]() =1082,2
-726,19=355,81 кг
=1082,2
-726,19=355,81 кг
![]() =
=![]() =249,07
=249,07
![]() =
=![]() =17,44
кг
=17,44
кг
![]() =
=![]() =11,55
=11,55
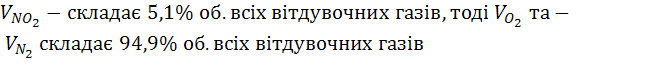
![]() 249,07+11,55=260,6
249,07+11,55=260,6
![]() =
=![]() =15,1
=15,1
![]() =
=![]() =31,0
кг
=31,0
кг
У нітролеумі залишається
![]() =
=![]() -
-![]() -
=
7432,62-4176,63-31,0=3224,99 кг
-
=
7432,62-4176,63-31,0=3224,99 кг
Результати матеріального розрахунку заносимо в таблицю матеріального балансу 1
Таблиця
1 Матеріальний баланс процесу отримання
Концентрованої
![]() у
розрахунку на годину продуктивність.
у
розрахунку на годину продуктивність.
Прихід |
Витрата |
||||
Вих. реч. |
Маса,кг |
Мас. доля,
|
Продукти |
Маса, кг |
Мас. Доля,
|
Сира суміш, складу |
10634,89 |
90,65 |
Нітролеум, складу |
11629,09 |
97,43 |
|
2304,1 7432,62 898,17 |
|
|
8022.9 3524,99
81.2 |
|
Технічний Кисень,складу |
1097,1 |
9,35 |
Вітдувочні гази |
306,7 |
2,57 |
|
1082,0 15,1 |
|
|
260,6 15,1 31,0 |
|
Всього |
11731,99 |
100 |
ВСього |
11935,79 |
100 |
