
- •1 Электромагнитные свойства ферритов
- •1.1 Основные понятия о ферритах.
- •1.2 Ферримагнетизм
- •1.3 Магнитомягкие ферриты
- •2 Спекание твердых тел
- •2.1 Спекание однокомпонентных систем.
- •2.1.1 Механизмы транспорта вещества
- •2.1.1.1 Уплотнение порошкового тела.
- •2.2 Спекание многокомпонентных систем
- •2.2.1 Системы с полной взаимной растворимостью компонентов.
- •2.2.2 Системы с ограниченной растворимостью компонентов.
- •2.3 Спекание пьезокерамики
- •2.4 Основные положения теории спекания
- •3 Макроскопическая и микроскопическая теории диэлектриков
- •3.1 Макроскопическая теория
- •3.2 Микроскопическая теория
- •4.1 Основные положения сегнетоэлектриков.
- •4.2 Доменная микроструктура сегнетоэлектрика
- •5 Методы получения функциональных материалов
- •5.1 Керамическая технология
- •5.1.1 Выбор и подготовка сырья
- •5.2 Химические методы производства
- •5.2.1 Метод совместного осаждения
- •5.2.2 Полукерамический метод
- •5.2.3 Распылительная сушка растворов
- •5.2.4 Криохимический метод
1.2 Ферримагнетизм
Антиферромагнитное состояние впервые рассмотрено Л.Д. Ландау и в дальнейшем развито Неелем. В результате были открыты некоторые новые практически важные физические явления и материалы, в частности ферриты.
При отрицательном знаке обменного интеграла энергетически выгодной является антипараллельная ориентация спинов соседних атомов решетки. Кристаллы, у которых спиновые магнитные моменты соседних атомов решетки одинаковы по величине, направлены антипараллельно и компенсируют друг друга, получили название антиферромагнетиков.
Простейшая модель антиферромагнетика предполагает разделение решетки магнитных атомов на две взаимопроникающие подрешетки, причем каждый атом одного сорта имеет ближайшими соседями только атомы другого сорта. Данная структура возможна лишь при температуре ниже некоторой температуры, называемой точкой Нееля TN.
При абсолютном нуле магнитные моменты подрешеток компенсируют друг друга, и результирующий магнитный момент антиферромагнетика в отсутствие магнитного поля равен нулю. При повышении температуры антипараллельное расположение спинов разрушается тепловым движением, и появляется намагниченность IS антиферромагнетика, которая в точке TN достигает максимального значения (рис. 1.1).

Рис. 1.1 Температурная зависимость магнитной восприимчивости пара- (а), ферро- (б) и антиферромагнитных (в) материалов: 1 – парамагнетики, 2 – ферромагнетики, 3 – антиферромагнетики[4]
При этом полностью исчезает упорядоченное расположение спинов, и антиферромагнетик становится парамагнетиком. С дальнейшим ростом температуры намагниченность уменьшается по закону Кюри-Вейса для парамагнетиков.
Под действием внешнего магнитного поля антиферромагнетики подобно парамагнетикам приобретают слабую намагниченность при Т = 0. В сильных магнитных полях при T<TN могут наблюдаться магнитные фазовые переходы: направление намагниченности подрешеток может скачком изменяться на 90° относительно ОЛН и приложенного поля, либо направления IS подрешеток становятся параллельными друг другу и совпадают с направлением приложенного поля.
Если магнитные подрешетки содержат неодинаковое количество или разные по природе атомы, то магнитные моменты подрешеток неодинаковы, и при противоположном их направлении результирующий магнитный момент подрешеток уже не равен нулю, что приводит к спонтанному намагничиванию кристалла. Такой нескомпенсированный антиферромагнетизм называется ферримагнетизмом, а сами кристаллы - ферримагнетиками.
Примером
ферромагнетика является магнетит Fe3O4,
точная химическая формула которого
![]() .
Он имеет гранецентрированную кубическую
(ГЦК) решетку. Узлы
последней составлены из двукратно
ионизованных атомов кислорода, в
промежутках между которыми располагаются
катионы железа; 8
ионов Fe2+
занимают октаэдрические пустоты и 16
ионов Fе3+
- октаэдрические и тетраэдрические
пустоты (междоузлия) с определенной
ориентировкой.
.
Он имеет гранецентрированную кубическую
(ГЦК) решетку. Узлы
последней составлены из двукратно
ионизованных атомов кислорода, в
промежутках между которыми располагаются
катионы железа; 8
ионов Fe2+
занимают октаэдрические пустоты и 16
ионов Fе3+
- октаэдрические и тетраэдрические
пустоты (междоузлия) с определенной
ориентировкой.
Двухвалентные ионы железа могут быть замещены ионами других двухвалентных металлов (Mg, Ni, Co, Cu и др.). Такие ферримагнетики
имеют
общую формулу
![]() и называются ферритами.
и называются ферритами.
Известен ряд структур ферритов. Наибольший интерес представляют следующие:
феррошпинели, имеющие кристаллическую структуру природного минерала шпинели MgO·Al2O3;
феррогранаты - ферриты со структурой минерала граната Ca3Al2(SiO4)3;
гексаферриты - ферриты с гексагональной структурой MeFe12O19 (где Ме – Ba, Pb, Sr);
ортоферриты - ферриты с орторомбической структурой типа искаженной структуры перовскита СаTiOз.
Рассмотрим одну из структур – феррошпинель, имеющую кристаллическую структуру природного минерала шпинели MgO·Al2O3;
На рис 1.2 приведена нормальная структура шпинелидов.

Рис.
1.2. Структура нормальной шпинели:
![]() - ионы кислорода,
- ионы кислорода,
![]() - ионы соответственно двух- и трехвалентного
метала[4]
- ионы соответственно двух- и трехвалентного
метала[4]
Кристаллическую структуру шпинели можно рассматривать с позиций теории плотнейших упаковок. Анионы О2- образуют плотную кубическую гранецентрированную упаковку, а катионы Ме2+ и Fe3+ располагаются в пустотах. В элементарную ячейку входят восемь формульных единиц MeFe2O4. Таким образом, 32 аниона O2- образуют плотноупакованную кубическую гранецентрированную элементарную ячейку шпинели. Узлы занимаемые О2- обычно обозначаются как 32с-узлы.
При плотной упаковке анионы О2- в элементарной ячейке образуется 64 тетраэдрических и 32 октаэдрических пустоты. В этих пустотах и располагаются катионы Ме2+ и Fe3+, занимающие 8 тетраэдрических пустот (обозначают 8а) и 16 октаэдрических пустот (обозначают 16d).
Элементарную ячейку шпинели можно условно разбить на 8 отдельных кубиков-октантов с ребрами, равными половине параметра ячейки. При этом одинаковое расположение ионов будет наблюдаться в октантах, соприкасающихся ребрами (рис. 1.3).

Рис. 1.3. Разделение элементарной ячейки шпинели на октанты с одинаковым расположением ионов
Таким образом, можно ограничиться рассмотрением расположения ионов только в двух октантах, так как в остальных эти варианты будут повторятся.
Расположение ионов в двух октантах элементарной ячейки шпинели показано на рис. 1.4.
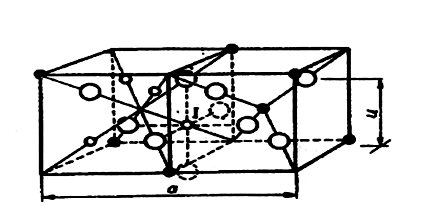
Рис. 1.4. Расположение ионов в октантах ячейки шпинели
Узлы:
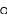 - 16d;
- 32c;
- 16d;
- 32c;
 - 8а.
- 8а.
Видно, что тетраэдрические пустоты – или 8а-узлы – находятся в четырех из восьми вершин куба и в одном октанте в центре куба; в соседнем октанте центр куба не занят. Октаэдрические пустоты – 16d-узлы – находятся только в том октанте, где в центре нет 8а-узла. Образование октаэдрической пустоты для иона 1 происходит с участием двух ионов О2- (пунктир), находящиеся вне пределов данных октантов[5].
Предпочтение определенного координационного окружения для ионов металлов связано с размерами и конфигурацией электронных оболочек ионов, электростатической энергией, высокотемпературным нагревом, энергией анионной поляризации. Сумма зарядов катионов в структуре шпинели всегда равна 8.
В зависимости от распределения катионов по О- и Т- положениям различают различные виды структуры феррошпинелей. Обозначая через λ так называемый параметр обращенности шпинели АВ2О4 (т.е. удельную часть катионов В3+, расположенных в Т- позициях), общую формулу распределения металлических ионов по подрешеткам шпинели можно записать следующим образом:
![]() (1.1)
(1.1)
При λ=0 формула (1.1) описывает распределение катионов для нормальной шпинели, а при λ=1 – для обращенной. Если 0 < λ < 1, то имеет место смешанная структура шпинели. При статическом распределении ионов металлов по подрешеткам λ=2/3 выражение для нормальной шпинели может быть представлено в виде:
А2+[В3+]2О4. (1.2)
Параметр λ, определяющий долю ионов Fe3+, расположенных в Т- положениях, зависит от химического состава феррита, способа его приготовления, режима термической обработки и склонности катионов занимать определенные положения в структуре.
