
- •Термодинамическая система. Температура.
- •Т ермодинамическая температура (шкала).
- •Энтропия. Общая формулировка второго закона (начала) термодинамики.
- •Термодинамические потенциалы.
- •Теплоемкость.
- •Энтропия. Вероятностная формула энтропии.
- •Термодинамические системы. Классификация по степени изолированности.
- •Функция вероятности для микроканонического ансамбля.
- •Ф ункция вероятности для канонического ансамбля. Статистическая сумма. Связь статистической суммы с термодинамическими величинами.
- •Функция вероятности для большого канонического ансамбля. Статистическая сумма. Связь статистической суммы с термодинамическими величинами.
- •Функции плотности вероятности для непрерывных n – частичных классических систем. Фазовое пространство. Квазиклассическое приближение. Фазовая ячейка. Тождественность частиц.
- •Функция плотности вероятности для идеального газа (канонический ансамбль, отсутствие внешнего поля). Термодинамика идеального газа.
- •Идеальный газ во внешнем поле. Химический потенциал. Барометрическая формула.
- •Термодинамика квантовых систем. Излучение абсолютно черного тела. Закон Стефана-Больцмана.
- •Квантовая теория теплоемкости кристаллов.
- •Квантовый идеальный газ.
- •Конденсация Бозе-Эйнштейна. Идеальный газ бозонов при низкой температуре.
- •Идеальный газ фермионов при низкой температуре.
- •Флуктуации термодинамических величин.
Теплоемкость.
Теплоемкость определяет «температурную инерционность» системы.
![]() .
.
X - условия теплообмена. Удельные теплоемкости
![]() - массовая удельная теплоемкость
- массовая удельная теплоемкость
![]() - мольная удельная теплоемкость.12
- мольная удельная теплоемкость.12
В справочной литературе обычно приводятся
значения теплоемкостей при постоянном
объеме CV
и постоянном давлении CP.
Величина теплоемкости может быть любой
(положительной, отрицательной, нулевой,
бесконечной). Величина определяется
условиями теплообмена.
справочной литературе обычно приводятся
значения теплоемкостей при постоянном
объеме CV
и постоянном давлении CP.
Величина теплоемкости может быть любой
(положительной, отрицательной, нулевой,
бесконечной). Величина определяется
условиями теплообмена.
Задача. Определите величину теплоемкости моля идеального одноатомного газа на прямой линии диаграммы P – V.
Уравнение прямой линии в координатах P – V
![]() .
.
Используемые уравнения (термическое и калорическое уравнения газа, первый закон термодинамики)
 .
.
Из последнего уравнения
![]() .
.
Производную на прямой линии p0 – v0 определяем, используя уравнение прямой и термическое уравнение.
 .
.
 .
.
![]() .
.

График полученного результата показывает
диапазон изменения теплоемкости вдоль
прямой. В середине линии теплоемкость
терпит разрыв. Граничные теплоемкости
соответственно равны 5/2 и 3/2. В точке
![]() теплоемкость равна 0.
теплоемкость равна 0.
Задача. Получить уравнение политропического процесса. Политропическим процессом называется процесс при постоянной теплоемкости.
Будем использовать
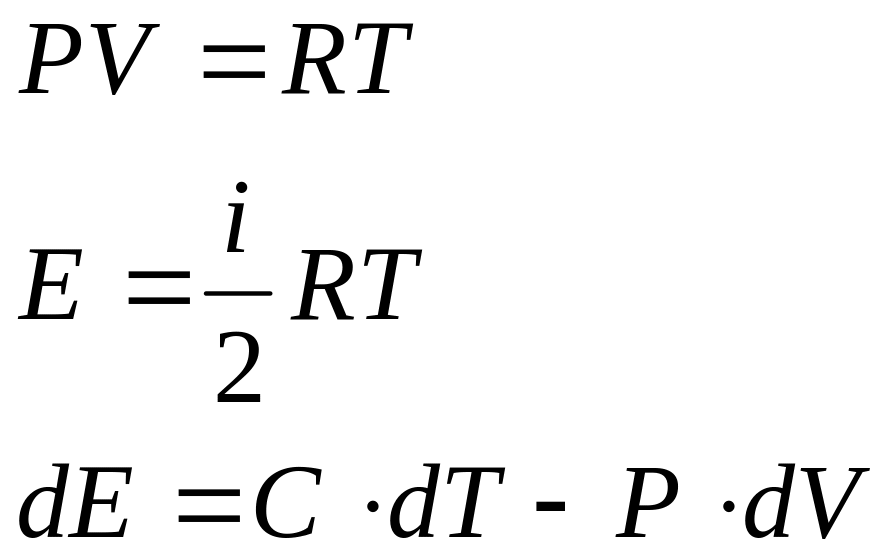 .
.
Используя первые два уравнения, преобразуем дифференциальное уравнение первого закона термодинамики
 .
.
Обозначим
![]() .
Дифференциальное уравнение политропы
переписывается
.
Дифференциальное уравнение политропы
переписывается
![]() .
Интегрирование приводит к уравнению
.
Интегрирование приводит к уравнению
 .
(10)
Здесь и далее теплоемкость выражена
в единицах R.
.
(10)
Здесь и далее теплоемкость выражена
в единицах R.
Изохорный процесс. Очевидно, что в этом случае
 .
.Изобарный процесс. В формуле (10) перейдем к давлению

![]() .
.
Очевидно, что давление будет постоянным
при условии
![]() .
Отсюда
.
Отсюда
![]() .
.
Адиабатный процесс. C = 0. Подстановка в (10) определяет уравнение адиабаты
![]()
 .
.
Изотермический процесс. Преобразуем формулу (10) к виду
 .
.
Температура будет константой при условии
![]() .
.
Процесс с линейной зависимостью давления от объема. В формуле (10) избавляемся от температуры
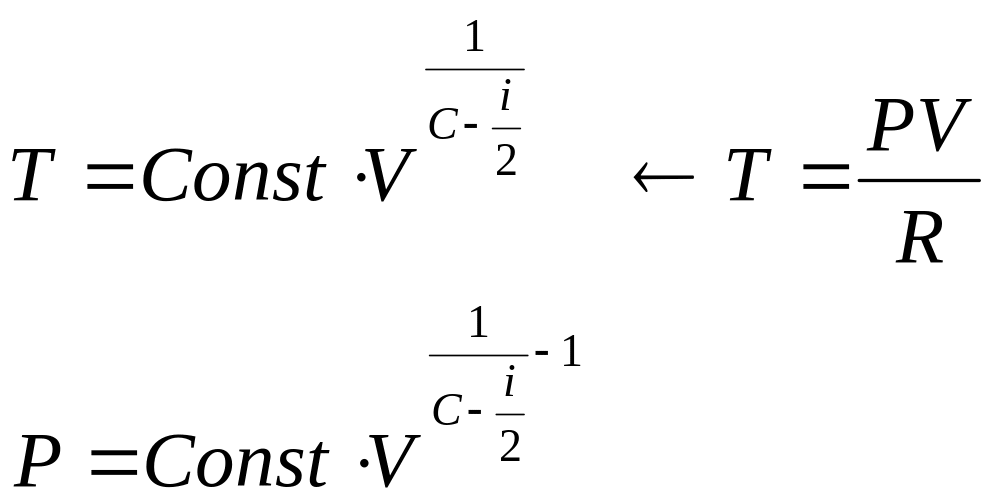 .
.
Для линейной зависимости давления от объема необходимо выполнения условия
 .
Отсюда получаем
.
Отсюда получаем
![]() .
.
Рисунок иллюстрирует спектр политропных процессов с различными теплоемкостями. Процессы идущие вблизи изотермы имеют бесконечные теплоемкости.
С
 татистическая
термодинамика.
татистическая
термодинамика.
Энтропия. Вероятностная формула энтропии.
Для системы с дискретным набором состояний энтропия определяется в соответствии с формулой13
![]() (11)
Структура формулы соответствует
среднему значению логарифма вероятности.
Энтропия обладает свойством аддитивности.
Пусть имеем две невзаимодействующие
дискретные системы. Тогда вероятность
состояния общей системы определяется
произведением вероятностей
(11)
Структура формулы соответствует
среднему значению логарифма вероятности.
Энтропия обладает свойством аддитивности.
Пусть имеем две невзаимодействующие
дискретные системы. Тогда вероятность
состояния общей системы определяется
произведением вероятностей
![]() .
Энтропия общей системы запишется
формулой
.
Энтропия общей системы запишется
формулой
![]() .
.
После преобразования
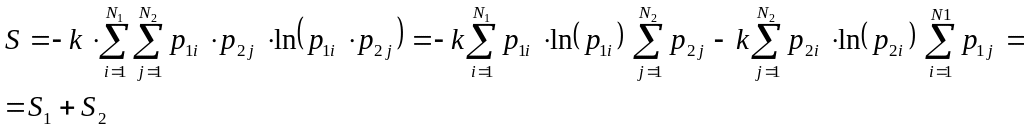 .
.
Энтропия общей системы равна сумме энтропий ее частей.
Термодинамические системы. Классификация по степени изолированности.
Полностью изолированная система. Ансамбль изолированных систем называется микроканоническим ансамблем.14
Система, погруженная в термостат (открыта по теплообмену и закрыта по объему и числу частиц) сохраняет постоянную температуру. Ансамбль систем в термостате называется каноническим ансамблем.
Система погружена в термостат и открыта по числу частиц. Ансамбль таких систем называется большим каноническим ансамблем.
Система, открытая по объему (цилиндр имеет подвижный поршень) сохраняет постоянным давление.
Полностью открытая система. Такая система погружена в термостат, имеет подвижный пористый поршень. В ней сохраняется температура, поддерживается постоянным давление и не сохраняется число частиц.
