
- •Термодинамическая система. Температура.
- •Т ермодинамическая температура (шкала).
- •Энтропия. Общая формулировка второго закона (начала) термодинамики.
- •Термодинамические потенциалы.
- •Теплоемкость.
- •Энтропия. Вероятностная формула энтропии.
- •Термодинамические системы. Классификация по степени изолированности.
- •Функция вероятности для микроканонического ансамбля.
- •Ф ункция вероятности для канонического ансамбля. Статистическая сумма. Связь статистической суммы с термодинамическими величинами.
- •Функция вероятности для большого канонического ансамбля. Статистическая сумма. Связь статистической суммы с термодинамическими величинами.
- •Функции плотности вероятности для непрерывных n – частичных классических систем. Фазовое пространство. Квазиклассическое приближение. Фазовая ячейка. Тождественность частиц.
- •Функция плотности вероятности для идеального газа (канонический ансамбль, отсутствие внешнего поля). Термодинамика идеального газа.
- •Идеальный газ во внешнем поле. Химический потенциал. Барометрическая формула.
- •Термодинамика квантовых систем. Излучение абсолютно черного тела. Закон Стефана-Больцмана.
- •Квантовая теория теплоемкости кристаллов.
- •Квантовый идеальный газ.
- •Конденсация Бозе-Эйнштейна. Идеальный газ бозонов при низкой температуре.
- •Идеальный газ фермионов при низкой температуре.
- •Флуктуации термодинамических величин.
Энтропия. Общая формулировка второго закона (начала) термодинамики.
М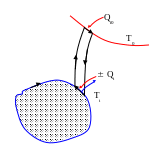 ожно
показать, что для замкнутого равновесного
цикла справедливо следующее интегральное
соотношение
ожно
показать, что для замкнутого равновесного
цикла справедливо следующее интегральное
соотношение
![]() (2)
(dQ – дифференциальная
теплота обмена с источником при
температуре T).
Доказательство проводится по схеме,
представленной на рисунке. Основной
цикл совмещают с дифференциальными
циклами Карно между базовой температурой
T0 и температурой
Ti
участка цикла. При этом теплоты принятые
и отданные на участке основного цикла
делают равными. Известно, что для цикла
Карно
(2)
(dQ – дифференциальная
теплота обмена с источником при
температуре T).
Доказательство проводится по схеме,
представленной на рисунке. Основной
цикл совмещают с дифференциальными
циклами Карно между базовой температурой
T0 и температурой
Ti
участка цикла. При этом теплоты принятые
и отданные на участке основного цикла
делают равными. Известно, что для цикла
Карно
![]() .
.
В результате такого «сложного» цикла
система получает тепло
![]() и полностью превращает его в работу,
что запрещено постулатом Клаузиуса
(вторым началом термодинамики). Поэтому
должно выполняться условие (2), определенное
выше. Формула (2) позволяет ввести в
термодинамику понятие энтропии, как
функции состояния системы.
и полностью превращает его в работу,
что запрещено постулатом Клаузиуса
(вторым началом термодинамики). Поэтому
должно выполняться условие (2), определенное
выше. Формула (2) позволяет ввести в
термодинамику понятие энтропии, как
функции состояния системы.
![]()
 (3)
При дифференциальном (равновесном)
обмене теплотой с источником изменение
энтропии системы равно
(3)
При дифференциальном (равновесном)
обмене теплотой с источником изменение
энтропии системы равно
![]() .
Для двух произвольных состояний системы
изменение энтропии в ходе равновесного
перехода записывается интегралом
.
Для двух произвольных состояний системы
изменение энтропии в ходе равновесного
перехода записывается интегралом
![]() .
(4)
Если процесс перехода в новое
состояние не является равновесным, то
соотношение (4) должно записываться в
виде неравенства
.
(4)
Если процесс перехода в новое
состояние не является равновесным, то
соотношение (4) должно записываться в
виде неравенства
![]() .
(5)
Для теплоизолированной системы
получаем
.
(5)
Для теплоизолированной системы
получаем
![]() .
(6)
Изменение энтропии замкнутой
системы возможно только при условии,
что система находилась в неравновесном
состоянии. Потому, энтропия изолированной
неравновесной системы при переходе к
равновесию увеличивается.
.
(6)
Изменение энтропии замкнутой
системы возможно только при условии,
что система находилась в неравновесном
состоянии. Потому, энтропия изолированной
неравновесной системы при переходе к
равновесию увеличивается.
Соотношение (6) является наиболее общей формой второго начала термодинамики и называется неравенством Клаузиуса.
Использование формулы (3) позволяет записывать первый закон термодинамики для равновесных процессов с использованием дифференциала энтропии (для газа)10
![]() .
(7)
.
(7)
Т
 ретье
начало термодинамики. (сформулировано
В.Г. Нернстом в 1906 году) При приближении
температуры к 0 К энтропия стремится
к определенному пределу. Равновесные
процессы при 0 К проходят без изменения
энтропии. Энтропия при 0 К не зависит
от значений параметров, характеризующих
состояние системы (объема, давления и
т.д.). Числовое значение энтропии при 0
К не фиксировано, но его удобно выбрать
равным нулю.11
ретье
начало термодинамики. (сформулировано
В.Г. Нернстом в 1906 году) При приближении
температуры к 0 К энтропия стремится
к определенному пределу. Равновесные
процессы при 0 К проходят без изменения
энтропии. Энтропия при 0 К не зависит
от значений параметров, характеризующих
состояние системы (объема, давления и
т.д.). Числовое значение энтропии при 0
К не фиксировано, но его удобно выбрать
равным нулю.11
Термодинамические потенциалы.
В термодинамике чаще всего используют четыре энергетические функции, называемые термодинамическими потенциалами: энергия, свободная энергия Гельмгольца, термодинамический потенциал Гиббса (большой потенциал), энтальпия (тепловая функция).
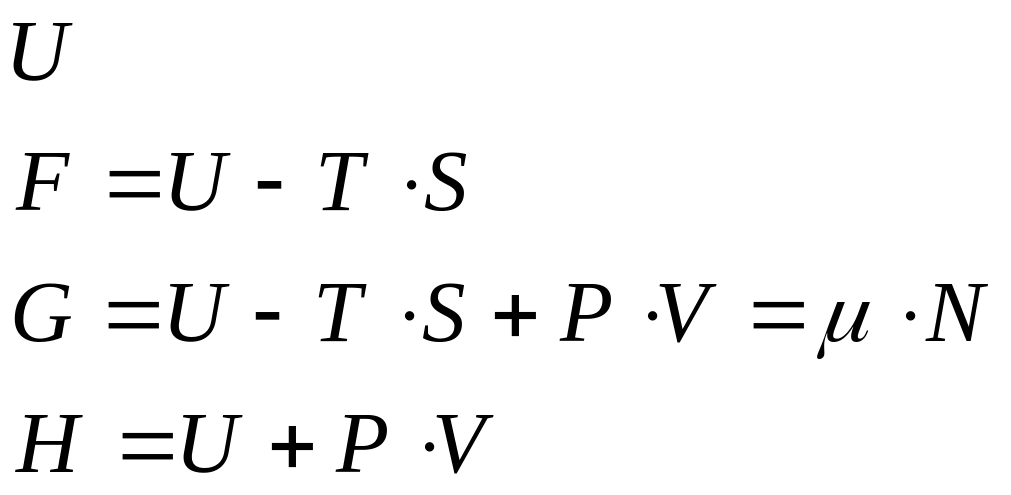 .
(8)
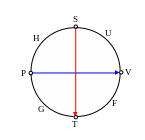
Дифференциалы этих потенциалов
можно получить, используя мнемоническую
схему Максвелла.
.
(8)
Дифференциалы этих потенциалов
можно получить, используя мнемоническую
схему Максвелла.
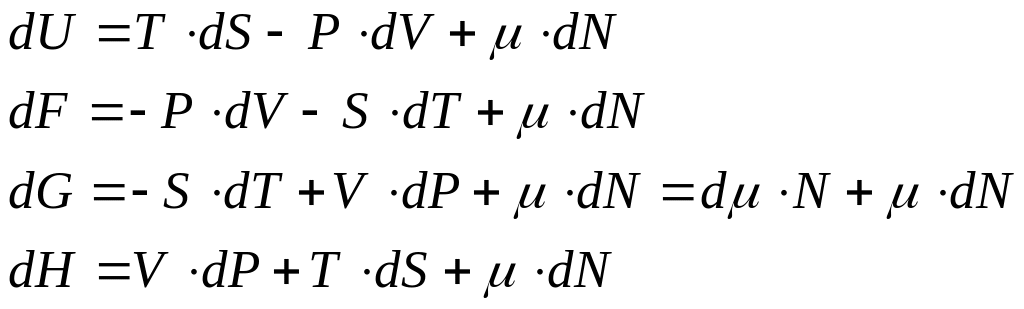 .
(9)
Символ термодинамического потенциала
стоит между двумя величинами, которые
«образуют» дифференциалы. Множители
дифференциалов стоят напротив величин.
Знак слагаемого определяется направлением
стрелок. «Движение» от дифференциала
к множителю против стрелки дает знак
минус (по стрелке плюс). Треть слагаемое
у всех дифференциалов одинаковое.
Формулы (9) уточняют определение
химического потенциала. Наиболее
«понятное» определение получается на
основе термодинамического потенциала
Гиббса.
.
(9)
Символ термодинамического потенциала
стоит между двумя величинами, которые
«образуют» дифференциалы. Множители
дифференциалов стоят напротив величин.
Знак слагаемого определяется направлением
стрелок. «Движение» от дифференциала
к множителю против стрелки дает знак
минус (по стрелке плюс). Треть слагаемое
у всех дифференциалов одинаковое.
Формулы (9) уточняют определение
химического потенциала. Наиболее
«понятное» определение получается на
основе термодинамического потенциала
Гиббса.
![]()
- численно равно удельному изменению потенциала Гиббса при условиях постоянства температуры и давления.
Смысл введения термодинамических потенциалов состоит в следующем. При различных условиях равновесие системы соответствует минимуму некоторого термодинамического потенциала.
