
- •Бийский технологический институт (филиал)
- •Краткий курс биотехнологии
- •1 Природа и многообразие биотехнологических процессов
- •1.1 Введение
- •История развития биотехнологических процессов
- •1.3 Микроорганизмы, используемые в биотехнологических процессах
- •2 Производство белков одноклеточных организмов
- •2.1 Целесообразность использования микроорганизмов для
- •Производства белка
- •2.2 Использование дрожжей
- •2.3 Использование бактерий
- •2.4 Использование водорослей
- •2.5 Использование микроскопических грибов
- •3 Методы генетического конструирования
- •In vivo
- •3.1 Регуляция метаболизма в микробной клетке
- •3.2 Мутагенез и методы выделения мутантов
- •3.3 Плазмиды и конъюгация у бактерий
- •3.4 Фаги и трансдукция
- •3.5 Гибридизация эукариотических организмов
- •3.6 Слияние протопластов или фузия клеток
- •4 Технология производства метаболитов
- •4.1 Классификация продуктов биотехнологических производств
- •4.2 Общая схема биотехнологического производства продуктов микробного синтеза
- •4.3 Биотехнология получения первичных метаболитов
- •4.3.1 Производство аминокислот
- •4.3.2 Производство витаминов
- •4.3.3 Производство органических кислот
- •4.4 Биотехнология получения вторичных метаболитов
- •4.4.1 Получение антибиотиков
- •4.4.2 Получение промышленно важных стероидов
- •5 Биоиндустрия ферментов
- •5.1 Область применения и источники ферментов
- •5.2 Выбор штамма и условий культивирования
- •5.3 Технология культивирования микроорганизмов – продуцентов ферментов и выделение ферментов
- •5.4 Инженерная энзимология и ее задачи
- •6 Методы генетического конструирования
- •In vitro
- •6.1 Биотехнология рекомбинантных днк
- •6.2 Конструирование рекомбинантных днк
- •6.3 Идентификация клеток-реципиентов, содержащих рекомбинантные гены
- •6.4 Экспрессия чужеродных генов
- •6.4.1 Клонирование в бактериях
- •6.4.2 Клонирование в дрожжах
- •6.4.3 Клонирование в клетках животных
- •6.5 Использование генетической инженерии в животноводстве
- •6.6 Генная инженерия растений
- •7 Основы клеточной инженерии растений
- •7.1 История предмета
- •7.2 Методы и условия культивирования изолированных тканей и клеток растений
- •7.3 Дедифференцировка на основе каллусогенеза
- •7.4 Типы культур клеток и тканей
- •7.5 Общая характеристика каллусных клеток
- •7.6 Морфогенез в каллусных тканях как проявление тотипотентности растительной клетки
- •7.6.1 Дифференцировка каллусных тканей
- •7.6.2 Гистогенез (образование тканей)
- •7.6.3 Органогенез
- •7.6.4 Соматический эмбриогенез
- •7.7 Изолированные протопласты, их получение, культивирование, применение
- •7.8 Клональное микроразмножение и оздоровление растений
- •8 Экологическая биотехнология
- •8.1 Получение биогаза
- •8.2 Производство биоэтанола
- •8.3 Очистка сточных вод
- •8.3.1 Методы очистки сточных вод
- •8.3.1.1 Механические методы
- •8.3.1.2 Химические методы
- •8.3.1.3 Физико-химические методы
- •8.3.1.4 Биологический метод
- •8.3.2 Отстой сточных вод и его использование
- •9 Контрольные вопросы
- •Список литературы
- •Содержание
- •Краткий курс биотехнологии
5.4 Инженерная энзимология и ее задачи
Развитие прикладной энзимологии долгое время сдерживалось дороговизной чистых ферментных препаратов, неустойчивостью их при хранении и невозможностью многократного использования. Принципиально новые перспективы открылись перед прикладной энзимологией в 60-е года ХХ века в результате появления на стыке химии и биологии новой отрасли – инженерной энзимологии. Ее задачи заключаются в развитии прогрессивных методов выделения ферментов, их стабилизации и иммобилизации, конструировании катализаторов с нужными свойствами и разработке научных основ их применения.
Важным этапом развития инженерной энзимологии стала разработка способов получения и использования иммобилизованных ферментов.
Иммобилизованными называют ферменты, искусственно связанные с нерастворимым носителем, но сохраняющие свои каталитические свойства.
Иммобилизованные ферменты имеют ряд преимуществ в сравнении со свободными молекулами:
1) они представляют собой гетерогенные катализаторы, которые легко отделяются от реактивной среды;
2) могут использоваться многократно;
3) обеспечивают непрерывность каталитического процесса.
Иммобилизация ведет к изменению свойств фермента: субстратной специфичности, устойчивости, зависимости активности от параметров среды. Иммобилизованные ферменты долговечнее и в тысячи раз стабильнее свободных энзимов. Это обеспечивает высокую экономическую эффективность и конкурентоспособность технологий, использующих иммобилизованные ферменты.
Все носители, используемые для иммобилизации ферментов, можно разделить на две группы: органические полимерные и неорганические. К носителям предъявляются следующие требования: они должны быть нерастворимы в реакционной среде, быть разно заряженными с ферментом, иметь высокую гидрофильность, механическую прочность, химическую и биологическую стойкость, не вызывать неспецифической адсорбции и сильных конформационных изменений белка, легко активироваться.
Способы иммобилизации делятся на две группы: химические (то есть с образованием ковалентной связи) и физические.
К физическому способу относят адсорбцию, когда фермент удерживается на носителе с помощью электростатических, водородных связей, а также в силу дисперсности взаимодействий. Этот способ осуществляется на нерастворимых носителях любой природы.
Другим физическим способом является механический способ, при котором ферменты включаются в гели, сшитые поперечными связями, заключаются в капсулы, волокна, мембраны и т.д.
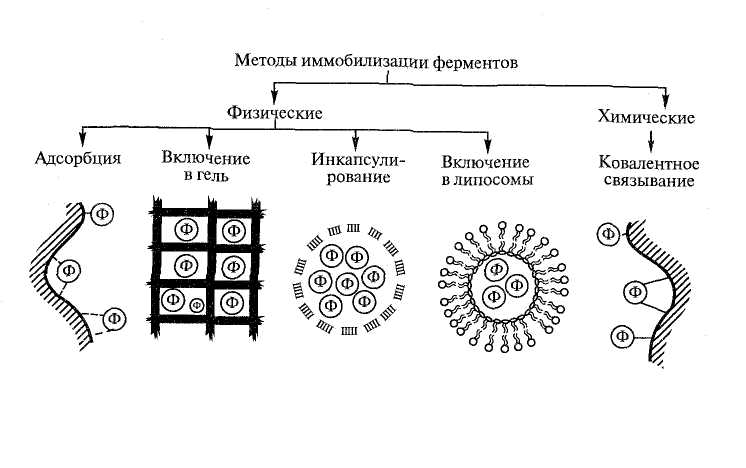 К
химическому способу относится ковалентное
связывание, которое осуществляется
путем ковалентного сшивания с полимерным
носителем и поперечного сшивания
ковалентными связями молекул белка без
носителя. Химический способ является
основным в получении иммобилизованных
ферментов. Такие препараты стабильны,
ферменты из них не вымываются, уменьшается
отрицательное влияние матрицы.
Существенным недостатком является
значительная инактивация ферментов.
К
химическому способу относится ковалентное
связывание, которое осуществляется
путем ковалентного сшивания с полимерным
носителем и поперечного сшивания
ковалентными связями молекул белка без
носителя. Химический способ является
основным в получении иммобилизованных
ферментов. Такие препараты стабильны,
ферменты из них не вымываются, уменьшается
отрицательное влияние матрицы.
Существенным недостатком является
значительная инактивация ферментов.
Рисунок 4 – Методы иммобилизации ферментов
Кроме иммобилизованных ферментов используют также иммобилизованные клетки.
При использовании иммобилизованных клеток отпадает необходимость выделения и очистки ферментных препаратов, применения кофакторов, создается возможность получения полиферментных систем.
В промышленных производствах используют покоящиеся клетки, так как:
1) многие хозяйственно-ценные продукты синтезируются в стационарной фазе;
2) растущие клетки нарушают структуру носителя;
3) образующиеся дочерние клетки, покидая носитель, загрязняют целевой продукт.
Для подавления роста иммобилизованных клеток используют дефицит фитогормонов, а рост клеток бактерий тормозят добавлением антибиотиков.
В настоящее время с использованием иммобилизованных ферментов и клеток проводятся следующие промышленные процессы:
1) получение глюкозофруктозных сиропов;
2) получение оптически активных L-аминокислот из их рацемических смесей;
3) синтез L-аспарагиновой кислоты (подсластитель и подкислитель) из фумарата аммония;
4) синтез L-аланина из L-аспарагиновой кислоты;
5) синтез L-яблочной кислоты из фумаровой кислоты;
6) получение безлактозного молока;
7) получение сахаров из молочной сыворотки;
8) получение 6-аминопенициллановой кислоты (аналог пенициллина).
