
Глава 2
О сновные
вопросы теории и практики взрыва
сновные
вопросы теории и практики взрыва
Существенным признаком взрыва является резкое увеличение давления, вызывающее возникновение в окружающей среде ударной волны.
2.1. Понятие о взрыве и взрывчатом веществе
Взрывом в физическом смысле называется чрезвычайно быстрое изменение вещества, сопровождающееся таким же быстрым освобождением его потенциальной энергии, производящей механическую работу, направленную на разрушение окружающей среды.
По своей природе взрывы подразделяются на физические, химические и ядерные.
При физических взрывах происходят только физические преобразования без изменения химического состава веществ (взрывы паровых котлов, баллонов со сжиженным газом и др.).
Химическим взрывом называют крайне быстрое самораспространяющееся химическое превращение вещества (системы веществ), протекающее с выделением большого количества теплоты и образованием газообразных продуктов. Из этого определения вытекают четыре основных условия, которым должна удовлетворять химическая реакция для того, чтобы она могла протекать в форме взрыва, а именно: экзотермичность, образование газов или паров, большая скорость, способность к самораспространению.
Роль газообразования для взрыва может быть показана на примере хорошо известной термитной реакции
2Al + Fe2O3 Al2O3 + 2Fe + 828,8 кДж,
которая протекает без химического взрыва, несмотря на то, что тепловой эффект реакции достаточен для нагревания конечных продуктов до температуры 3273 К.
К химическим взрывам относятся взрывы взрывчатых веществ, метана или других горючих газов, угольной или другой органической пыли.
При ядерных взрывах происходят цепные реакции деления ядер с образованием новых элементов.
При изучении дисциплины “Разрушение горных пород взрывом” будем рассматривать только химический взрыв взрывчатого вещества.
Взрывчатым называется вещество (система веществ), способное под влиянием определённого внешнего воздействия к крайне быстрому химическому превращению с выделением большого количества теплоты и образованием газов, способных производить механическую работу.
Для большинства взрывчатых веществ количество газов, выделяющихся при взрыве 1 кг ВВ, находится в пределах 0,3...1 м3, количество теплоты – 2,1…6,3 МДж (500...1500 ккал), а скорость взрыва колеблется от 1000 до 10000 м/с.
При взрыве в окружающей среде возникают ударная и звуковая волны.
2.2. Взрывные реакции. Кислородный баланс
Характерный признак взрывчатого вещество – наличие в составе химических элементов, необходимых для построения конечной системы. Например, при горении нефти, угля, других ископаемых реакция происходит за счёт кислорода воздуха, ибо горящее вещество содержит в себе преимущественно горючие элементы и, следовательно, горение их не может протекать без доступа воздуха. В то же время взрыв ВВ основан на окислении кислородом горючих веществ – углерода и водорода, которые входят в его состав, и лишь взрыв некоторых ВВ – на распаде молекулы на отдельные атомы.
Рассмотрим несколько примеров реакций химического превращения ВВ:
нитроглицерин
C3H5(ONO2)3 3CO2+2,5H2O+1,5N2+0,25O2 +1400 МДж (333200 ккал);
аммиачная селитра
NH4NO3 2H2O + N2 + 0,5O2 + 121 МДж (29000 ккал);
нитрогликоль
C2H4 (ONO2)2 2CO2 + H2O + N2 + 990 МДж (236500 ккал);
аммонит 6ЖВ, состоящий из смеси аммиачной селитры (79%) и тротила (21%)
C6H2(NO2)3CH3 +10,7NH4NO3 7CO2+23.9H2O+12,2N2+0,1O2+4520 МДж
(1078000 ккал);
тротил
C6H2(NO2)3CH33,5CO+2,5H2O+3,5C+1,5N2+922 МДж (219500 ккал);
азид свинца
PbN6 Pb + 3N2 + 448 МДж (107000 ккал).
Из рассмотренных реакций взрывчатого превращения видно, что при создании рецептуры и применении ВВ важно знать содержание кислорода в его составе, т. е. так называемый кислородный баланс системы.
Кислородным балансом называется выраженное в процентах избыточное, достаточное или недостаточное количество кислорода во взрывчатом веществе по сравнению с количеством, необходимым для полного окисления содержащихся в нём горючих элементов (углерода, водорода, алюминия и др.). Под полным окислением следует понимать окисление водорода в воду, углерода – в диоксид углерода (углекислый газ), алюминия – в оксид алюминия.
В зависимости от избытка или недостатка кислорода в ВВ различают нулевой, положительный и отрицательный кислородный баланс. Нулевой – это такой кислородный баланс, при котором количество кислорода в составе ВВ равно количеству, необходимому для полного окисления всех горючих элементов, входящих в ВВ. Если в составе ВВ имеется избыток кислорода, то кислородный баланс считается положительным, а если недостаток – отрицательным.
Кислородный баланс – это физико-химическая характеристика ВВ. Его можно качественно оценить по взрывной реакции, т. е. по составу газообразных продуктов взрыва, а именно: при нулевом - среди продуктов взрыва есть только Н2О, СО2, N2 (возможно и Al2O3), например, у нитрогликоля; при положительном, кроме того, содержится свободный кислород, например, в аммиачной селитре; при отрицательном – оксид углерода (угарный газ) и углерод, например, у тротила.
Точное численное значение кислородного баланса ВВ определяют по уравнению:
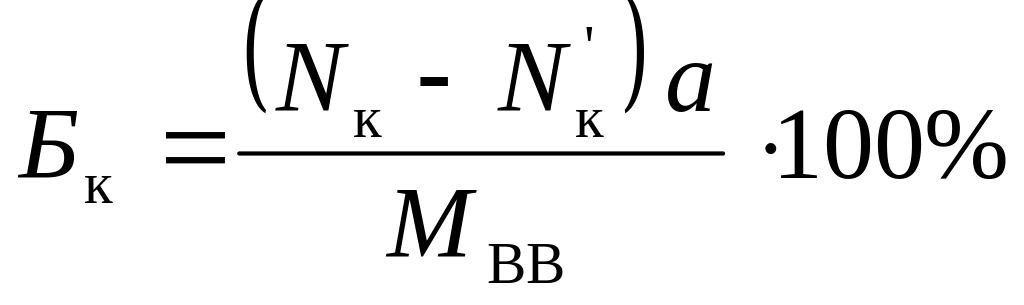 ,
(2.1)
,
(2.1)
где Nк – количество атомов кислорода в молекуле ВВ;
Nк' – количество атомов кислорода, необходимое для полного окисления горючих элементов (углерода, водорода, алюминия и др.);
а – молярная масса кислорода (а =16 кг/кмоль);
МВВ – молярная масса ВВ, кг/кмоль.
Если ВВ имеет элементарный состав в виде CaHbOcNdAle, то Nк=с;
Nк' = 2а + 0,5b + 1,5е,
где а, b, c, d, e – количество атомов химического элемента в составе ВВ.
Очевидно, что если Nк > Nк', то кислородный баланс положительный, если Nк< Nк' – отрицательный, а если Nк = Nк' – нулевой.
Взрывчатые вещества с нулевым кислородным балансом наиболее эффективны, поскольку при полном окислении горючих элементов выделяется максимальное количество теплоты, что обеспечивает максимальное выделение энергии в момент взрыва.
Пример 1. Определить кислородный баланс нитроглицерина C3H5(ONO2)3 и тротила C6H2(NO2)3CH3.
Молярная масса нироглицерина МВВ = 12·3 + 1·5 + 16·9 + 14·3 = 227 кг/кмоль.
Решение. Молекула нитроглицерина содержит Nк = 6 + 3 = 9, а тротила Nк = 2 · 3 = 6 атомов кислорода. Для полного окисления горючих компонентов нитроглицерина требуется Nк' = 2 · 3 + 0,5 · 5 = 8,5, а тротила
Nк' = 2 · 6 + 0,5 · 2 + 2 · 1 + 0,5 · 3 = 16,5 атомов кислорода.
Кислородный баланс нитроглицерина рассчитываем по формуле (2.1)
![]() .
.
Следовательно, кислородный баланс нитроглицерина положительный.
Моляоная масса тротила: МВВ = 12·7 + 1·5 + 14·3 + 16·6 = 227 кг/кмоль.
Кислородный баланс тротила
![]()
![]() .
.
Следовательно, кислородный баланс тротила отрицательный.
Пример 2. Определить кислородный баланс аммонита 6ЖВ, состоящего из 0,925 кмоля тротила и 9,88 кмолей аммиачной селитры. Его элементарный состав – C6,48 H44,13 O35,18 N22,52 .
Решение. Исходя из элементарного состава, определяем Nк, Nк' и МВВ:
Nк = 35,180; Nк' = 2 · 6,48 + 0,5 · 44,13 = 35,025.
Молярная масса смеси равна 1083 кг/кмоль.
Кислородный баланс рассчитываем по формуле (2.1)
![]() .
.
Следовательно, кислородный баланс аммонита 6ЖВ небольшой положительный.
Селективно-детонирующие взрывчатые вещества V…VII классов содержат не только классические горючие элементы (С, Н), но и целый ряд металлов, фосфор, которые в процессе взрывной реакции окисляются кислородом. Причем вначале хлор соединяется с металлами, затем окисляются остатки всех металлов, после этого окисляется водород до Н2О, и в заключение остаток кислорода соединяется с углеродом до СО и СО2. С учетом этого, параметр Nк' для таких ВВ определяется значительно сложнее, чем для ВВ II…IV классов.
В общем виде
![]() ,
,
где 0,5 – величина, обратная валентности кислорода;
ni – количество атомов i-элемента в составе ВВ;
ki – валентность i-элемента;
bi – безразмерный коэффициент, принимается равным +1 для химических элементов, вступающих в процессе взрывчатого разложения в реакцию с кислородом; равным 0 для химических элементов, не вступающих при взрыве в реакцию с кислородом, например, для кислорода, азота и др., равным –1 – для химических элементов, вступающих в реакцию с элементами первой из перечисленных групп, т.е. для которых b=1, например, для хлора.
Пример 3. Определить кислородный баланс для опытного образца У14П (V класс).
С5,198Н12,783О24,06Сl5,514Na5,67Са0,4582 5,514NaCl+0,078Na2O+1,4802СО+
+14,608Н2О+3,7178СО2+0,4582СаО+6,3915N2
Решение.

Кислородный баланс отрицательный.
