
Химическая кинетика
Контрольные вопросы
1. Дайте определение скорости химической реакции.
2. Дайте формулировку закона действия масс для гомогенной и гетерогенной реакции.
3. Дайте определение константы скорости химической реакции. От каких параметров она зависит?
4. Охарактеризуйте влияние температуры на скорость химической реакции (правило Вант-Гоффа).
5. Прокомментируйте уравнение Аррениуса. Дайте определение энергии активации.
6. Что такое катализатор? Каков механизм действия катализатора? Приведите примеры гомогенного и гетерогенного катализа.
7. Дайте определения обратимой химической реакции и химического равновесия.
8. Дайте вывод константы химического равновесия, от каких параметров она зависит?
9. Дайте формулировку принципа Ле-Шателье.
10. Приведите пример обратимой химической реакции, объясните, как интенсивность различных параметров может влиять на смещение равновесия реакции.
Примеры решения задач
Пример 1. Как изменится скорость химической реакции: СО + О2 СО2 , если концентрацию угарного газа повысить в 3 раза?
Дано: |
Решение: |
[CO]2 =3[CO]1 |
1.Составим уравнение реакции: |
Найти: 2/1 |
2СО + О2 = 2 СО2 |
2.Напишем выражение закона действия масс для этого процесса при исходных условиях:
1 = k[CO]2[O2]
3.Напишем выражение закона действия масс для этого процесса с учетом повышения концентрации СО в 3 раза. (Константа скорости реакции (k) не зависит от концентрации реагентов).
2 = k (3[CO])2[O2]
4.Составим отношение 2/1:
2/1= k (3[CO])2[O2]/ k[CO]2[O2]= 32/1 =9
Ответ: при возрастании концентрации СО в 3 раза скорость химической реакции увеличится в 9 раз.
Пример 2. Как изменится скорость химической реакции при снижении температуры процесса с 1030С до 1000С, если температурный коэффициент реакции равен 2?
Дано: |
Решение: |
t1=1030C |
t+10n/t = n |
t2=1000C |
n = (1030-1000):10 = 3 |
= 2 |
По условию задачи t1>t2, следовательно v1>v2 |
Найти: 1/2 |
1/2= n, n = 23 = 8 |
Ответ: скорость химической реакции уменьшится в 8 раз.
Пример 3. В направлении какого процесса сместится равновесие системы SO2+O2 SO3; Н0 при а) возрастании концентрации SO2; б) снижении температуры; в) повышении давления; г) внесении катализатора? Составьте выражение константы химического равновесия для этой системы.
Решение:
1)Составим термохимическое уравнение:
2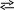 SO2
(г)+
O2(г)
2 SO3(г)
+ Q (ΔН<0, реакция экзотермическая)
SO2
(г)+
O2(г)
2 SO3(г)
+ Q (ΔН<0, реакция экзотермическая)
В соответствии с принципом Ле-Шателье:
а) равновесие смещается вправо, в сторону прямой реакции, понижающей концентрацию SO2;
б) равновесие смещается в сторону экзотермической реакции, т.е. вправо;
в) равновесие смещается в сторону снижения давления, т.е. вправо, т.к. меньшее число молекул газа оказывают меньшее давление;
г) равновесие не смещается, т.к. катализатор увеличивает скорость прямой и обратной реакции в одинаковое число раз.
2)Константа равновесия для реакции окисления оксида серы (IV): Kр = [SO3]2/[SO2]2[O2]
