
- •1.1. Диаграммы состояния однокомпонентных систем
- •2.2. Фазовые равновесия диаграмм двухкомпонентных систем
- •2.3.2. Система k2о – SiО2
- •2.4.2. Система FeO – SiO2
- •2.4.3. Система PbO – SiO2
- •3. Общие и реальные трехкомпонентнье диаграммы состояния
- •3.4. Трехкомпонентная система с двойным химическим соединением, плавящимся конгруентно
- •3.5. Трехкомпонентная система с двойным химическим соединением, плавящимся инконгруентно
- •3.6. Трехкомпонентная система с тройным химическим соединением, плавящимся инконгруентно
- •3.7. Система СаО – Аl2o3 – SiO2
- •3.8. Система MgO – Аl2о3 – SiО2
- •Приложения
- •Приложения
2.2. Фазовые равновесия диаграмм двухкомпонентных систем
Элементы диаграммы, изображаемые сплошными линиями на рисунке, делят поле диаграммы на области, в которых в равновесии находятся одна (расплав, твердый раствор) или две равновесные фазы. Правильное определения характера фазового равновесия в областях диаграммы существенно облегчает рассмотрение путей кристаллизации при охлаждении исходных расплавов системы, Следует напомнить читателю, что в этом пособии в дальнейшем будет рассматриваться охлаждение исходных составов и связанное с этим изменение фазового равновесия. При нагреве последовательность фазовых превращений будет обратной.
Рассмотрим подробней задачу определения областей фазовых равновесий. Для определения фаз, находящихся в равновесии, необходимо оценить, какие элементы диаграммы ограничивают рассматриваемую область слева и справа. Это могут быть:
линия ликвации: одна из равновесных фаз – расплав;
линии химических соединений – одна из равновесных фаз это данное химическое соединение;
температурные вертикали – одна из равновесных фаз – один из компонентов диаграммы в кристаллическом состоянии;
наклонные кривые солидуса – одна (или единственная) фаза – твердый раствор.
При этом анализе следует помнить о том, что кристаллические фазы могут находиться в. равновесии в различных полиморфных модификациях.
Задача № 26. Определить фазовое равновесие в областях диаграммы двухкомпонентной системы (прил.2, рис.1).
Задача № 27. Определить фазовое равновесие в областях диаграммы двухкомпонентной системы (прил.2, рис.2).
Задача № 28. Определить фазовое равновесие в областях диаграммы двухкомпонентной системы (прил.2, рис.З).
Задача № 29. Определить фазовое равновесие в областях диаграммы двухкомпонентной системы (прил.2, рис.4).
Задача № 30. Определить фазовое равновесие при температуре Т1 для исходного состава 1 (прил.2, рис. 1, 2).
Задача № 31.Определить фазовое равновесие при температуре Т1 для исходного состава 1 (прил.2, рис.3,4).
2.3. Силикаты щелочных металлов
2.3.1. Система Na2O – SiO2
Диаграмма Na2O – SiO2 (рис.5) имеет в своем составе следующие химические соединения.
Ортосиликат натрия 2Na2O – SiO2: Na2[SiO4]. Доля оксида натрия в составе соединения составляет 68,1 %.
Метасиликат натрия Na2O – SiO2: Na2[SiO4]. Доля оксида натрия в составе соединения составляет 50.8 %.
Дисиликат натрия Na2O – 2SiO2. Доля оксида натрия в составе соединения составляет 34,0 %.
Эвтектика с минимальной температурой плавления 793°С по мере увеличения доли кремнезема в исходном составе увеличивается.
Составы, содержащие от 20 до 50 % оксида натрия, полностыо переходят в расплав в интервале температур 790...1200 °С.
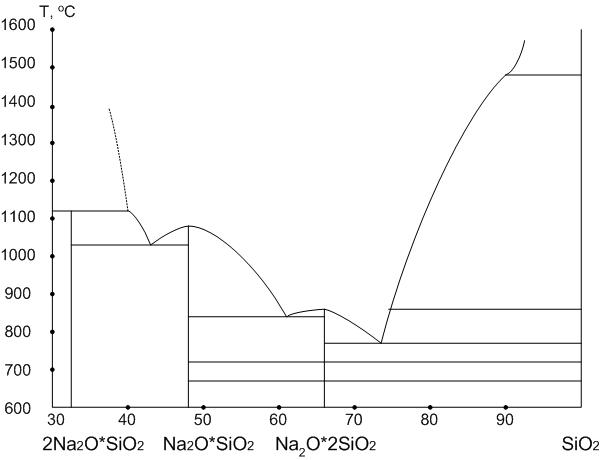
Рис. 5. Диаграмма Na2O – SiO2
Силикаты натрия растворимы в воде и используются для производства натриевого растворимого стекла состава Na2O*nSiO2: где n-силикатный модуль стекла, изменяющийся от единицы до 4.
Растворимость силикатов натрия увеличивается со снижением силикатного модуля.
Жидкое стекло получают растворением силикат – глыбы, как правило, при избыточном давлении в автоклаве. Жидкое стекло обладает вяжущими свойствами и используется при изготовлении бумажных, деревянных и силикатным материалов, конструкций и изделий, как вяжущее в кислотоупорных композициях, как средство для химического закрепления грунтов.
Задача № 32. Для системы Na2O – SiO2 определить максимальную температуру термообработки исходного сырья (сульфат натрия и кварцевый песок) для получения стекол с силикатным модулем 2,2.
Задача № 33. Для системы Na2O – SiO2 рассчитать состав шихты (исходное сырье карбонат натрия и кварцевый песок, содержащий 8 % органических примесей) для получения в системе при температуре 1000°С расплава, содержащего 56 % SiO2.
Задача № 34. Известно, что в системе Na2O – SiO2 при температуре 1020°С в равновесии с кристаллической фазой находится 40 % расплава. Определить все возможные для этих условий точки исходных составов и поясните, для какой из них растворимость силикат – глыбы будет выше.
Задача № 35. Рассматриваемый состав системы Na2O – SiO2, находящейся в равновесии характеризуется следующими термодинамическими параметрами: температура 950°С, количество расплава 30 %. Каким образом (не изменяя температуры) можно увеличить количество расплава до 50 %?
Задача № 36. Определить фазовый состав силиката (90 % SiO2 и 10 % Na2O) при температурах 1000 °С и 700°С.
