
- •1.1. Диаграммы состояния однокомпонентных систем
- •2.2. Фазовые равновесия диаграмм двухкомпонентных систем
- •2.3.2. Система k2о – SiО2
- •2.4.2. Система FeO – SiO2
- •2.4.3. Система PbO – SiO2
- •3. Общие и реальные трехкомпонентнье диаграммы состояния
- •3.4. Трехкомпонентная система с двойным химическим соединением, плавящимся конгруентно
- •3.5. Трехкомпонентная система с двойным химическим соединением, плавящимся инконгруентно
- •3.6. Трехкомпонентная система с тройным химическим соединением, плавящимся инконгруентно
- •3.7. Система СаО – Аl2o3 – SiO2
- •3.8. Система MgO – Аl2о3 – SiО2
- •Приложения
- •Приложения
УДК 666 ()
Горбунов С.П. Физическая химия силикатов: Учебное пособие для самостоятельной работы студентов.— Челябинск: Изд-во ЮУрГУ, 2006.— 39 с.
В учебном пособии изложены основы учения о фазовом равновесии одно-, двух- и трехкомпонентных систем. Рассматриваются диаграммы равновесия на примере решения практических задач определения параметров технологических процессов производства обжиговых строительных материалов.
Подробно рассматриваются приемы определения фазовых равновесий при стационарных термодинамических параметрах.
Предназначено для студентов, обучающихся по специальности 270601—"Производство строительных материалов, изделий и конструкций".
Илл.16, табл.2, список лит.— 4 назв.
Одобрено учебно-методической комиссией архитектурно-строительного факультета.
Рецензенты: Алабугин А.Н., Некрасов С.А.
ВВЕДЕНИЕ
Химия кремния и физическая химия силикатов является базовой для технологических дисциплин, охватывающей такие вопросы, как учение о фазовых равновесиях поликомпонентных систем, строении и свойств силикатных материалов при различных температурах, термодинамику силикатов, структурно-механические и реологические свойства силикатных суспензий и расплавов, процессы спекания керамических масс, взаимодействие силикатов в твердом состоянии.
Силикатная промышленность является одной из наиболее старых, изделия которых датируются вторым тысячелетием до нашей эры. Роман – цемент использовался в Римской империи в период ее расцвета для возведения грандиозных сооружений.
Необходимость научного обоснования процессов, происходящих с исходным сырьем в процессе обжига, направленного формирования структуры строительных силикатных материалов, проектирования новых материалов и эффективных технологий их изготовления, в том числе при использовании техногенных отходов промышленности – все это явилось причиной выделения физической химии силикатов в самостоятельную дисциплину.
В настоящее время использование современных научных знаний позволяет получать высококачественные материалы со специальными свойствами, используемыми как в строительстве, так и в других отраслях, промышленности: металлокерамика, в том числе обладающая эффектом сверхпроводимости при температурах до 60 °К, специальное стекло и ситаллы, оптическое волокно и др.
Предлагаемое пособие имеет целью развития у студента интереса к изучаемой дисциплине, практической отработке вопросов теоретического курса по решению задач, связанных с фазовым равновесием одно – , двух – и трехкомпонентных систем в порядке возрастания их сложности.
Самостоятельная проработка предлагаемых задач позволит студенту научно обоснованно подходить к выбору параметров технологических процессов производства силикатных материалов, изучаемых на старших курсах.
1.ОБЩИЕ СВЕДЕНИЯ О ДИАГРАММАХ СОСТОЯНИЯ
Диаграмма состояния представляет собой графическое изображение возможных равновесных состояний системы при различных условиях.
В основу построения диаграмм состояния положены принципы, сформулированные Н.С.Курнаковым.
1. Принцип непрерывности: при неизменном фазовом состоянии системы непрерывное изменение состава и внешних условий приводит к непрерывному изменению свойств отдельных фаз к системы в целом. Скачкообразное изменение свойств фаз и системы в целом является индикатором фазовых превращений.
2. Принцип соответствия: каждому равновесному состоянию системы соответствуют определенные геометрические образы на диаграмме.
Изменения, происходящие в системе, следует рассматривать как цепь последовательных равновесных состояний при бесконечно малом изменении термодинамических параметров (в реальных силикатных системах такими параметрами чаще всего выступают температура и концентрация компонентов системы).
Диаграммы состояния являются тем инструментом исследования для ученого и технолога, с помощью которого можно решать комплекс задач практического и теоретического характера.
Например, читателю хорошо известно из курса "Строительные, материалы", что свойства керамического черепка зависят от степени спекания сырца, то есть от доли расплава в объеме изделия. Назначение температуры обжига керамических изделий в зависимости от состава сырья для их производства – типичная технологическая задача, легко решаемая по соответствующим диаграммам.
Какие же задачи можно решать с помощью диаграмм? К часто встречающимся на практике можно отнести следующие:
определение температуры начала и завершения в рассматриваемой системе при любом соотношении компонентов различных процессов: плавления, кристаллизации, изменения составов расплава и твердых растворов и т.п.;
определение минералогического и химического составов равновесных фаз;
расчет количественного соотношения равновесных фаз;
определение степени достижения равновесного состояния системы.
Широкие возможности, которые дают диаграммы состояния как инструмента исследования, лежат в основе объяснения и усовершенствования процессов, протекающих при синтезе различных минералов и материалов. Диаграммы помогают устанавливать и объяснять влияние фазового состава конечного продукта технологического процесса на его свойства, что позволяет решать задачи оптимизационного характера при производстве обжиговых строительных материалов.
В изучаемом Вами пособии будут рассматриваться, в основном, диаграммы силикатных систем, то есть систем, одним из компонентов которых является кремнезем – SiO2. При этом исходные сырьевые смеси в процессе переработки подвергаются действие высоких температур.
Общие положения диаграмм состояния применимы и для анализа, например, продуктов гидратационных процессов минералов портландцементного клинкера и иных гидравлически активных веществ.
Итак, приступим к рассмотрению диаграмм состояния общего вида. Естественно, что наиболее простыми диаграммами являются те, количество компонентов которых минимально, то есть диаграммы состояния однокомпонентных систем. Если вспомнить правило Гиббса, то для однокомпонентных неконденсированных систем, находящихся в равновесии, максимальное количество степеней свободы
Fmax=K – Pmin + 2
Таким образом, существует всего два независимых термодинамических параметра, изменения значений которых не приведет к изменению количества равновесных фаз. Для однокомпонентной системы такими параметрами являются температура системы и давление паров над поверхностью жидкой фазы.
Именно по этой причине диаграммы однокомпонентных систем называют Т (температура) – Р(давление) диаграммами.
1.1. Диаграммы состояния однокомпонентных систем
Т – Р диаграммы однокомпонентной системы (рис.1) указывают области существования различных фаз: парообразной, жидкой и твердой или же двух твердых фаз (рис.2 и рис.3) при наличии полиморфизма в зависимости от двух внешних параметров: температуры и давления.
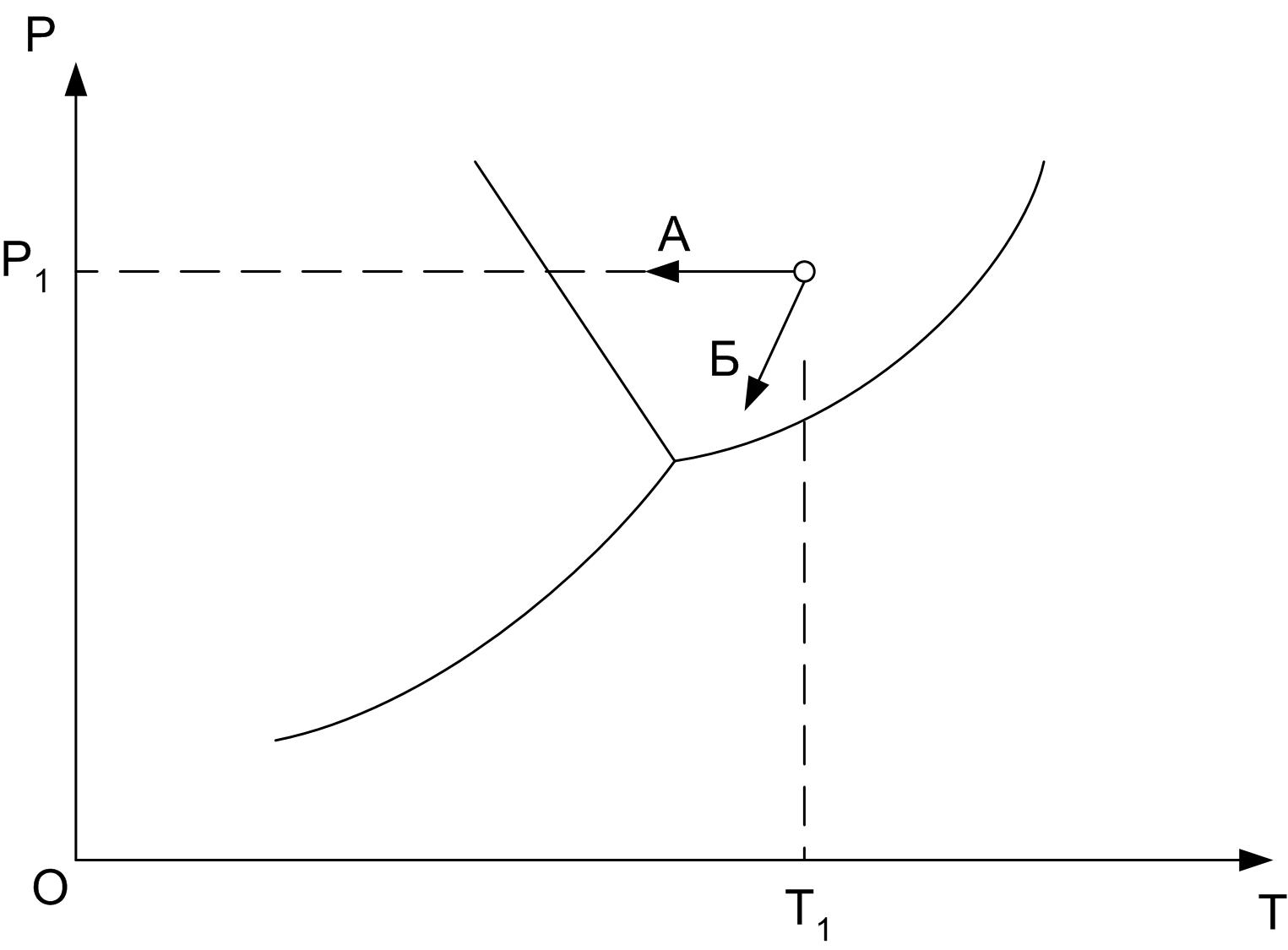
Рис.1 Т – Р диаграмма воды (параметры условно не показаны)
Задача №1. Объясните, используя правило Гиббса, почему на кривой охлаждения (изменения температуры от времени охлаждения) воды при температуре 0° С появляется горизонтальная площадка?
Задача № 2. Почему при автоклавной обработке силикатного бетона нельзя произвольно изменять в автоклаве температуру и давление паров воды?
Задача № 3. Известно, что при атмосферном давлении температура кипения воды составляет 100 °С. Если осуществлять процесс вакуумирования строительных материалов с целью удаления из них воздуха (например, перед пропиткой их полимерными материалами), то одновременно происходит их интенсивная сушка. В чем причина этого?
Задача № 4. Прокомментируйте процесс охлаждения воды с начальными параметрами Т1 (рис.1) при постоянном давлении (направление Б) и постоянной скорости снижения давления (направление А).
Рассмотрим теперь диаграмму состояния однокомпонентной системы с несколькими твердыми модификациями на примере диаграммы серы. В производстве строительных материалов сера используется для изготовления серных бетонов и модифицированных асфальтобетонов. Пропитка расплавом серы бетона с последующей кристаллизацией расплава в его порах и капиллярах увеличивает прочность композиционного материала, снижает его проницаемость и улучшает параметры долговечности композиционного материала..
Сера имеет две полиморфные кристаллические модификации: ромбическую и моноклинную. Диаграмма состояния имеет вид, показанный на рис.2.

Рис.2 Т – Р диаграмма серы
Область выше DABE - однофазная область равновесного существования ромбической кристаллической серы; ABC – однофазная область равновесного существования моноклинной кристаллической серы; ЕВСК – однофазная область равновесного существования расплава серы; DАСК – однофазная область равновесного существования парообразной серы.
Задача № 5. Дайте характеристику фазового равновесия в системе для всех сплошных линий на диаграмме и ее тройных точек.
Тройная точка 0 образуется при пересечении продолжения линий СК, DA и BE. Эта точка соответствует метастабилъному плавлению ромбической серы.
Линия СО соответствует давлению пара над переохлажденной жидкой серы; АО – давлению пара над перегретой ромбической серой; ВО – метастабильному равновесию между перегретой ромбической (относительно моноклинной) серой и переохлажденной жидкой серой.
Таким образом точка О соответствует метастабильному равновесному состоянию трех фаз: сера ромбическая – жидкость – пар. Это состояние неустойчиво, так как при данных давлении и температуре устойчивая является моноклинная сера, давление пара над которой меньше. При возможности образования нескольких твердых модификаций в однокомпонентных системах возможны два взаимных перехода между ними:
взаимные превращения модификаций, которые могут протекать самопроизвольно в зависимости от условий в прямом и обратном направлениях, называются энантиотропными превращениями;
превращения модификаций, которые могут протекать только в одном направлении, называются монотропными.
Задача № 6. При каких условиях для диаграммы серы возможно одновременное существование всех четырех фаз? Какой элемент диаграммы соответствует этому условию?
Задача № 7. Прокомментируйте изменения фазового состава при охлаждении исходного состава А (рис.2) в условиях постоянного давления.
Задача № 8. Опишите изменения фазовых равновесий в системе серы, если термодинамические параметры системы изменяются следующим образом: исходный состав Б ( Т3Р3) при быстром охлаждении перемещается в точку с параметрами (T2P2), затем в условиях медленного охлаждения – в точку (T1P1).
Задача № 9. Как поведет себя система при быстром нагреве серы с исходными параметрами T1P1 до температуры T3?
Задача № 10. Анализируя только диаграмму состояния, можете ли Вы сказать, плотность какой серы, ромбической или моноклинной, будет больше?
Рассмотрев практические диаграммы однокомпонентных систем, решим ряд задач для диаграммы однокомпонентной системы общего вида (рис.3).
Задача № 11. Рассмотрите последовательность фазовых превращений, происходящих при переохлаждении расплава исходного состава М с параметрами Т1 Р1 до температуры Т2.

Рис.3 Диаграмма состояния однокомпонентной системы с энантиотропными полиморфными превращениями
Задача № 12. Рассмотрите последовательность фазовых превращений, происходящих при переохлаждении расплава исходного состава М с параметрами Т1 Р1 до температуры Т3
Задача № 13. Рассмотрите последовательность фазовых превращений, происходящих при переохлаждении расплава исходного состава М с параметрами Т1 Р1 до температуры Т4
Задача № 14. Покажите, при каких условиях низкотемпературная модификация кристаллической фазы (точка М с параметрами T4P4) может перейти в высокотемпературную модификацию при постоянной температуре.
Диаграмма SiO2 обладает сложным полиморфизмом. В данном пособии мы не будем подробно рассматривать схему фазовых переходов. Для повторения этого вопроса читатель может обратиться, например, к тексту пособий [1, 2]. Предлагается, работая с диаграммой кремнезема по Феннеру, решить ряд задач.
Задача № 15. Определить и обосновать последовательность фазовых превращений, происходящих с кремнеземом при медленном нагреве до температуры 1400°С и последующим быстром охлаждении до температуры 80 °С.
Задача № 16. Объясните, как будут соотноситься друг с другом температуры плавления главных форм кремнезема.
Задача № 17. Опишите влияние минерализаторов на скорость и температуру фазовых превращений модификаций кремнезема.
Для практической оценки параметров технологических процессов обжига при производстве, например, керамических огнеупоров, служит скорость превращений полиморфных модификаций, в частности превращений α – кварца (плотность 2,65 г/см3) в менее плотные модификации (плотность α – тридимита 2,32 г/см3, α – кристаболита 2.23 г/см3, расплава кварца – 2,21 г/см3).
Например, режим обжига динаса подбирается таким образом, чтобы наряду с ускорением термообработки предотвратить разрыхление и растрескивание изделий.
Скорость полиморфного превращения кварца оценивается константой скорости
Х
К=-----------------, (1)
M(m – X)*H
где m-исходное количество кварца, %, X-количество превращенного за время Н кварца, %.
Константу скорости можно приближенно вычислить по формуле (А.И.Августинник, О.К.Курдеванидзе)
A B*104
-------- = ------------, (2)
D0,064 T
где D – диаметр зарна, мм; T – температура, градусы Кельвина.
Значения коэффициентов а и b в уравнении (2) зависят от степени чистоты кварца (табл.1).
Рассчитав константу скорости по (2) и подставив значение в (1) можно определить время в часах, необходимое для заданной степени превращения кварца.
Задача № 18. Проведите анализ времени, необходимого для 50 % превращения зерен кварца диаметром 0.1 мм при температурах 1200 °С и 1400 °С. Сделайте вывод о влиянии температуры на протекание процесса превращения. Определите, будет ли влияние температуры носить линейный характер?
Задача № 19. Дополнительно к условию задачи № 13 определите влияние минерализатора на протекание реакции.
Задача № 20. Определите характер зависимости влияния размера зерен кварца на время, необходимое для превращения исходного минерала на 50 %.
Задача № 21. Дополнительно к условию задачи № 20 определите влияние минерализатора на протекание реакции.
Таблица 1
-
Кварцсодержащая порода
Значения коэффициентов
А
В
Кварц
10.7
3.16
Кварц с примесью 2 % СаО
11.3
3.06
Халцедон
11.6
3.02
Решение задач № 18-21 с учетом подробного обобщения влияния различных факторов на протекание исследуемого процесса удобно проводить с использованием навыков программирования, а также метода математического планирования эксперимента, что позволит построить наглядную картину процесса, например, зависимость:
время протекания реакции = f(D,'T, степень превращения).
2. ДИАГРАММЫ РАВНОВЕСИЯ ДВУХКОМПОНЕНТНЫХ СИСТЕМ
2.1. Построение диаграмм равновесия двухкомпонентных систем
В специальной литературе [1] подробно рассмотрены статический и динамический методы построения диаграмм равновесия. Целью данного раздела является практический анализ кривых охлаждения бинарных систем и построения на его основе диаграмм равновесия. Следует напомнить читателю некоторые основы анализа кривых охлаждения.
Основными элементами кривых охлаждения являются точка перегиба и горизонтальная площадка.
Точка перегиба кривой охлаждения при постоянной скорости охлаждения появляется в том случае, когда изменяется скорость охлаждения. А это, в свою очередь, связано с началом протекания в системе процессов, сопровождающихся тепловыми эффектами, имеющих, как правило, экзотермический характер при охлаждении системы. Дополнительное выделение тепла снижает скорость охлаждения системы и угол наклона (между кривой охлаждения и абсциссой графика) увеличивается.
Для бинарных систем изменение угла наклона кривой охлаждения связано прежде всего с началом кристаллизации одной кристаллической фазы: компонента или химического соединения.
Горизонтальные площадки на кривых охлаждения бинарных систем появляются в случае достижения системой нонвариантного состояния: одновременного существования в системе трех фаз. Вспомним, какие процессы в бинарных системах приводят к этому состоянию. Это частные случаи однокомпонентных систем в составе бинарных:
кристаллизация химического соединения, плавящегося конгруентно, когда исходный состав системы совпадает с составом химического соединения;
кристаллизация расплава одного из компонентов, когда система содержит 100 %, одного из них.
Для бинарных составов:
кристаллизация расплава эвтектического состава;
образование химического соединения, плавящегося инконгруентно, при температуре точки перитектики;
ликвация в системе при температуре начала (окончания) процесса расслоения жидкости;
полиморфные превращения кристаллических фаз;
образование (разложение) химического соединения, разлагающегося в твердой фазе.
При постоянной скорости охлаждения длина горизонтальной площадки на кривой охлаждения зависит от количества фазы на момент начала процесса, определяющего этот процесс. Поясним это положение на примере. Если площадка на кривой охлаждения является следствием кристаллизации расплава эвтектического состава, то для исходного состава, совпадающего с эвтектическим, протяженность горизонтальной площадки будет максимальной. На этом простом правиле основан геометрический метод поиска точного местоположения некоторых элементов диаграмм, так называемый метод треугольника Таммана. На рис. 4 показаны примеры построения треугольников для перечисленных выше ситуаций.

Рис.4 . Элементы построения диаграмм двухкомпонентных систем: а – кристаллизация расплава эвтектического состава; б – образование химического соединения, плавящегося инконгруентно; в – ликвация; г – полиморфные превращения кристаллических фаз; д – образование химического соединения, разлагающегося в твердой фазе.
Задача № 22. Объясните принцип построения треугольников Таммана на рис 4б, в.
Задача № 23. На основе анализа кривых охлаждения бинарных систем постройте диаграмму состояния (прил.1, рис.1).
Задача № 24. На основе анализа кривых охлаждения бинарных систем постройте диаграмму состояния (прил.1, рис.2).
Задача № 25. На основе анализа кривых охлаждения бинарных систем постройте диаграмму состояния (прил.1, рис.3).
При решении задач 23-25 обратите внимание на то, что для бинарных систем максимальная величина горизонтальной площадки составляет 15 мм.
