
- •Часть V. Поверхностные явления.
- •1.1.2. Индукционное взаимодействие.
- •1.1.3. Ориентационное взаимодействие.
- •1.3. Водородная связь.
- •2. Поверхностное натяжение
- •3. Поверхностное натяжение растворов. Пав и пиав.
- •1.2. Теория мономолекулярной адсорбции Лэнгмюра.
- •1.3. Теория полимолекулярной адсорбции.
- •1.4. Адсорбция на пористых адсорбентах.
- •1.5. Адсорбция из растворов.
- •Моль/м2 ,
- •1.3.2. Метод счета капель.
- •1.3.3. Метод максимального давления в пузырьке (метод Ребиндера).
- •1.3.4. Метод отрыва диска или кольца.
1.2. Теория мономолекулярной адсорбции Лэнгмюра.
Согласно этой теории поверхность адсорбента является совершенно однородной. По ней равномерно распределены центры адсорбции, способные образовывать ван-дер-ваальсовы связи с молекулами адсорбата. Один центр адсорбции образует связь только с одной молекулой адсорбата, поэтому при максимальной адсорбции на поверхности адсорбента образуется мономолекулярный слой адсорбата.
Скорость
адсорбции пропорциональна величине
свободной, незанятой адсорбатом
поверхности адсорбента и числу соударений
молекул газа об эту поверхность в единицу
времени. Если долю поверхности, занятой
адсорбатом обозначить как
![]() ,
доля свободной поверхности будет
составлять (
,
доля свободной поверхности будет
составлять (![]() ).
Число соударений пропорционально
давлению газа P,
поэтому скорость адсорбции составляет:
).
Число соударений пропорционально
давлению газа P,
поэтому скорость адсорбции составляет:
![]()
Скорость
десорбции при данной температуре
пропорциональна числу молекул адсорбата
на единице поверхности адсорбента, то
есть величине
![]() :
:
![]()
При
равновесии скорости адсорбции и десорбции
газа равны друг другу, то есть
![]() и, следовательно,
и, следовательно,
![]() ;
;
![]() ;
;
![]() ,
,
откуда
![]() ,
,
где
![]() – константа равновесия адсорбции.
– константа равновесия адсорбции.
Э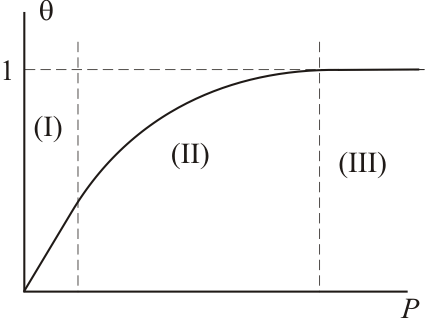 то
уравнение называется адсорбционным
уравнением Лэнгмюра. Из него следует,
что степень адсорбции, выражаемая
величиной доли поверхности, занятой
адсорбатом, в общем случае является
нелинейной функцией давления. При малых
давлениях газа, когда
то
уравнение называется адсорбционным
уравнением Лэнгмюра. Из него следует,
что степень адсорбции, выражаемая
величиной доли поверхности, занятой
адсорбатом, в общем случае является
нелинейной функцией давления. При малых
давлениях газа, когда
![]() степень
адсорбции линейно растет с давлением:
степень
адсорбции линейно растет с давлением:
![]() (область (I)
графика). При достаточно высоких
давлениях, когда
(область (I)
графика). При достаточно высоких
давлениях, когда
![]() ,
вся поверхность адсорбента оказывается
занята адсорбатом (область (III)
графика) и для нее
,
вся поверхность адсорбента оказывается
занята адсорбатом (область (III)
графика) и для нее
![]() . Средняя нелинейная часть графика
описывается полным уравнением Лэнгмюра.
. Средняя нелинейная часть графика
описывается полным уравнением Лэнгмюра.
Уравнение
Лэнгмюра показывает, что при данном
давлении степень адсорбции
тем больше, чем больше величина константы
равновесия адсорбции
![]() .
В свою очередь, константа равновесия
адсорбции зависит от изменения энергии
Гиббса в процессе адсорбции и от
температуры:
.
В свою очередь, константа равновесия
адсорбции зависит от изменения энергии
Гиббса в процессе адсорбции и от
температуры:
![]()
Поскольку
адсорбция является самопроизвольным
процессом, при котором энергия Гиббса
системы уменьшается, то
![]() .
Уменьшается также и энтропия системы
(при образовании связи адсорбент-адсорбат
возрастает упорядоченность системы и
поэтому
.
Уменьшается также и энтропия системы
(при образовании связи адсорбент-адсорбат
возрастает упорядоченность системы и
поэтому![]() ).
Из соотношения
).
Из соотношения
![]() следует, что
следует, что
![]() ,
то есть теплота при адсорбции всегда
выделяется. Чем больше теплоты выделяется
при адсорбции одного моля адсорбата,
тем отрицательнее оказывается величина
,
то есть теплота при адсорбции всегда
выделяется. Чем больше теплоты выделяется
при адсорбции одного моля адсорбата,
тем отрицательнее оказывается величина
![]() и тем больше величина константы равновесия
адсорбции
.
В соответствии с уравнением Лэнгмюра
большей оказывается и степень адсорбции.
и тем больше величина константы равновесия
адсорбции
.
В соответствии с уравнением Лэнгмюра
большей оказывается и степень адсорбции.
Чем выше температура, тем выше энергия теплового движения молекул адсорбата на поверхности адсорбента, тем чаще они отрываются от поверхности, тем, соответственно, меньше константа равновесия адсорбции, тем меньше и степень адсорбции.
При адсорбции смеси газов происходит вытеснение из адсорбционного слоя газа с меньшей теплотой адсорбции и замена его газом, теплота адсорбции которого выше.
1.3. Теория полимолекулярной адсорбции.
Мономолекулярная адсорбция газов и паров на поверхности адсорбента встречается достаточно редко. Значительно чаще изотермы адсорбции имеют более сложный вид, чем следует из теории Лэнгмюра. Для объяснения такой зависимости степени адсорбции от давления адсорбата была предложена теория полимолекулярной адсорбции, согласно которой центры адсорбции способны образовывать связи не только с одной молекулой адсорбата с образованием единичного комплекса, но и с двумя, тремя и более молекулами. При этом образуются соответственно двойные, тройные и более комплексы. Наибольшая теплота выделяется при образовании связи с первой молекулой адсорбата, значительно меньше – при образовании связи со второй, еще меньше – с третьей и т.д. Соответственно, наибольшей оказывается константа равновесия адсорбции первой молекулы, значительно меньше – второй и т.д. молекулы адсорбата. Пока поверхность адсорбента занята лишь в небольшой степени, преобладают единичные комплексы. После заполнения поверхности мономолекулярным слоем начинают образовываться двойные, тройные и т.д. комплексы с образованием второго, третьего и т.д. слоев адсорбата вплоть до конденсации жидкой пленки, что происходит при давлении насыщенного пара (P=Pнас.).
