
- •Часть V. Поверхностные явления.
- •1.1.2. Индукционное взаимодействие.
- •1.1.3. Ориентационное взаимодействие.
- •1.3. Водородная связь.
- •2. Поверхностное натяжение
- •3. Поверхностное натяжение растворов. Пав и пиав.
- •1.2. Теория мономолекулярной адсорбции Лэнгмюра.
- •1.3. Теория полимолекулярной адсорбции.
- •1.4. Адсорбция на пористых адсорбентах.
- •1.5. Адсорбция из растворов.
- •Моль/м2 ,
- •1.3.2. Метод счета капель.
- •1.3.3. Метод максимального давления в пузырьке (метод Ребиндера).
- •1.3.4. Метод отрыва диска или кольца.
3. Поверхностное натяжение растворов. Пав и пиав.
Поверхностное натяжение на границе раздела "водный раствор – газ" зависит от вида и концентрации растворенного в воде вещества. По влиянию на величину поверхностного натяжения такие вещества делятся на поверхностно-активные (ПАВ) и поверхностно-инактивные вещества (ПИАВ). ПАВ уменьшают поверхностное натяжение вследствие того, что, будучи менее полярными чем молекулы воды, взаимодействуют между собой и с молекулами воды с энергией меньшей, чем молекулы воды между собой:
![]() .
.
По этой причине на поверхностные молекулы ПАВ действует значительно меньшая втягивающая сила чем на молекулы воды. По этой причине малополярные молекулы ПАВ имеют меньшую избыточную энергию чем высокополярные молекулы воды. Находясь в поверхностном слое, молекулы ПАВ уменьшают суммарную избыточную энергию поверхностных молекул, то есть поверхностное натяжение.
Поверхностно-активными являются любые малополярные органические вещества, имеющие в своем составе неполярный алифатический, перфторалифатический или жирноароматический радикал:
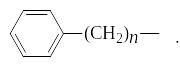
СН3–(СН2)n–СН2– CF3–(CF2)m–CF2– или
Кроме него в состав молекулы обязательно должна входить и какая либо полярная группа, обеспечивающая ПАВ некоторую растворимость в воде:
![]() и т.д.
и т.д.
Таким образом, любая молекула ПАВ схематично может быть представлена как:
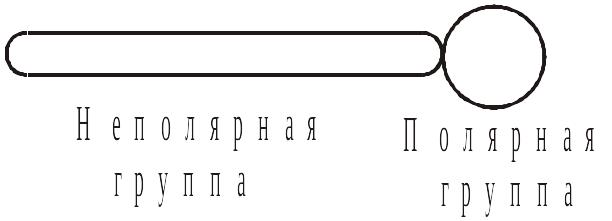
Наибольшее распространение получили так называемые ионогенные ПАВ. При их диссоциации в воде образуются поверхностно-активные ионы. В качестве примера можно привести соли жирных кислот, входящие в состав хозяйственного мыла или сульфокислот, составляющих основу стиральных порошков. Такие ПАВ называются анионоактивными, например:
![]()
Примером катионоактивных ПАВ могут служить четвертичные соли аминов, дающие при диссоциации поверхностно-активные катионы, например:
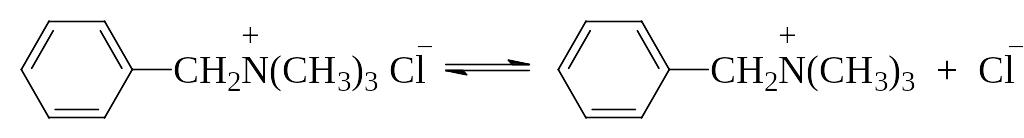
Неионогенными ПАВ являются высшие алифатические спирты, амины и т.д. , например бутиловый спирт CH3CH2CH2CH2OH , амиловый спирт CH3CH2CH2CH2CH2OH .
Мерой влияния ПАВ на поверхностное натяжение раствора является величина его поверхностной активности, показывающая степень уменьшения поверхностного натяжения раствора с ростом его концентрации. В честь Гиббса поверхностная активность обозначается буквой G , измеряется в Дж·м/моль и равна производной поверхностного натяжения по концентрации ПАВ, взятой с обратным знаком:
G
=
–![]() .
.
Для ПАВ эта величина всегда положительна.
Согласно правилу Траубе абсолютная величина поверхностной активности ПАВ растет приблизительно в 3.2 раза с увеличением длины цепочки алифатического радикала в его молекуле на одну метиленовую группу. Это правило соблюдается, естественно, лишь для ПАВ, принадлежащих к одному гомологическому ряду. Так, небольшие добавки бутилового спирта CH3(CH2)3OH понижают поверхностное натяжение воды примерно в 3 раза в меньшей степени, чем такие же добавки амилового спирта, то есть CH3(CH2)4OH.
Поверхностно-инактивными веществами являются такие вещества, молекулы которых взаимодействуют между собой и с молекулами воды с большей энергией чем молекулы воды между собой:
![]()
Такие молекулы втягиваются с поверхности раздела вглубь фазы с силой большей чем молекулы воды, поэтому имеют большую, по сравнению с молекулами воды, избыточную энергию. Попадая в поверхностный слой, молекулы ПИАВ увеличивают суммарную избыточную энергию поверхностных молекул. Примерами ПИАВ могут служить любые электролиты, диссоциирующие с образованием гидратированных ионов, например:
![]()
Энергия ион-дипольного взаимодействия ионов с молекулами воды и, тем более, межионного притяжения противоположно заряженных ионов, значительно превышает энергию взаимодействия молекул воды.
РАБОТА № 7
АДСОРБЦИЯ НА ТВЕРДЫХ ПОВЕРХНОСТЯХ, НАХОЖДЕНИЕ КОНСТАНТ УРАВНЕНИЯ ФРЕЙНДЛИХА ПРИ АДСОРБЦИИ ИЗ РАСТВОРОВ.
Цель работы: построение зависимости степени адсорбции карбоновой кислоты из водного раствора на активированном угле от равновесной ее концентрации, вычисление значений коэффициентов уравнения Фрейндлиха.
1. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
1.1. Адсорбция газов и паров на твердых поверхностях.
Общая энергия системы из твердой, газообразной фазы и поверхности раздела между ними при постоянной температуре и давлении определяется суммой энергий Гиббса фаз и избыточной энергии Гиббса поверхности раздела:
![]() .
.
При
неизменных
![]() и
и
![]() изменение энергии Гиббса системы
определяется изменением либо поверхностного
натяжения, либо площади поверхности
раздела:
изменение энергии Гиббса системы
определяется изменением либо поверхностного
натяжения, либо площади поверхности
раздела:
![]() .
.
Самопроизвольными
являются любые процессы, приводящие к
уменьшению энергии системы (![]() ).
Площадь поверхности раздела "твердое
тело – газ" есть величина постоянная
(S
= const,
dS
=
0) поэтому
).
Площадь поверхности раздела "твердое
тело – газ" есть величина постоянная
(S
= const,
dS
=
0) поэтому
![]() ,
а значит самопроизвольными в этом случае
являются процессы, сопровождающиеся
уменьшением поверхностного натяжения
(
,
а значит самопроизвольными в этом случае
являются процессы, сопровождающиеся
уменьшением поверхностного натяжения
(![]() ).
).
Поверхностное
натяжение на границе раздела "твердое
тело – газ" определяется различием
в энергии взаимодействия поверхностных
молекул твердого вещества с молекулами
своей фазы (![]() )
и с молекулами газа (
)
и с молекулами газа (![]() ).
Это различие тем меньше, чем выше величина
,
определяемая расстоянием между
поверхностью раздела и молекулами газа
(
).
Это различие тем меньше, чем выше величина
,
определяемая расстоянием между
поверхностью раздела и молекулами газа
(![]() ).
Поскольку при сгущении газа на поверхности
раздела это расстояние уменьшается,
величина
растет, а поверхностное натяжение
уменьшается. Соответственно уменьшается
и общая энергия системы. По этой причине
такой процесс протекает самопроизвольно.
).
Поскольку при сгущении газа на поверхности
раздела это расстояние уменьшается,
величина
растет, а поверхностное натяжение
уменьшается. Соответственно уменьшается
и общая энергия системы. По этой причине
такой процесс протекает самопроизвольно.
Самопроизвольное сгущение газа или пара на поверхности твердого вещества, называется адсорбцией. Твердое тело, на котором адсорбируется газ, называется адсорбентом, а адсорбирующееся вещество – адсорбатом. Если взаимодействие молекул газа с молекулами твердого вещества ограничивается физическим, или ван-дер-ваальсовым взаимодействием (см. теоретическое введение), адсорбция называется физической. Если же взаимодействие сопровождается образованием поверхностных химических соединений, адсорбция называется химической, или хемосорбцией.
Энергия взаимодействия молекул адсорбента и адсорбата при физической адсорбции составляет единицы и очень редко, при образовании водородных связей – десятки кДж/моль. При химической адсорбции эта энергия равна энергии обычных химических связей и составляет сотни кДж/моль. Поскольку молекулы адсорбата участвуют в тепловом движении, энергия которого при нормальной температуре составляет около 4 кДж/моль, часть молекул газа, связанных с поверхностью адсорбента ван-дер-ваальсовыми силами, отрывается от нее и переходит в объем газовой фазы. Этот процесс называется десорбцией. При данных условиях между процессом адсорбции и десорбции устанавливается равновесие, характеризующееся определенной величиной равновесной степени адсорбции.
Энергии теплового движения совершенно недостаточно для разрыва химических связей, поэтому десорбция протекает лишь при физической адсорбции. Химическая адсорбция при температурах до ~103 K является необратимой.
