
- •Часть V. Поверхностные явления.
- •1.1.2. Индукционное взаимодействие.
- •1.1.3. Ориентационное взаимодействие.
- •1.3. Водородная связь.
- •2. Поверхностное натяжение
- •3. Поверхностное натяжение растворов. Пав и пиав.
- •1.2. Теория мономолекулярной адсорбции Лэнгмюра.
- •1.3. Теория полимолекулярной адсорбции.
- •1.4. Адсорбция на пористых адсорбентах.
- •1.5. Адсорбция из растворов.
- •Моль/м2 ,
- •1.3.2. Метод счета капель.
- •1.3.3. Метод максимального давления в пузырьке (метод Ребиндера).
- •1.3.4. Метод отрыва диска или кольца.
1.3. Водородная связь.
Такая связь возникает между акцептором электронов – молекулой имеющей в своем составе поляризованную связь атома водорода с каким либо электроотрицательным атомом (А←Н) и донором электронов – молекулой (В), в составе которой имеются атомы с заполненными несвязывающими n–орбиталями (свободными электронными парами), такие как:
![]()
При сближении донора и акцептора на расстояние, сравнимое с длиной обычной химической связи (1.5−3∙10-10 м), происходит образование трехцентровой водородной связи, обусловленной образованием трех молекулярных орбиталей из двух σ–орбиталей акцептора (связывающей и разрыхляющей) и одной несвязывающей n–орбитали донора. Ее прочность обычно находится в пределах от 15−20 кДж/моль до ~200 кДж/моль, то есть от энергии, сравнимой с энергией ион-дипольного взаимодействия, до энергии, близкой к энергии обычной химической связи. В качестве примера можно привести образование водородной связи в дифторид-анионе:
![]() .
.
Ее прочность практически не отличается от прочности обычной химической связи F−H. Сравнительно высокая прочность водородной связи является причиной ассоциации многих молекул в жидком и даже в газообразном состояниях. Так, молекулы карбоновых кислот в органических растворителях димеризованы нацело, а в парах – частично:
![]()
Молекулы воды и спиртов в жидком состоянии и даже в парах также в значительной степени ассоциированы:
![]()
Результатом этого является значительное увеличение энергии, требующейся для испарения одного моля жидкости, а также увеличение самой температуры кипения по сравнению с температурами кипения неассоциированных жидкостей с близкой молярной массой. Так, если бы вода не была ассоциированной жидкостью, ее температура кипения была бы не +100ºС, а близкой к температуре кипения метана (–161ºС).
2. Поверхностное натяжение
Е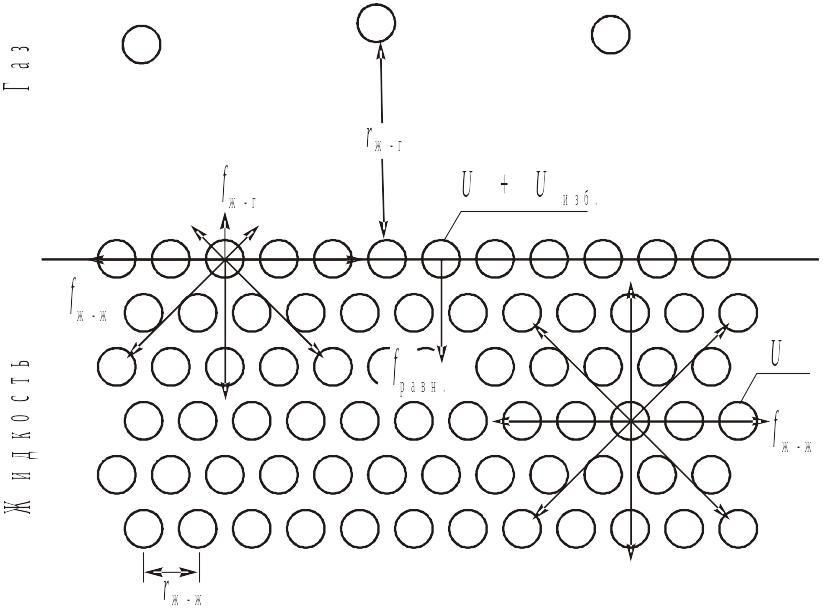 сли
рассмотреть гетерогенную систему,
состоящую из двух фаз, разделенных
поверхностью раздела, можно заметить,
что свойства частиц вещества (молекул,
ионов) вблизи поверхности раздела должны
заметно отличаться от их свойств в
глубине фазы.
сли
рассмотреть гетерогенную систему,
состоящую из двух фаз, разделенных
поверхностью раздела, можно заметить,
что свойства частиц вещества (молекул,
ионов) вблизи поверхности раздела должны
заметно отличаться от их свойств в
глубине фазы.
В
качестве примера рассмотрим поверхность
раздела "жидкость
– газ".
Любая молекула жидкости, находящаяся
внутри фазы и окруженная со всех сторон
одинаковыми молекулами, взаимодействует
с ними таким образом, что равнодействующая
всех сил, действующих на нее, равна нулю.
В то же время энергия взаимодействия
поверхностной молекулы жидкости с
молекулами газа (![]() )
значительно меньше энергии взаимодействия
ее с молекулами жидкости (
)
значительно меньше энергии взаимодействия
ее с молекулами жидкости (![]() ),
поскольку молекулы газа находятся от
нее на значительно большем расстоянии,
чем окружающие молекулы жидкости. В
результате – равнодействующая сил,
действующих на каждую поверхностную
молекулу, уже не равна нулю и направлена
вглубь жидкой фазы перпендикулярно
поверхности раздела. Благодаря этому,
любая поверхностная молекула жидкости
кроме внутренней энергии (U),
определяемой структурой молекулы и
температурой, имеет и избыточную
потенциальную энергию (
),
поскольку молекулы газа находятся от
нее на значительно большем расстоянии,
чем окружающие молекулы жидкости. В
результате – равнодействующая сил,
действующих на каждую поверхностную
молекулу, уже не равна нулю и направлена
вглубь жидкой фазы перпендикулярно
поверхности раздела. Благодаря этому,
любая поверхностная молекула жидкости
кроме внутренней энергии (U),
определяемой структурой молекулы и
температурой, имеет и избыточную
потенциальную энергию (![]() ),
величина которой тем больше, чем больше
равнодействующая сила, втягивающая
поверхностную молекулу вглубь фазы.
Таким образом, избыточная потенциальная
энергия поверхностной молекулы тем
больше, чем больше различие в энергиях
взаимодействия молекул жидкости между
собой и молекул жидкости с молекулами
газа.
),
величина которой тем больше, чем больше
равнодействующая сила, втягивающая
поверхностную молекулу вглубь фазы.
Таким образом, избыточная потенциальная
энергия поверхностной молекулы тем
больше, чем больше различие в энергиях
взаимодействия молекул жидкости между
собой и молекул жидкости с молекулами
газа.
Суммарная избыточная энергия молекул, находящихся на 1 м2 поверхности раздела, называется поверхностным натяжением. Оно равно, также, работе, которую необходимо совершить для образования 1 м2 новой поверхности раздела. При постоянной температуре и постоянном давлении
![]()
Кроме этого, поверхностное натяжение численно равно силе, действующей на единицу длины контура поверхности раздела тангенциально к поверхности. Его размерность составляет, также, Дж/м2 = Н·м/м = Н/м:
![]()
Чем
больше энергия взаимодействия молекул
жидкости между собой (
)
и чем меньше энергия взаимодействия
молекул жидкости с молекулами газа (
),
то есть чем больше разница в
![]() ,
тем больше величина
,
тем больше величина
![]() ,
тем больше поверхностное натяжение на
поверхности раздела. По этой причине
поверхностное натяжение на границе
раздела "вода – воздух" значительно
выше, чем на границе "гексан – воздух",
но значительно меньше, чем на границе
"ртуть – воздух":
,
тем больше поверхностное натяжение на
поверхности раздела. По этой причине
поверхностное натяжение на границе
раздела "вода – воздух" значительно
выше, чем на границе "гексан – воздух",
но значительно меньше, чем на границе
"ртуть – воздух":
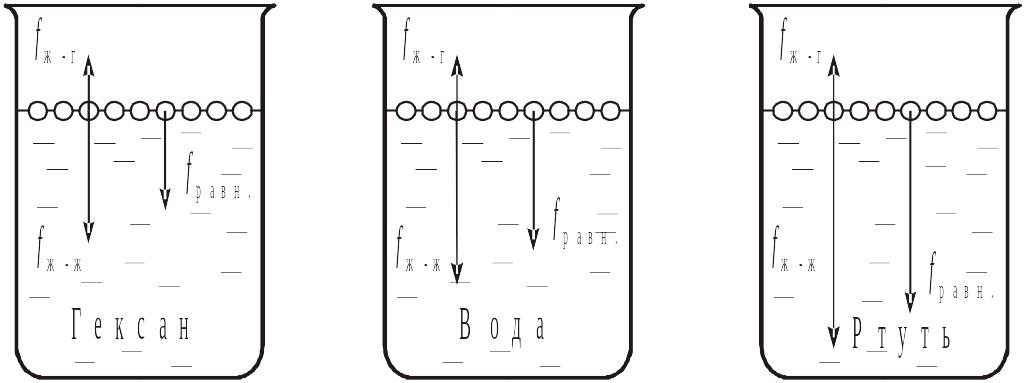
< < Дж/м2
Причиной этого является то, что если неполярные молекулы гексана связаны лишь дисперсионными силами, то полярные молекулы воды связаны не только ван-дер-ваальсовыми силами, но и водородной связью, а атомы и ионы ртути – гораздо более прочной металлической связью.
Поскольку поверхностное натяжение зависит и от энергии взаимодействия молекул одной фазы с молекулами другой фазы, оно уменьшается в ряду: "вода – воздух" > "вода – гексан" > "вода – спирт". В последнем случае поверхностное натяжение практически равно нулю и жидкости, не разделенные поверхностью раздела, смешиваются.
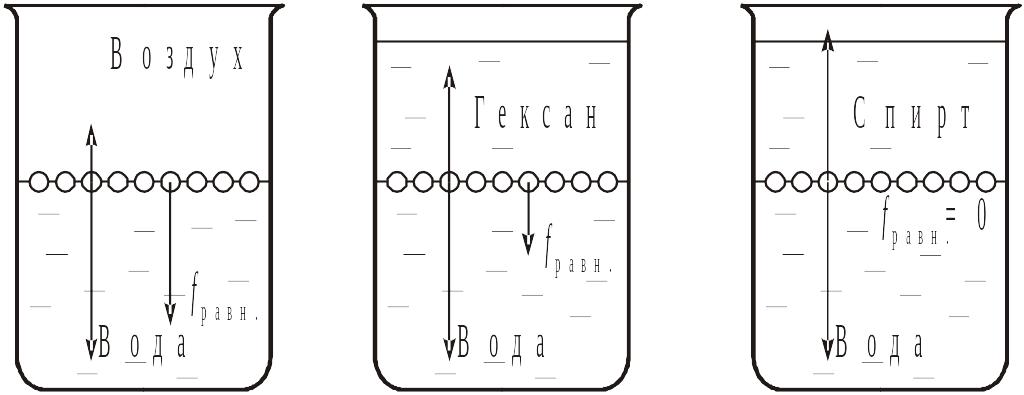
-
σ >
σ >
σ = 0
С
ростом давления газа уменьшается
расстояние между молекулами газа и
жидкости (![]() ),
поэтому увеличивается энергия их
взаимодействия (
),
а значит и
),
поэтому увеличивается энергия их
взаимодействия (
),
а значит и
![]() .
Вследствие этого уменьшается сила,
втягивающая поверхностные молекулы
вглубь фазы (
.
Вследствие этого уменьшается сила,
втягивающая поверхностные молекулы
вглубь фазы (![]() )
и поверхностное натяжение уменьшается.
Так, при 150 атм. величина поверхностного
натяжения на поверхности "вода –
воздух" вдвое меньше чем при нормальном
давлении.
)
и поверхностное натяжение уменьшается.
Так, при 150 атм. величина поверхностного
натяжения на поверхности "вода –
воздух" вдвое меньше чем при нормальном
давлении.
С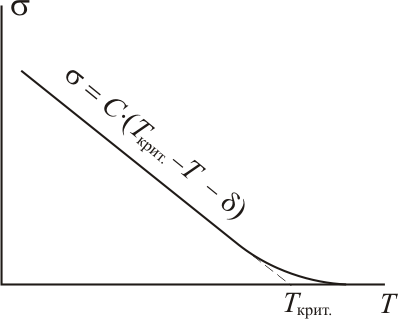 ростом температуры увеличивается
среднее расстояние между молекулами
жидкости (вещества при нагревании
расширяются) и, следовательно, уменьшается
энергия их взаимодействия (
).
С другой стороны, рост температуры
приводит к увеличению давления насыщенного
пара жидкости и соответствующему
уменьшению расстояния между молекулами
жидкости и газа. Это увеличивает энергию
взаимодействия поверхностных молекул
с молекулами газа (
).
Все вместе это приводит к уменьшению
поверхностного натяжения на границе
"жидкость – газ". Зависимость σ
от Т
является линейной почти вплоть до
критической температуры, при которой
поверхностное натяжение уменьшается
до нуля:
ростом температуры увеличивается
среднее расстояние между молекулами
жидкости (вещества при нагревании
расширяются) и, следовательно, уменьшается
энергия их взаимодействия (
).
С другой стороны, рост температуры
приводит к увеличению давления насыщенного
пара жидкости и соответствующему
уменьшению расстояния между молекулами
жидкости и газа. Это увеличивает энергию
взаимодействия поверхностных молекул
с молекулами газа (
).
Все вместе это приводит к уменьшению
поверхностного натяжения на границе
"жидкость – газ". Зависимость σ
от Т
является линейной почти вплоть до
критической температуры, при которой
поверхностное натяжение уменьшается
до нуля:
![]()
Здесь
С
и
![]() − постоянные, зависящие от свойств
жидкости.
− постоянные, зависящие от свойств
жидкости.
Совершенно аналогичные закономерности наблюдаются и на поверхностях твердых тел. И в этом случае поверхностное натяжение тем больше, чем больше разница в энергиях взаимодействия поверхностных молекул с молекулами своей и противоположной фазы. Поскольку плотность вещества в твердом состоянии обычно выше чем в жидком, то частицы в кристаллах располагаются ближе друг к другу. Соответственно выше энергия их взаимодействия, выше и поверхностное натяжение на границе раздела газа с твердым веществом. Особенно велико оно на поверхности ионных кристаллов.
