
- •Лабораторная работа №1 кинетика физико-химических процессов. Химическое равновесие
- •Экспериментальная часть
- •1.2. Расчет и анализ данных, или анализ результатов наблюдений
- •1.3. Вывод
- •2.2. Расчет и анализ данных, или анализ результатов наблюдений
- •2.3. Вывод
- •3.2. Расчет и анализ данных, или анализ результатов наблюдений
- •3.3. Вывод
- •4.2. Расчет и анализ данных, или анализ результатов наблюдений
- •5.2. Расчет и анализ данных, или анализ результатов наблюдений
- •5.3. Вывод
2.3. Вывод
В ходе проведения опыта и по расчетным данным установили, что с роста температуры увеличивается скорость температуру реакции.
3. Название опыта: Зависимость скорости гетерогенной реакции от величины поверхности реагирующих веществ
3.1.Ход и данные опыта
Порядок выполнения опыта: В две пробирки поместили одинаковое количество (по одному полному микрошпателю) мела и мрамора. По возможности одновременно долили в пробирки одинаковые объемы (2 – 3мл) 10 %‑ного раствора соляной кислоты.Наблюдали выделение газа в обеих пробирках. Отметили, в какой из пробирок выделение газа закончится раньше.
3.2. Расчет и анализ данных, или анализ результатов наблюдений
Выделение газа закончилось быстрее в пробирке с мелом.
Запишем уравнение
реакции взаимодействия мела и мрамора
с соленой кислотой, учитывая, что мел и
мрамор имеют одинаковую химическую
формулу:
![]()
Запишем выражение ЗДМ для каждой реакции:
![]()
Т.к. в реакции с
мелом поверхность соприкосновения
больше (мел -пористое вещество) то
вероятность соударения частиц больше,
т.е. реакционная способность мела в
данном случае выше =>![]()
3.3. Вывод
В течение времени проведения опыта убедились, что реакция проходит быстрее между теми веществами, S поверхность соприкосновения которых больше.
4. Название опыта: Влияние концентрации реагирующих веществ на состояние равновесия
4.1.Ход и данные опыта
Условие проведения опыта: Исследуем при постоянной температуре на примере реакции взаимодействия хлорного железа (FeCl3) с роданидом калия (KCNS):
![]() .
.
Красное окрашивание роданида железа Fe(CNS)3 позволяет следить за сдвигом химического равновесия при изменении концентрации реагирующих веществ.
Порядок выполнения опыта: Нальём в химический стакан 5 мл 0,01 нраствора FeCl3 и добавьте 5 мл 0,01 н раствора KCNS (или NH4CNS). Полученный раствор разольём на 4 пробирки. В первую пробирку добавим 3–5 капель концентрированного раствора FeCl3, во вторую – 2–3 капли концентрированного раствораKCNS, в третью поместите немного твердогоKCl(илиNH4Cl), встряхнем пробирку, чтобы ускорить растворение соли. Сравним интенсивность окраски полученных растворов с цветом раствора в контрольной пробирке. Результаты наблюдений запишите в табл. 3
|
Таблица 3 | |||
|
Номер пробирки |
Добавленное вещество |
Изменение интенсивности окраски (ослаблениe, усиление) |
Направление
смещения равновесия
|
|
1 |
|
Усиление (светло-коричневый цвет) |
→ |
|
2 |
|
Усиление (бурый цвет) |
→ |
|
3 |
|
Ослабление (желтый цвет) |
← |
|
4 |
Контрольная |
Оранжевый цвет |
→ ← |
![]()
4.2. Расчет и анализ данных, или анализ результатов наблюдений
Запишем кинетическое условие равновесия:
![]()
Отсюда выведем выражение константы равновесия (Kc)
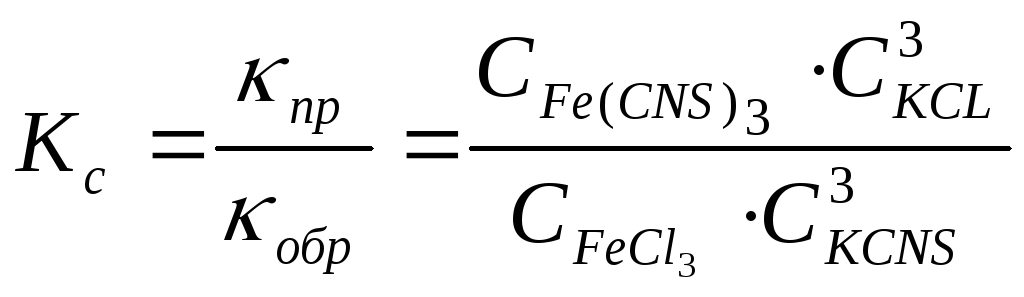
Константа равновесия зависит от природы реагирующих веществ и температуры, но не зависит от концентрации, давления и наличия катализатора.
Смещение химического
равновесия объясняется неодинаковым
изменением
![]() и
и![]() вследствие изменения одного из условий
(C,P,t°),
при этом:
вследствие изменения одного из условий
(C,P,t°),
при этом:
если
![]() ,
то равновесие смещается “ → ”
,
то равновесие смещается “ → ”
если
![]() ,
то равновесие смещается “ ← ”
,
то равновесие смещается “ ← ”
В ходе опыта в первых двух случаях мы увеличивали концентрацию исходных веществ, и равновесие смещалось в сторону продуктов реакцию
В третьем случае мы увеличили концентрацию одного из продуктов реакции (KCL), и равновесие смещалось в сторону исходных веществ.
Результаты опыта подтверждают принцип Ле Шателье: большое количество исходных веществ/продуктов реакции сместило равновесие в сторону продуктов реакции/исходных веществ, чем уменьшило воздействие большего количества исходных веществ/продуктов реакции.
5. Название опыта: Влияние температуры на состояние равновесия
5.1.Ход и данные опыта
Условие проведения опыта: При взаимодействии иода с крахмалом образуется вещество сложного состава – иодокрахмал, синего цвета. Реакцию можно представить в виде
![]()
![]() .
.
Изменение интенсивности синего окрашивания иодокрахмала позволяет следить за сдвигом химического равновесия при изменении температуры.
Порядок выполнения опыта: В пробирку нальем 4 –5 мл раствора крахмала и добавим несколько капель 0,1 н раствораI2до появления синего окрашивания. Разделим содержимое пробирки на две. Нагрейте одну пробирку с раствором, поместив её в стакан с горячей водой. Затем охладите её до комнатной температуры (под проточной водой), наблюдая в обоих случаях за изменением окраски растворов и сравнивая её с контрольной.
