
Контрольная работа №1
Задача 7.
При взаимодействии 2,95г некоторого вещества с 2,75г хлороводорода получилось 4,40г соли. Вычислите эквивалентные массы вещества, соли и установите формулу образовавшейся соли (Вме = 1). Чему равен эквивалентный объем хлороводорода (НСlг) при н.у.?
Решение:
Согласно закону эквивалентов:
![]() =
=
![]()
![]() =
=
![]()
Мэ(Ме) = 39,15г/ моль. Металл - калий
Согласно закону эквивалентов:
![]() =
=
![]()
![]() =
=
![]()
Мэ(соли) = 58,4 г/моль, формула соли – КСl
Эквивалентный объем хлороводорода (НСlг) при н.у. равен 22,4 л/моль
Ответ: Мэ(Ме) = 78,97 г/ моль, Мэ(соли) = 58,4 г/моль
Задача 34.
Составьте электронные формулы элементов с порядковыми номерами 8 и 16. Объясните, почему первый из них проявляет в соединениях основную степень окисления – 2, а второй от – 2 до + 6. Приведите примеры этих соединений.
Решение:
Кислород О имеет электронную конфигурацию невозбужденного атома О8 1s22s22p4:
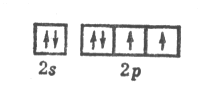
Подобно фтору кислород образует соединения почти со всеми элементами (кроме гелия, неона и аргона). Поскольку по электроотрицательности кислород уступает только фтору, степень окисления кислорода в подавляющем большинстве соединений принимается равной – 2.
Примеры соединений: Н2О-2, SО3-2.
Атом серы S, как и атом кислорода, имеет шесть валентных электронов S16 1s22s22p63s23p43d0 (3s23p4):
![]()
Однако в отличие от кислорода у серы валентными являются и 3d-орбитали. Поэтому наряду с общностью свойств кислород и сера обладают и существенными различиями.
Как и у других р-элементов 3-го периода, максимальное координационное число серы равно шести, а наиболее устойчиво sр3-гибридное состояние. В отличие от кислорода атомы серы способны образовывать dπ – рπ-связи.
Сера – типичный неметаллический элемент. По электроотрицательности (ОЭО = 2,5) она уступает только галогенам, кислороду и азоту. В соединениях она проявляет степени окисления – 2, 0, + 4 и + 6. Для серы наиболее характерны низшая и высшая степени окисления.
Примеры соединений: Н2S-2, S0, S+4О2,S+6О3
Задача 53.
Приведите примеры s – элементов I и II групп периодической таблицы. Какие свойства (кислотные, основные или амфотерные) проявляют s – элементы II группы в соединениях? Приведите примеры таких соединений.
Решение:
К s – элементам I группы периодической таблицы относятся : литий(Li), натрий(Na), калий(К), рубидий(Rb), цезий(Cs), франций(Fr).
К s – элементам II группы периодической таблицы относятся: бериллий(Ве), магний(Мg), кальций(Са), стронций(Sr), барий(Ва).
Бериллий в соединениях проявляет амфотерные свойства. ВеО взаимодействует при сплавлении и с основными, и с кислотными оксидами:
ВеО + SiО2 = ВеSiО3
основный
ВеО + Na2О= Na2ВеО2
кислотный
Магний(Мg), кальций(Са), стронций(Sr), барий(Ва) в соединениях проявляют основные свойства:
СаО + SiО2 = СаSiО3
МgО + СО2 = МgСО3
Задача 98.
С позиций ММО объясните близость значений энергий диссоциации молекул N2 (945 кДж / моль) и СО (1071 кДж / моль). Запишите их электронные формулы и определите порядок связи.
Решение:
Электронная конфигураций молекулы N2 в основном (невозбужденном) состоянии имеет вид:


Молекула СО иэоэлектронна молекуле N2 (содержат по 10 валентных электронов)

что соответствует следующей электронной конфигурации в невозбужденном состоянии:
![]()
В них число связывающих электронов значительно превосходит число разрыхляющих и поэтому указанная молекула характеризуется малым межъядерным расстоянием и высокой энергией диссоциации. Порядок связи, как и в молекуле азота, равен трем.
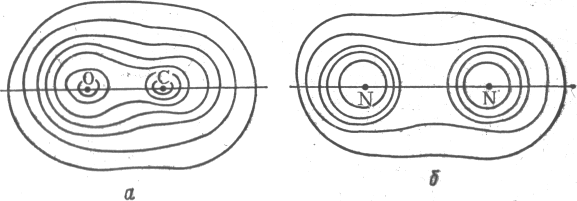
Рис.1. Контурная диаграмма распределения электронной плотности молекул СО (а) и N2 (б)
О характере распределения электронной плотности в молекуле СО можно судить по рис.1. Одинаковый характер распределения электронов по молекулярным орбиталям обусловливает сходство физических свойств СО и N2. В частности, оно проявляется в значении энергий диссоциации молекул N2 (945 кДж / моль) и СО (1071 кДж / моль). Наблюдается также некоторая аналогия в химических свойствах СО и N2.
Задача 108.
Определите скорость химической реакции
2SО3(г) = О2(г) + 2SО2(г)
при исходной концентрации SО3, равной 2,8 моль/л и в момент времени, когда получится 1 моль/л О2.Какова концентрация получившегося SО2? Сформулируйте закон действия масс.
Решение:
Для гомогенной реакции уравнение, выражающее ЗДМ, будет иметь вид:
υх.р. = k [SО3]2
В начальный момент времени:
υх.р. = k ∙ 2,82 = 7,84k
В момент времени, когда получится 1 моль/л О2, согласно уравнению реакции израсходуется 2 ∙ 1 = 2 моль/л SО3 и образуется 2 ∙ 1 = 2 моль/л SО2. Равновесная концентрация SО3 составит:
[SО3] = 2,8 – 2 = 0,8 моль/л
Тогда
υх.р. = k ∙ 0,82 = 0,64k
Закон действия масс: скорость гомогеннной реакции при постоянной температуре прямо пропорциональна произведению концентраций (давлений) реагирующих веществ, возведенных в степень, с показателями, равными стехиометрическим коэффициентам, стоящим в уравнении реакции.
Ответ: 7,84k; 0,64k; [SО2] = 2 моль/л.
Задача 128.
При некоторой температуре равновесие в газовой системе
2NО2(г) = 2NО(г) + О2(г)
установилось при следующих концентрациях веществ:СNО2 = 0,006 моль/л СNО = 0,024моль/л; СО2 = 0,012 моль/л. Определите константу равновесия (Кс) и исходную концентрацию NО2. Как нужно изменить давление и концентрации веществ, чтобы довести реакцию до конца?
Решение:
Запишем выражение для константы равновесия:
Кс
=
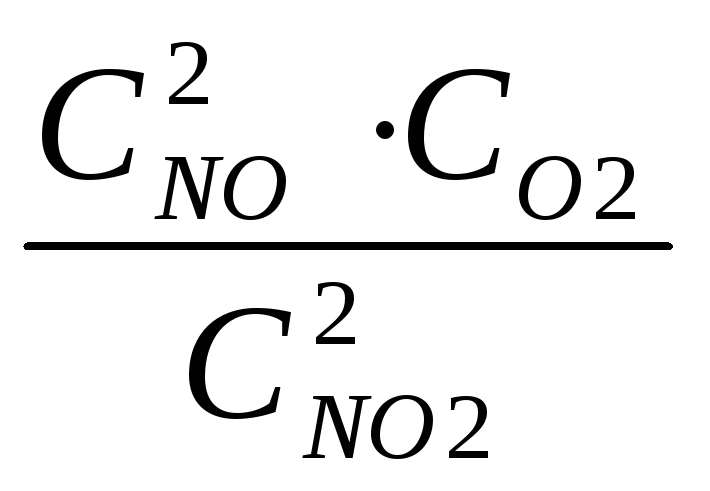 =
=
![]() = 0,192
= 0,192
Т.к. равновесная концентрация NО равна 0,024моль/л, то согласно уравнению реакции на его образование израсходовалось 0,024моль/л
NО2. Исходная концентрация NО2 составит:
Сисх (NО2) = 0,006 + 0,024 = 0,030моль/л
Чтобы довести реакцию до конца, необходимо либо увеличить концентрацию NО2( равновесие сместится в сторону его расходования), либо уменьшить концентрацию любого из продуктов( равновесие сместится в сторону их образования). Давление следует уменьшить( равновесие сместится в сторону большего количества газообразных молей).
Задача 158.
Рассчитайте молярность и нормальность 2,5% - ного раствора NаОН (ρ = 1,03 г/см3).
Решение:
2,5% - ный раствор NаОН соответствует содержанию в 100 г раствора 2,5 г NаОН и 97,5 г Н2О. Для расчета молярности раствора определим массу щелочи в 1 л раствора (1000 мл или 1000 см3). Так как плотность раствора ρ = 1,03 г/см3 , то масса 1 л раствора будет равна 1,03 ∙ 1000 = 1030 г. Масса NаОН будет равна
2,5 – 100
Х – 1030
Х = 2,5 ∙ 1030 / 100 = 25,75 г
Молярная масса NаОН равна 40 г / моль. Следовательно,
См = 25,75 / 40 = 0,64 моль / л
Эквивалентная масса NаОН равна 40 г / моль. Следовательно,
Сн = 25,75 / 40 = 0,64 моль / л
Ответ: См = 0,64 моль / л, Сн = 0,64 моль / л.
Задача 178.
Определите концентрацию и количество ионов в 0,06н растворе FeCl3.
Решение:
Запишем уравнение диссоциации хлорида железа:
FeCl3 → Fe3+ + 3Cl-
Переведем нормальную концентрацию соли в молярную:
См = Сн / n ∙ В = 0,06 / 1∙3 = 0,02 моль/л, где В – валентность металла, n – количество атомов металла в формуле соли.
Согласно уравнению реакции:
СFe3+ = СFeCl3 = 0,02 моль/л
СCl- = 3СFeCl3 = 0,06 моль/л
N = NА ∙ С±, где NА – число Авогадро.
N Fe3+ = 6,02 ∙ 1023 ∙ 0,02 = 1,2 ∙ 1022 ионов.
N Cl- = 6,02 ∙ 1023 ∙ 0,06 = 1,0 ∙ 1025 ионов
Ответ: СFe3+ = 0,02 моль/л, N Fe3+ = 1,2 ∙ 1022 ионов, СCl- = 0,06 моль/л,
N Cl- = 1,0 ∙ 1025 ионов
Задача 223.
Определите рН 0,2% - го раствора плавиковой кислоты НF (ρ = 1 г/см3), если степень ее диссоциации равна 2%.
