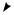Учебник Органическая химия Щеголев 2016
.pdf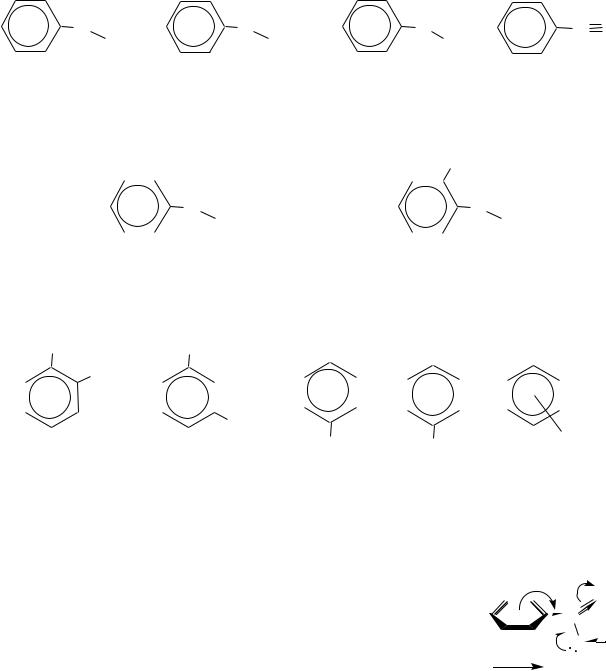
O |
O |
O |
|
= |
= |
= |
C N |
C |
C |
C |
|
Cl |
OCH3 |
NH2 |
|
бензоилхлорид |
метилбензоат |
бензамид |
бензонитрил |
Названия производных замещѐнных бензойных кислот строятся на основе названий производных бензойных кислот. Например:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C2H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
O |
||||||||||
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
||||
|
|
Cl |
C |
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
ONa |
|||||||||
|
|
4-хлорбензоилхлорид |
|
|
|
2-этилбензоат натрия |
||||||||||||||||||||||
|
Для ряда кислот и их производных сохраняются тривиальные и широ- |
|||||||||||||||||||||||||||
ко используются полутривиальные названия. Например: |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
COOH |
COOH |
|
|
COOH |
COOH |
|
|
COOH |
|||||||||||||||||||
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|
|
|
COOH |
OCH3 |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
фталевая |
|
|
|
изофталевая |
терефталевая |
анисовая |
|
|
толуиловые |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(о-, м-, п-) |
|||
10.9.2. СТРОЕНИЕ БЕНЗОЙНОЙ КИСЛОТЫ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
Карбоксильная группа в молекуле бензойной ки- |
|
|
|
|
|
|
|
|
O |
||||||||||||||||||
слоты |
оказывает по |
отношению к ароматическому |
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
C |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
кольцу |
электроноакцепторные |
индуктивный и мезо- |
|
|
|
|
|
|
|
|
O |
H |
||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||
мерный эффекты (аналогия со строением бензальдегида |
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
— гл. 10.8.2). Электронная плотность на кольце пони- |
-I |
-M |
|
жена, особенно в о- и п-положениях. В сопряжение во-
влекается и атом кислорода OH-группы, в связи с чем вся молекула имеет плоское строение.
10.9.3. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Ароматические карбоновые кислоты представляют собой белые кристаллические вещества, некоторые из них обладают приятным запахом.
Важнейшими свойствами самих карбоновых кислот (ароматических так же, как и алифатических) и в ряде случаев таких их производных, как
581
амиды, являются их кислотно-основные свойства. При этом оснóвные свойства незначительны и практического значения не имеют.
Так же, как и для алифатических аналогов, для ароматических кислот и их производных характерны реакции в ацильной группе, приводящие к получению одних производных из других. Ароматические карбоновые кислоты и их производные также вступают во многие реакции, характерные для алифатических аналогов. Это такие, как расщепление амидов по Гофману, декарбоксилирование серебряных солей (реакция Бородина) и другие.
Ещѐ одним важным свойством этих соединений являются реакции по бензольному кольцу, что характерно для всех ароматических производных.
10.9.3.1. Кислотные свойства
Для ароматических карбоновых кислот кислотность связана с возможностью отрыва катиона водорода от карбоксильной группы и образованием стабильного ацилат-иона. При этом аренмонокарбоновые кислоты относятся к слабым OH-кислотам. Бензойная кислота лишь ненамного сильнее уксусной (рКа для бензойной равна 4.17 против 4.76 для уксусной). Лучше всего это можно объяснить возможностью более полной делокализации отрицательного заряда аниона кислотного остатка с участием -электронной системы бензольного кольца.
O |
O |
= |
C |
C |
|
O |
O |
|
Поэтому так же, как и в случаях с аренсульфокислотами и фенолами, электроноакцепторные заместители будут увеличивать кислотные свойства, а электронодонорные, наоборот, — уменьшать.
CO2 |
CO2 |
A |
D |
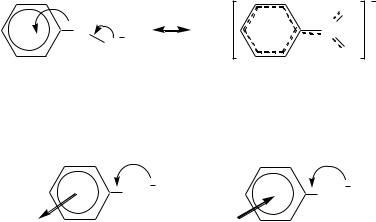
Однако для некоторых заместителей, находящихся в орто-положении бензольного кольца по отношению к карбоксильной группе, влияние на кислотные свойства аренкарбоновых кислот не ограничивается индуктивным и мезомерным эффектами (и пространственным эффектом тоже). Это так называемый орто-эффект, проявляющийся во взаимодействии карбоксильной и находящейся к ней в о-положении функциональной группы за счѐт внутримолекулярных водородных связей. Примером проявления орто-эффекта является взаимодействие заместителей в бензольном кольце салициловой кислоты, увеличивающее еѐ кислотность по сравнению с бензойной (рКа =
582

образовавшегося N-алкилфталимида, который обычно проводят серной или дымящей соляной кислотой при нагревании до 200 С.
10.9.3.2. Реакции в ацильной группе
Реакции нуклеофильного замещения в карбоксильной группе карбоновых кислот и в ацильных группах производных этих кислот протекают аналогично рассмотренным ранее алифатическим аналогам (гл. 6.4.4.2) — из одних ацильных производных образуются другие ацильные производные.
|
|
|
|
|
|
O |
|
|
|
|
|
Nu |
|
|
|
|
|
O |
||||||||
|
|
|
|
|
|
|
- |
|
|
|
|
- |
|
|
|
|
|
|
|
|||||||
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
Ar - C |
X |
+ Nu |
|
|
|
|
Ar - C - O |
- X - |
|
Ar - C |
Nu |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
|
|||
Возможен и кислотный катализ. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
- |
Nu |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
O |
+ |
|
|
|
|
OH |
|
|
|
+ OH |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
+ Nu |
|
|
|
|
|
||||||||||
|
|
|
= |
+H |
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Ar - C |
|
|
|
|
|
Ar - C |
|
|
|
|
Ar - C |
|
|
|
|
|
Ar - C - O H |
|||||||||
|
|
|
X |
|
|
|
|
|
|
X |
|
|
|
X |
|
|
|
|
|
|
X |
|
|
|
||
|
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ar - C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
- X - |
Nu |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
- H |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Скорость реакции зависит от пространственных факторов, величины заряда на карбонильном атоме углерода и природы уходящей группы (еѐ основности). Таким образом, реакционная способность ароматических карбоновых кислот и их производных уменьшается в том же ряду, что и их алифатических аналогов:
O |
O O |
O |
|
O |
|
O |
|
|
|
||||
= |
> Ar-C-O-C-Ar > |
= |
> |
= |
> |
= |
Ar - C |
Ar - C |
Ar - C |
Ar - C |
|||
Cl |
|
OH |
|
OR |
|
NH2 |
Для аренкарбоновых кислот характерны также реакции декарбоксилирования, начинающиеся с нуклеофильной атаки по карбонильному атому уг-
лерода (гл. 6.4.4.4).
10.9.3.3. Электрофильное замещение
Карбоксильная группа оказывает электроноакцепторное влияние на бензольное кольцо и направляет вступающий электрофил преимущественно в мета-положение. Это можно показать граничными формулами распределения электронной плотности в исходной молекуле бензойной кислоты:
584
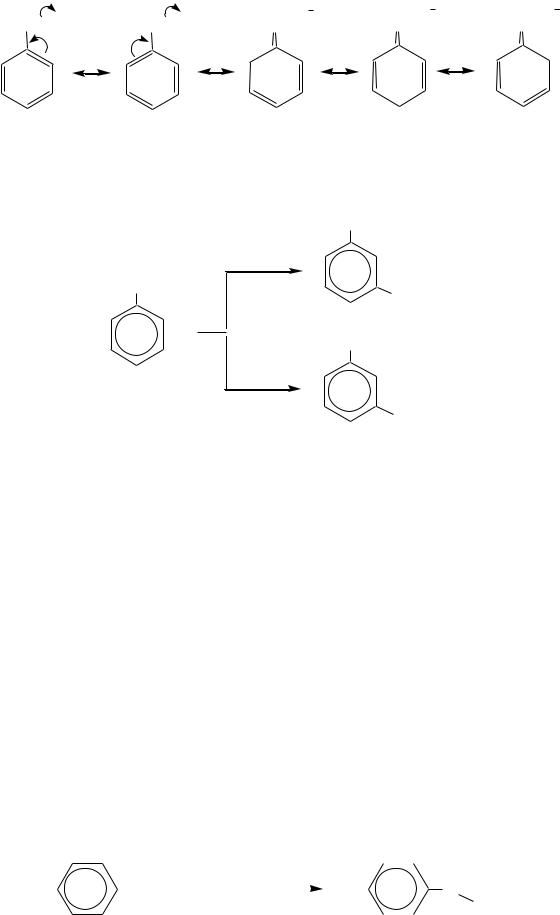
HO-C=O |
HO-C=O |
HO-C-O |
HO-C-O |
HO-C-O |
|
|
+ |
|
+ |
|
|
|
+ |
|
Из SE-реакций для аренкарбоновых кислот (и их ацильных производных) характерны реакции нитрования, сульфирования и галогенирования. Например:
COOH
|
NO+ |
|
2 |
COOH |
- H+ |
|
NO2 |
|
COOH |
SO3H +
- H+
SO3H
10.9.4. СПОСОБЫ ПОЛУЧЕНИЯ
Для получения ароматических карбоновых кислот можно использовать способы, применяющиеся для получения их алифатических аналогов
(гл. 6.4.5).
1.Окисление спиртов, альдегидов, кетонов.
2.Гидролиз , , -тригалогенаренов.
3.Металлорганический синтез (карбоксилирование реактивов Гринь-
яра).
4. Гидролиз (гидратация) нитрилов.
Однако ароматические карбоновые кислоты и их производные можно получать не только выше перечисленными, но и другими способами.
5.Окисление аренов кислородом в присутствии катализаторов (соли кобальта и марганца) или обычными неорганическими окислителями (перманганаты, дихроматы). Эти реакции были рассмотрены в главе 9.5.1.4.
6.Ацилирование аренов с помощью фосгена — прямой способ получения галогенангидридов:
|
|
AlCl3 |
|
|
O |
|
|
= |
|||
+ COCl2 |
- HCl |
|
|
C |
|
|
|
|
|
Cl |
|
|
|
|
|
|
|
|
|
585 |
|
|
|

10.9.5. ВАЖНЕЙШИЕ ПРЕДСТАВИТЕЛИ
Бензойная кислота — бесцветное кристаллическое вещество с температурой плавления 122 С. Легко возгоняется. Обладает бактерицидными свойствами. В промышленности бензойную кислоту получают окислением толуола.
Используется для получения красителей, душистых и лекарственных веществ.
п-Аминобензойная кислота (витамин H1) участвует во многих жизненно важных процессах в качестве промежуточного вещества. В связи с этим является жизненно важным фактором для многих микроорганизмов, а также необходимым элементом для биосинтеза некоторых витаминов. Эфиры п-аминобензойной кислоты нашли применение в медицине как лекарственные вещества с местноанестезирующим действием. Примерами таких веществ могут служить новокаин и анестезин. Этиловый эфир п-амино- бензойной кислоты (анестезин) применяется как местноанестезирующее средство более 70 лет. Получают его из п-нитротолуола по следующей схеме:
|
CH3 |
|
|
|
COOH |
|
|
|
COOC2H5 |
|
|
COOC2H5 |
||||||||||||
|
|
|
||||||||||||||||||||||
|
|
K2Cr2O7 |
|
|
|
|
|
C2H5OH |
|
|
|
|
|
|
Fe |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2SO4 |
|
|
|
|
|
|
H2SO4 |
|
|
|
|
|
CH3COOH |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NO2 |
|
NO2 |
|
NO2 |
NH2 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
анестезин |
|||
Терефталевая кислота — бесцветное кристаллическое вещество с температурой плавления 425 С, но при температуре 300 С возгоняется.
В промышленности терефталевую кислоту получают окислением п-ксилола кислородом воздуха.
Используется в производстве синтетического волокна лавсана (полиэтилентерефталата) и кевлара (поли-п-фенилентерефталата). Такие полимеры обладают прекрасной термической устойчивостью (что определяется наличием ароматических циклов) и очень хорошими механическими свойствами.
Фталевый ангидрид — бесцветное кристаллическое |
O |
||
вещество с температурой плавления 131 С. |
|
||
В промышленности фталевый ангидрид получают |
|
|
O |
окислением нафталина или о-ксилола. |
|
|
|
Применяется для получения полиэфиров, пластифи- |
O |
||
каторов и красителей; используется в органическом синте- |
|
||
зе для получения биологически активных соединений. |
|
||
586 |
|
|
|
Салициловая кислота (гл. 10.5.3, 10.9.3.1) — бесцветное кристаллическое вещество с температурой плавления 159 С. Легко возгоняется. В промышленности получают карбоксилированием фенола.
Салициловая кислота и еѐ производные используют в медицине в качестве лекарственных препаратов.
10.10. ФИЗИОЛОГИЧЕСКАЯ РОЛЬ ФУНКЦИОНАЛЬНЫХ ПРОИЗВОДНЫХ БЕНЗОЛА
Как уже указывалось в главе 9.7, при метаболическом окислении ароматических углеводородов в результате ароматического гидроксилирования образуются фенолы. Аналогичные продукты образуются и при окислении различных функциональных производных. Важную роль здесь играет структурная избирательность, зависящая от свойств субстрата. Например, при метаболизме анилина образуются все три возможных изомерных гидроксипроизводных (50 % п-гидроксианилина, 10 % о-изомера и 0.1 % м-изомера), тогда как из нитробензола преимущественно образуются п- и м-изомеры. Если бензольное ядро ксенобиотика содержит несколько заместителей, то гидроксилирование может идти по нескольким положениям, как, например, в случае салициловой кислоты:
|
OH |
|
OH |
COOH |
COOH |
COOH |
COOH |
|
+ |
+ |
|
OH |
OH HO |
OH HO |
OH |
салициловая кислота
Среди лекарственных препаратов на основе салициловой кислоты наиболее известны фенилсалицилат (салол), ацетилсалициловая кислота (аспи-
рин).
Фенилсалицилат является эфиром салициловой кислоты и фенола:
 COO
COO 
OH
Он применяется в порошках и таблетках при заболеваниях кишечника. Действие препарата основано на том, что в слабощелочном содержимом кишечника фенилсалицилат гидролизуется до салициловой кислоты и фенола, которые угнетающе действуют на кишечную флору. Салициловая кислота и
587
фенол частично выделяются из организма почками и могут оказывать дезинфицирующее действие в мочевых путях.
Действие ацетилсалициловой кислоты во многом сходно с действием на организм салицилата натрия, что понятно, так как ацетильное производное в желудочно-кишечном тракте гидролизуется:
COOH |
+ H2O |
COOH + CH3COOH |
|
||
O |
|
|
O C CH3 |
|
OH |
Ацетилсалициловую кислоту применяют внутрь при мигрени, а также как жаропонижающее и болеутоляющее средство. Она оказывает противовоспалительное действие.
При метаболическом расщеплении О-замещѐнных фенолов скорость О-дезалкилирования снижается при увеличении длины неразветвлѐнной алкильной цепи, а электронодонорные группы около -углеродного атома увеличивают скорость реакции. Значительное влияние на скорость реакции оказывают и заместители в ароматическом цикле, однако не менее существенна и роль пространственных факторов.
п-Бензохинон, как и все хиноны, — сильный окислитель. Окислитель- но-восстановительные свойства системы хинон–гидрохинон играют важную роль в организме. По отношению к большинству органических субстратов эта система играет роль окислителя, участвуя в переносе электронов от субстрата к кислороду.
Анилин и многие ароматические амины довольно токсичны. Они являются нервными и кровяными ядами.
Анилин обладает жаропонижающим действием, однако не применяется в медицине вследствие своей токсичности.
Большое значение в химии лекарственных соединений имеют аминокислоты ароматического ряда, которые участвуют во многих жизненно важных процессах в качестве промежуточных веществ. Это п-аминобензойная кислота (витамин H1).
Если п-аминобензойная кислота является необходимым фактором для нормальной деятельности микроорганизмов, то п-аминосалициловая кислота, участвуя в обмене веществ, подавляет рост микроорганизмов. Таким образом, п-аминосалициловая кислота является антагонистом п-амино- бензойной кислоты. п-Аминосалициловая кислота и еѐ натриевая соль обладают бактериостатической активностью в отношении микобактерий туберкулѐза и относятся к основным противотуберкулѐзным препаратам. При
588
приѐме внутрь п-аминосалициловая кислота хорошо всасывается и проникает в сыворотку крови и ткани внутренних органов. п-Аминосалициловую кислоту и еѐ соль часто применяют в комбинации с другими противотуберкулѐзными препаратами.
Получают п-аминосалициловую кислоту из м-аминофенола карбоксилированием:
|
COONa |
OH |
OH |
|
CO2, NaHCO3 |
NH2 |
NH2 |
ВОПРОСЫ И УПРАЖНЕНИЯ
1.Сравните строение и реакционную способность галогенозамещѐнных углеводородов ароматического и алифатического рядов. Найдите сходство и объясните различие в поведении хлорбензола, этилхлорида и винилхлорида.
2.Разберите механизмы реакций нуклеофильного замещения в ароматическом кольце на примере ароматических галогенопроизводных.
3.Сравните кислотные свойства следующих соединений: п-нитробензол- сульфокислоты, бензолсульфокислоты, п-хлорбензолсульфокислоты, о-толуолсульфокислоты, воды. Объясните.
4.Какое из предложенных соединений наиболее легко десульфируется: бензолсульфокислота, п-хлорбензолсульфокислота, о-толуолсульфо- кислота, п-нитробензолсульфокислота. Поясните. Приведите механизм реакции.
5.Объясните, почему для ароматических сульфокислот возможны реакции замещения сульфогруппы как по электрофильному, так и по нуклеофильному пути. Сравните условия протекания этих реакций.
6.Какие продукты образуются при взаимодействии п-изопропил- бензолсульфокислоты: а) с концентрированной серной кислотой, б) с избытком нитрующей смеси, в) с кипящей очень разбавленной соляной кислотой? Приведите механизмы реакций.
7.Приведите три уравнения реакций хлорирования п-толуол- сульфокислоты: а) хлором в присутствии железа, б) хлором на свету, в) пентахлоридом фосфора (V). Приведите механизмы этих реакций.
589
8.Приведите механизм нуклеофильного замещения для 1,2,3-тринитро- бензола при взаимодействии с гидроксидом натрия. Какая нитрогруппа заместится в первую очередь и сколько всего нитрогрупп заместится при избытке нуклеофильного реагента? Поясните. Приведите механизм реакции.
9.Проведите сульфирование: а) этилбензола, б) бензойной кислоты. Рассмотрите механизм реакции сульфирования на примере (а). Объясните, почему группа -СООН является м-ориентантом и обладает дезактивирующим действием.
10.Какие продукты образуются при взаимодействии ,п-динитротолуола: а) с нитрующей смесью, б) с разбавленным водным раствором щѐлочи? Приведите механизмы реакций.
11.Сравните строение и свойства фенолов и ароматических спиртов. Каковы причины различия и в чѐм наблюдаются общие черты? Приведите примеры.
12.Сравните кислотные свойства следующих соединений: фенол, п-нитрофенол, п-хлорфенол, о-нитрофенол, м-нитрофенол. Объясните.
13.Сравните основные свойства следующих соединений: бензиламин, этиламин, аммиак, N-этиланилин, п-этиланилин. Объясните.
14.Приведите схемы и механизмы реакций превращения следующих аминов при взаимодействии с азотистой кислотой: а) м-броманилина, б) N,N- диметиланилина.
15.Из анилина получите: а) п-нитроанилин, б) N,N-диэтиланилин. Какой из аминов будет проявлять более сильные оснóвные свойства? Дайте объяснение.
16.Получите п-толуиловый альдегид: а) окислением ароматического спирта, б) гидролизом соответствующего дигалогенопроизводного. Для альдегида приведите уравнения реакций: а) с гидроксиламином, б) конденсации с уксусным ангидридом (укажите условия конденсации).
17.Для п-хлорбензальдегида приведите механизмы реакций: а) с ацетоном, б) уксусным альдегидом, в) уксусным ангидридом.
18.Сравните кислотные свойства следующих соединений: бензойная кислота, п-бензолдикарбоновая кислота, п-гидроксибензойная кислота, п-нит- робензойная кислота. Объясните. Какое из этих соединений легче вступает в реакцию электрофильного замещения?
19.Получите п-толуиловую кислоту следующими реакциями: а) гидролизом нитрила, б) окислением спирта. Для кислоты напишите схемы реакций: а) образования хлорангидрида кислоты, б) бромирования в присутствии катализатора (SE).
20.С помощью каких реакций можно различить следующие соединения: а) бензилацетат и п-этилбензойную кислоту, б) бензамид и п-амино- бензойную кислоту?
590


 O
O O
O N
N H
H