
Учебник Органическая химия Щеголев 2016
.pdf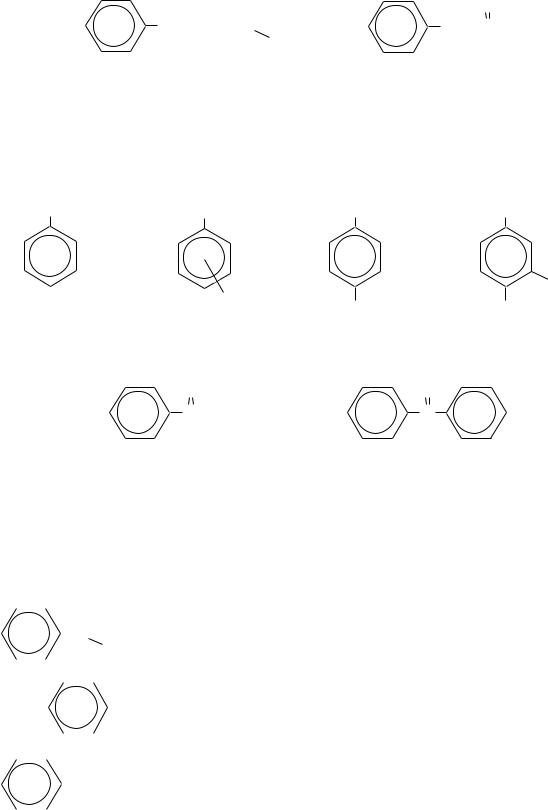
ских карбонильных соединений можно выделить соединения, содержащие ароматическое кольцо в алифатической углеводородной цепи альдегида или кетона, например:
|
O |
O |
|
|
|
= |
CH2-C-CH3 |
|
CH2-CH2-C |
H |
|
|
|
|
В молекулах таких соединений отсутствует прямое взаимодействие между карбонильной группой и бензольным кольцом, и поэтому, за некоторым исключением, здесь они рассматриваться не будут.
Относительно небольшое число ароматических альдегидов и кетонов имеют распространѐнные тривиальные названия. Например:
CHO |
CHO |
CHO |
CHO |
|
CH3 |
|
OCH3 |
|
OCH3 |
OH |
|
|
|
||
бензальдегид |
толуиловые |
анисовый |
ванилин |
|
альдегиды (о-, м-, п-) |
альдегид |
|
|
O |
O |
|
|
C-CH3 |
C |
|
|
ацетофенон |
бензофенон |
|
Из систематических названий альдегидов более всего распространена заместительная номенклатура, по которой к названию циклической системы (арена или другого ароматического соединения) добавляется обозначение «карбальдегид» (гл. 1.5.1), а названия ароматических кетонов (так же как и для алифатических) строятся при помощи суффикса -он. Например:
|
|
|
|
|
|
|
|
|
|
|
O |
|
||
|
|
|
|
|
|
|
= |
|
|
— бензолкарбальдегид, |
||||
|
|
|
|
|
|
|
|
C |
H |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— 4-метилбензолкарбальдегид, или |
H3C |
|
|
|
|
|
|
|
|
|
|
|
CHO |
||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
п-толуолкарбальдегид, |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
— 1-фенилэтанон. |
||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
C-CH3 |
||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
571 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
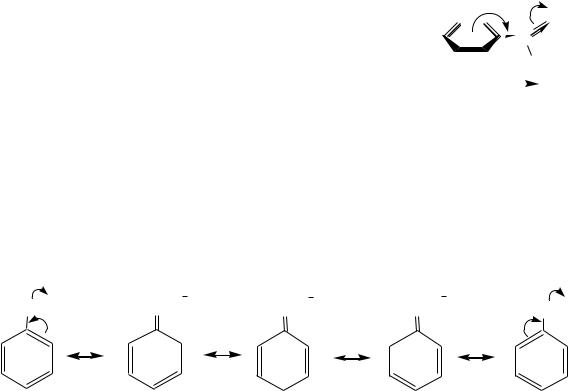
Однако для названий кетонов чаще используется радикало-функциональная номенклатура, по которой сначала перечисляются в алфавитном порядке радикалы, связанные с кетонной группой, а затем добавляется слово «кетон». Например, ацетофенон (1-фенилэтанон) получит название метилфенилке-
тон.
10.8.2.СТОЕНИЕ БЕНЗАЛЬДЕГИДА
Вкарбонильной группе >C=O-связь между
углеродом и кислородом сильно-полярна из-за сме- |
|
|
|
|
|
|
|
|
|
O |
щения к атому кислорода как -, так и -электронов |
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|||||||
этой связи. Но в молекулах ароматических альдеги- |
|
|
|
|
|
|
|
H |
-I |
|
дов и кетонов (например, в бензальдегиде) карбо- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-M |
|
нильная группа связана с ароматическим кольцом. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Поэтому по отношению к нему альдегидная группа в молекуле бензальдегида является сильным электроноакцептором как за счѐт индуктивного, так и за счѐт мезомерного влияния (гл. 10.1.1).
Мезомерный эффект проявляется за счѐт перекрывания рz-орбиталей карбонильного атома углерода и атома углерода бензольного кольца. В результате электронная плотность на кольце понижена, и особенно в орто- и пара-положениях.
HC=O |
HC-O |
HC-O |
HC-O |
HC=O |
|
|
+ |
+ |
|
+
В итоге молекула бензальдегида плоская, все атомы углерода находятся в состоянии sp2-гибридизации, углы близки к 120 .
При смещении электронной плотности с бензольного кольца происходит экранирование карбонильного атома углерода, и бензальдегид труднее вступает в характерные для альдегидов реакции нуклеофильного присоединения, чем алифатические альдегиды.
Таким образом, результатом такого распределения электронной плотности является уменьшение реакционной способности бензальдегида как по отношению к электрофилам в сравнении с бензолом, так и по отношению к нуклеофилам в сравнении с алифатическими аналогами.
572
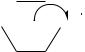
10.8.3. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Ароматические карбонильные соединения — это бесцветные жидкости или кристаллические вещества с приятным запахом.
Химические свойства, прежде всего, определяются наличием карбонильной группы (поэтому они должны быть аналогичны алифатическим альдегидам и кетонам) и бензольного кольца (как для любых замещѐнных бензолов). Однако возможны и специфические реакции.
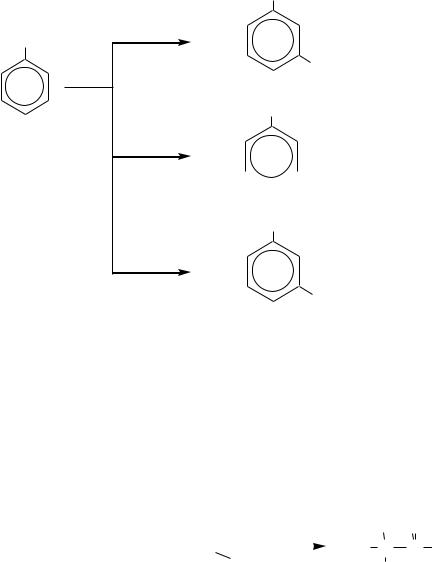
Здесь не будут рассматриваться реакции, аналогичные алифатическим альдегидам и кетонам, такие как окисление, восстановление, замещение в алифатическом радикале (для жирно-ароматических кетонов), в том числе галоформная проба и некоторые из реакций нуклеофильного присоединения (гл. 6.1.4.1). Хотя, например, окисление ароматических альдегидов протекает очень легко даже кислородом воздуха на свету. Это объясняется образованием стабильного ароильного радикала
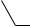 C=O
C=O
10.8.3.1. Нуклеофильное присоединение
Это типичные реакции всех альдегидов и кетонов. Ранее на примере алифатических аналогов (гл. 6.1.4.1) рассматривался этот тип реакций. Для ароматических карбонильных соединений также характерно присоединение воды, спиртов, синильной кислоты, гидросульфита натрия, аммиака и его производных, реактивов Гриньяра; по этому механизму протекают также рассмотренные ранее в алифатическом ряду реакции с гидридами металлов, пентахлоридом фосфора. Для оксимов кетонов возможно протекание бекмановской перегруппировки с образованием N-ариламидов ароматических карбоновых кислот.
В целом ароматические альдегиды и кетоны менее реакционноспособны, чем их алифатические аналоги. Это объясняется двумя причинами: электронной и стерической. Первая причина связана со смещением электронной плотности с бензольного кольца на карбонильный атом углерода и уменьшением за счѐт этого эффективного положительного заряда на этом атоме и электростатическим отталкиванием нуклеофильной частицы -электронной плотностью бензольного кольца. Вторая причина — это пространственные препятствия для подхода атакующей частицы к реакционному центру (карбонильному атому углерода).
Уменьшение реакционной способности ароматических соединений по сравнению с алифатическими отразилось и на возможности протекания некоторых АN-реакций. Так, если с гидросульфитом натрия взаимодействуют
573
любые альдегиды и алифатические метилкетоны, то ароматические кетоны не присоединяют NaHSO3.
|
O |
|
O- |
O- |
OH |
|
|
|
- |
||
= |
+ |
S=O |
CH-SO3H |
CH-SO3 |
|
C |
H |
||||
|
|
|
|
|
|
|
|
|
OH |
|
|
O |
O- |
||
|
|
||
|
= |
+ S=O |
|
|
C |
||
|
CH3 |
|
|
|
OH |
||
Аналогично формальдегиду (и некоторым другим алифатическим альдегидам) аренкарбальдегиды могут вступать в реакцию с фенолами и ароматическими аминами, как, например, рассмотрено в главах 10.5.3.3 и 10.6.3.1 на примере взаимодействия фенола и анилина с формальдегидом. Если субстратом считать фенол (или анилин), то механизм реакции SE, а по отношению к альдегиду механизм АN.
Отсутствие -водородных атомов в молекулах ароматических альдегидов создаѐт препятствия для протекания обычных в алифатическом ряду реакций альдольной и кротоновой конденсации. Поэтому для аренкарбальдегидов будут возможны только перекрѐстные реакции с участием алифатического альдегида, кетона или родственных соединений, содержащих - водородные атомы. При этом альдоль не образуется, а получаются сразу непредельные соединения (аналогичные продуктам кротоновой конденсации в алифатическом ряду). Например:
|
|
H |
|
|
|
- O-CH CH-C=O |
|
|
|
HC=O |
CH -C=O |
|
HC CH-C=O |
|
|
2 |
|
|
|
|
H |
OH- |
|
- |
|
+ |
- H2O |
- OH |
|
|
|
|
Или конденсация ароматических альдегидов с алифатическими альдегидами или кетонами (реакция Кляйзена Шмидта), протекающая в присутствии водных растворов щелочей:
15 30 С, ОН
Ar-CHO + R-СН2-СО-R’ . Ar-CH=CR-С(O)R’ + Н2О
Аналогичная реакция протекает с нитроалканами:
Ar-CHO + СН3NО2 Ar-CH=CH-NO2
574

Взаимодействие ароматических альдегидов с ангидридами карбоновых кислот известно под названием конденсации Перкина*. Например:
|
|
|
O |
|
|
|
|
|
|
|
|
O |
|
= |
|
CH COOK |
|
|
|
|
|
|
|
CH3-C |
|
|
|
|
||||
= |
+ |
|
|
3 |
|
|
|
|
CH=CH-COOH |
|
|
|
|
|
|
|
|||||
C |
H |
O |
|
-CH3COOH |
|
|
|
|||
|
|
CH3-C |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
|
|
|
= |
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
Образование сразу непредельного продукта в этих случаях можно объяснить его устойчивостью за счѐт наличия длинной сопряжѐнной системы с участием ароматического кольца. Такая сопряжѐнная система не может образоваться, если реакция протекает только между алифатическими соединениями.
10.8.3.2. Диспропорционирование
Ранее на примере алифатических альдегидов рассматривались реакция Канниццаро и реакция Тищенко (гл. 6.1.4.3). В ароматическом ряду механизм и условия протекания этих реакций аналогичны алифатическим соединениям. В реакции Каниццаро все аренкарбальдегиды ввиду особенностей их строения (отсутствие -водородного атома) в присутствии щелочей превращаются в соль ароматической карбоновой кислоты и ароматический спирт.
|
O |
- |
|
O |
|
|
= |
+OH |
= |
- |
+ |
Ar - CH2OH |
|
2 Ar - C |
H |
|
Ar - C |
|||
|
|
|
O |
|
|
|
В присутствии формальдегида как более активного вещества будет происходить восстановление аренкарбальдегида.
|
O |
|
|
O |
+OH |
- |
|
- |
= |
+ |
= |
|
Ar - CH2OH + HCOO |
||||
Ar - C |
H |
H - C |
H |
|
|
|
||
|
|
|
|
|
|
|
||
Главным ограничением протекания реакции в ароматическом ряду являются стерические препятствия.
10.8.3.3. Электрофильное замещение
Для альдегидов и кетонов реакции электрофильного замещения по бензольному кольцу протекают труднее, чем для незамещѐнного бензола и аренов, так как электронная плотность на кольце понижена за счѐт –I- и –M- эффектов карбонильной группы. То есть, для них скорость реакций нитрования, сульфирования, галогенирования существенно ниже, чем для бензола, а реакции алкилирования, ацилирования, нитрозирования либо совсем не осуществляются, либо требуют для протекания особых условий.
575
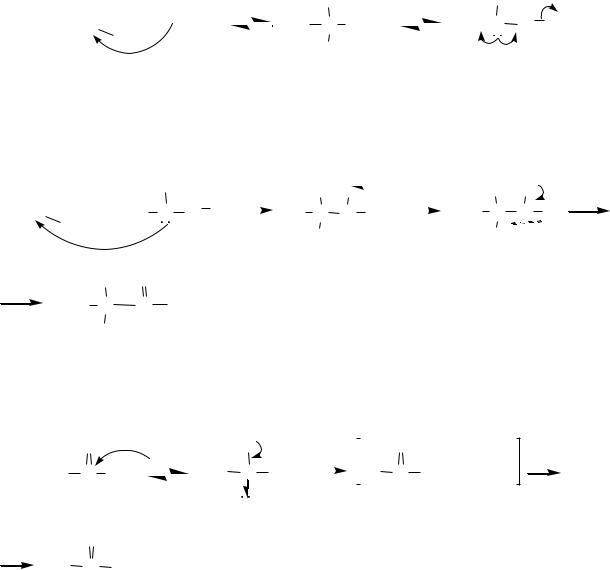
|
O |
- |
|
|
|
O- |
|
|
|
|
|
OH |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
||
= |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|||
Ar - C |
H |
+ :CN |
|
|
|
Ar C C |
|
N |
|
|
|
Ar C C |
|
|||||
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Образовавшаяся частица, проявляя нуклеофильные свойства, необратимо взаимодействует со второй молекулой аренкарбальдегида, а дальнейшая перегруппировка и отщепление цианид-иона определяются образованием более устойчивых продуктов:
|
|
OH |
|
O- |
|
|
|
|
|
|
|
- |
|
||||
O |
|
O |
|
H |
|
HO |
O: |
|
|||||||||
|
|
||||||||||||||||
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
= |
|
|
|
|
|
|
|
|
|
|
|
Ar |
|
|
|
Ar |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Ar - C |
H + Ar C C N |
|
Ar C |
C Ar |
C |
C |
|||||||||||
|
|
|
|
|
|
|
|
H |
|
|
|
||||||
|
|
|
|
|
|
|
H |
CN |
|
|
CN |
||||||
OH O
- Ar C C Ar
-CN
H
Расщепление диарилкетонов. Эта реакция протекает при действии на кетоны амидов щелочных металлов.
|
O |
|
|
- |
|
|
O- |
|
|
|
O |
||
|
|
|
|
|
|
|
|
||||||
|
|
|
|
:NH2 |
Ar |
|
|
|
|
Ar |
- |
||
Ar |
C Ar' |
|
|
|
|
C NH2 |
|
|
|
C NH2 + :Ar' |
|||
|
|
|
|
|
|
||||||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
Ar' |
|
|
|
|
|
|
O |
- |
|
|
|
|
|
|
|
|
|
|
|
Ar |
|
|
+ Ar'-H |
|
|
|
|
|
|
||||
C NH |
|
|
|
|
|
|
|||||||
Продуктами реакции являются арен и амид аренкарбоновой кислоты (при подкислении).
Образование кетил-радикалов. Для бензофенона и некоторых его производных при присоединении атома водорода характерно образование стабильных радикалов. Например, в растворе изопропилового спирта при поглощении кванта света молекула бензофенона переходит в возбуждѐнное состояние вследствие перескока электрона с одного энергетического уровня на другой (со связывающих орбиталей на разрыхляющие). Бензофенон имеет долгоживущее ( 10-2с) возбуждѐнное состояние. Затем происходит отрыв водорода от молекулы растворителя с образованием кетил-радикала. Этот радикал отрывает ещѐ один атом водорода, давая бензгидрол, или димеризуется до бензпинакона:
577
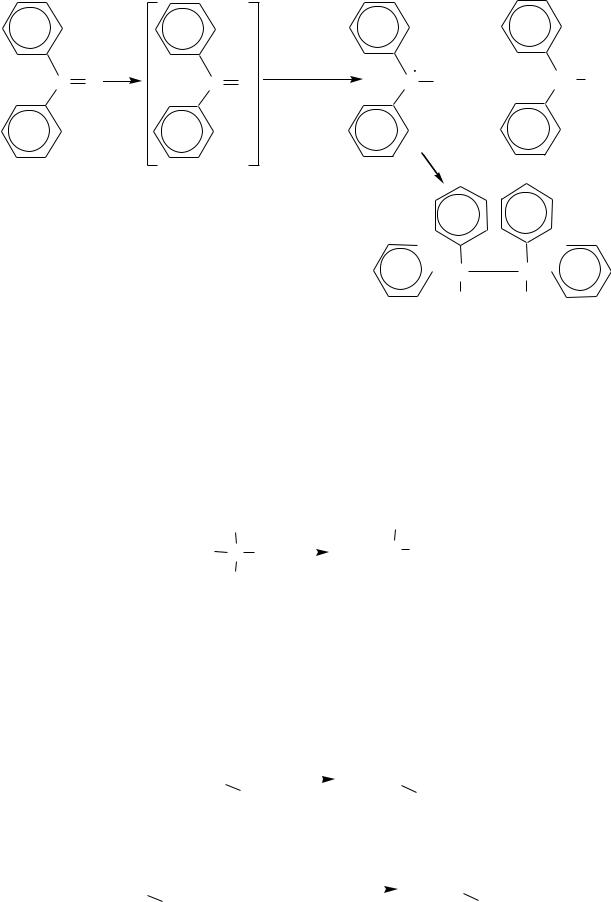
Бензофенон С6H5COС6H5 — бесцветное кристаллическое вещество с температурой плавления 49 С.
В промышленности бензофенон получают окислением дифенилметана. Используется в органическом синтезе и в качестве фотосенсибилизато-
ра.
10.9.АРОМАТИЧЕСКИЕ КАРБОНОВЫЕ КИСЛОТЫ
ИИХ ПРОИЗВОДНЫЕ
Ароматические карбоновые кислоты содержат в своих молекулах связанные друг с другом ароматическое кольцо и карбоксильную группу (возможно, не одну).
Как и алифатические аналоги, ароматические карбоновые кислоты могут образовывать ацильные производные (ангидриды, галогенангидриды, сложные эфиры, амиды, соли) и нитрилы.
10.9.1. КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА
По количеству карбоксильных групп, содержащихся в молекулах карбоновых кислот их можно разделить на монокарбоновые, дикарбоновые, трикарбоновые и т. д. кислоты.
Для названия ароматических карбоновых кислот наиболее применима заместительная номенклатура. При этом атомы углерода карбоксильной группы не включаются в родоначальную структуру. Таким образом, простейшая ароматическая кислота должна получить название «бензолкарбоновая кислота», однако за ней сохраняется тривиальное название бензойная кислота, которое используется как родоначальное при составлении названий замещѐнных ароматических кислот. Например:
|
|
COOH |
|
|
|
|
COOH |
HO |
|
|
|
|
COOH |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
C2H5 |
C H |
5 |
|
|
||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
2 |
|
|
|
||
бензолкарбоновая кислота, |
2-этилбензойная кислота |
4-гидрокси-3-этилбензойная |
|||||||||||
или бензойная кислота |
|
|
|
|
|
|
|
|
|
кислота |
|||
Ацильные производные бензойной кислоты называются при помощи слова «бензоил» (название ацила) или «бензоат» (название ацилата); для амида название «бензолкарбоксамид» обычно сокращается до бензамида. Нитрил бензойной кислоты должен называться соответственно «бензолкарбонитрил»; название сокращается до бензонитрила:
580

 SO
SO HC OH
HC OH C C
C C 