
- •Дефильность молекул и их ориентация на межфазной поверхности. Стандартная работа адсорбции. Растворимые пав. Уравнение Шишковского. Правило Дюкло-Траубе. Связь уравнения Гиббса с уравнением Ленгмюра.
- •Билет 2 Белые золи. Определение дисперсности белого золя по оптической плотности.
- •Билет 3 Физическая и химическая адсорбция. Природа адсорбционных сил. Полярные и неполярные адсорбенты.
- •Дэс по теории Штерна. Сравнительная хар-ка термодинамич и электрокинетич потенциалов.
- •Стабилизир и моющее действие мыл и пав. Гидрофобизация и гидрофолизация поверхности.
- •Конденсационно-кристаллизационные структуры. Структурообразование разбавленных дисперсных систем – гели, студни. Синерезис.
- •Билет 5 Классиф-ция дисп-ых систем по агрегатному состоянию дисперсн фазы и дис-ой среды
- •Билет 6 Термодинамическая неравномерность и агрегатная неустойчивость дисперсных систем. Основные факторы стабилизации.
- •Адсорбция на границе жидкость – газ. Вывод адсорбционной формулы Гиббса. Применение этой формулы для случая, когда адсорбирующееся веществл растворимо в жидкости. Поверхностная активность.
- •Электрокинетический потенциал. Влияние различных факторов на электрокин потенц: индифферентных и неиндифферентных электролитов, разбавления, конц-ия, pH среды и др.
- •Ионообменная адсорбция и ее особенности. Уравнение Никольского. Ионообменная адсорбция в природе и технике.
- •Высокопористые адсорбенты корпускулярной, пористой и губчатой структуры и методы их получения. Пористость. Интегральная и дифференциальная структурные кривые адсорбции.
- •Билет 9 Поверхностное натяжение и электрический потенциал. Механизмы образования дэс. Связь межфазного электрического потенциала с поверхностным натяжением – уравнение Липмана.
- •Газообразные и конденсированные слои на границе: раствор-газ (кривая сжатия пленки нерастворимых пав). Поверхностное давление. Весы Ленгмюра. Определение размеров молекул пав с помощью весов Ленгмюра.
- •Коагуляция коллоидных систем электролитами. Порог коагуляции. Правило Шульца-Гарди. Критическое значение электрокинетического потенциала.
- •Билет 10 Кинетическая и агрегативная устойчивость колл систем. Молекулярные и ионные стабилизаторы. Механизм их действия. Приведите примы стабилизации колл систем.
- •Билет 12 Основы теории устойчивости и коагуляции длфо. Потенциальные кривые взаимодействия частиц. Расклинивающее давление. Электростатическая и молекулярная составляющие
- •Адсорбция на границе жидкость-газ. Поверхностное натяжение растворов. Пав и пиав. Мера поверхностной и адсорбционной активности. Правило Дюкло-Траубе.
- •Дисперсность. Коллоидные системы как “предельно-дисперсные системы”, их роль в создании новых материалов, применяемых в технике.
- •Билет 13 Эффективная вязкость структурированных жидкостей и пластических тел. Зависимость ее от действующего напряжения сдвига.
- •Адсорбция электролитов. Основные закономерности. Влияние радиуса и гидратации ионов на адсорбцию. Лиотропные ряды ионов.
- •Поведение дисперсных систем в постоянном электрическом поле. Электрокинетические явления. Работы Рейса.
- •Билет 15 Теория кинетики быстрой коагуляции Смолуховского. Вывод уравнения для расчетов частиц в золе. Время половинной коагуляции.
- •Адсорбция на границе раздела фаз твердое тело-жидкость. Молекулярная адсорбция из растворов: влияние природы адсорбента, растворенного вещества и растворителя на адсорбцию.
- •Получение коллоидных частиц методом конденсации. Механизм процесса конденсации. Примеры физ и хим конденсации.
- •Билет 18 Основные реологические величины при исследовании упруго-кинетических свойств структурированных частиц.
- •Особенности адсорбции паров на пористых адсорбентах. Капилярная конденсация. Уравнение Томпсона.
- •Пептизация, как метод получения золей. Способы пептизации. Правило осадка.
- •Билет 19 Определение констант уравнения Ленгмюра: их физ смысл. Константа адсорбционно-десорбционного равновесия и её связь с температурой и теплотой адсорбции.
- •Назовите виды устойчивости дисперсных систем в соотвествии с классификацией Пескова. В чем заключается различие между лиофильными и лиофобоными колл системами?
- •Оптические методы исследования коллоидных систем. Ультрамикроскопия. Нефелометрия.
- •Билет 21 Что такое хроматография? Рассмотрите физико-химические принципы хроматографического разделения.
- •Билет 22 Нерастворимые пав. Тип пленок. Анализ кривой сжатия пленки нерастворимых пав.
- •Модели Ньютона и Бингама, ньютоновские и бингамовские жидкости. Физический смысл Ps и Pd.
- •Вязкое течение жидкостей. Уравнение Ньютона и Пуазейля. Причины неподчинения коллоидных растворов этим законам.
- •Классификация дисперсных структурированных систем по Ребиндеру. Дисперсные системы с конденсационно-кристаллической структурой.
- •Билет 28 Термодинамика поверхностных явлений. Общая характеристика поверхностных явлений. Поверхностная энергия в общем уравнении 1-го и 2-го законов термодинамики.
- •Устойчивость дисперсных систем. Потенциальные кривые взаимодействия частиц дисперсной фазы. Потенциальный барьер и его зависимость от толщины диффузного слоя.
- •Что представляют собой явления тиксотропии и реопексии? Чем обусловлены эти явления и для каких структурированных систем они характерны? Приведите примеры таких структурированных дисперсных систем
- •Билет 29 Ультрамикроскопия. Определение концентрации золей и размеров частиц. Поточный ультрамикроскоп.
- •Жидкообразные и твердообразные условно-пластичные структурированные системы: их отличие от ньютоновских жидкостей. Уравнение Ньютона и Пуазейля и их анализ.
- •Капиллярная конденсация паров в пористых адсорбентах. Сорбционно-десорбционный гистерезис. Возможные механизмы этого явления.
Жидкообразные и твердообразные условно-пластичные структурированные системы: их отличие от ньютоновских жидкостей. Уравнение Ньютона и Пуазейля и их анализ.
Все реальные тела принято делить на
жидкообразные (предел текучести равен
0 Pт=0) и твердообразные
(Pт>0). В свою очередь
жидкообразные тела делят на ньютоновские
– вязкость не зависит от напряжения
сдвига и явл постоянной величиной и
неньютоновские – не следуют з-ну Ньютона
их взякость зависит от напряж сдвига.


Если n = 1, то жидкость является ньютоновской и константа k совпадает с ньютоновской вязкостью η. При n < 1 ньютоновская вязкость уменьшается с увеличением скорости сдвига и напряжения. Соответственно этому жидкости называют псевдопластическими. При n > 1 ньютоновская вязкость растет с увеличением скорости сдвига. Соответственно такие жидкости называют дилатантными.
Капиллярная конденсация паров в пористых адсорбентах. Сорбционно-десорбционный гистерезис. Возможные механизмы этого явления.
 P/Ps – отношен
давлен к давлен насыщ пара
P/Ps – отношен
давлен к давлен насыщ пара
Адсорбция на переходнопористых телах происходит в основном по механизму капиллярной конденсации. Капилярная конденсация начинает проявляться при определенном давлении пара. К этому моменту поверхностная энергия адсорбента практически полностью скомпенсирована в результате полимолекулярной адсорбции, а микропоры заполнены адсорбатом. С увеличением давления газа или пара заполняются конденсатом все более крупные поры.
Для адсорбентов с переходными порами характерна изотерма адсорбции с петлей капиллярно-конденсационного гистерезиса. Адсорбция - нижняя кривая, десорбция - верхняя. При малых давлениях, когда не происходит капиллярная конденсация гистерезиса нету. Начало его появления зависит от природы адсорбента и адсорбата. Пористая структура разнообразна. Однако ее можно смоделировать 3 видами пор.
1)конусообразными - конденсация начинается со дна пор, где кривизна наибольшая. По мере заполнения поры радиус мениска увеличивается, поэтому для дальнейшего заполнения нужно увеличивать давление. Процесс десорбции идет в обратном направлении и описывается той же кривой.
2)цилиндрическими с одним открытым концом - конденсация начинается со дна пор, где кривизна сферическая и поэтому наибольшая. Т.к. пора цилиндрическая то она заполняется целиком при определенном радиусе мениска, что отвечает определенному давлению пара. Капиллярная конденсация также происходит обратимо.
3)цилиндрическая с 2 открытыми концами - конденсация начинается со стенок цилиндра, имеющих кривизну в2раза меньше, чем у сферы. Поэтому заполнение идет при большем давлении пара. Конденсация на стенках уменьшает диаметр поры, что приводит к мгновенному заполнению при давлении начала конденсации. На концах поры образуются сферические мениски. Десорбция может начаться только при давлении, соответствующем радиусам кривизны этих менисков. Таким образом ОПОРОЖЕНИЕ капилляра происходит при МЕНЬШЕМ давлении чем его заполнение.
Билет 30 Поверхностный слой. Параметры, величины и формы поверхностного слоя: толщина слоя, удельная поверхность, кривизна поверхности, дисперсность. Поверхностное натяжение как мера энергии Гиббса межфазной поверхности.
Поверхностный слой – переходная область от одной фазы к другой. Свойства поверхности непосредственно связаны с объемной структурой жидких и твердых фаз.
За толщину поверхностного слоя принимают расстояние по обе стороны от границы раздела фаз, за пределами которого свойства слоя перестают отличаться от свойств объемных фаз.
Параметры поверхности: удельная поверхность тела определяется отношением площади его поверхности к объему тела Sуд=S1,2/V
Кривизна поверхности определяется производной площади поверхности по объему: Н=1/2*dS/dV
Кривизна может быть отрицательной и положительной.
Если центр окружности находится внутри
тела, то кривизна поверхности считается
положительной
 ,
тогда
,
тогда
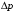 > 0
– выпуклая поверхность, дополнительное
избыточное давление увеличивает
внутреннее давление жидкости (сжимает
ее).
> 0
– выпуклая поверхность, дополнительное
избыточное давление увеличивает
внутреннее давление жидкости (сжимает
ее).
Знак «+» в уравнении Лапласа для выпуклой поверхности:
 .
.
Если центр окружности находится вне
тела (рис. 2.8), то кривизна поверхности
считается отрицательной
 ,
тогда
,
тогда
 <
0 – вогнутая поверхность, дополнительное
избыточное давление уменьшает внутреннее
давление жидкости (растягивает ее).
<
0 – вогнутая поверхность, дополнительное
избыточное давление уменьшает внутреннее
давление жидкости (растягивает ее).
Знак «–» в уравнении Лапласа для вогнутой поверхности:
 .
.
|
|
|
Дисперсность (D) – величина, обратная поперечному размеру частицы: D = l/a.
Удельная поверхность (Sуд) – межфазная поверхность, приходящаяся на единицу объема или массы дисперсной фазы:
 ; или
; или  . (1.1)
. (1.1)
Таким образом, удельная поверхность прямо пропорциональна дисперсности D, и обратно пропорциональна поперечному размеру частицы а.
Поверхностное натяжение(сигма) есть частная производная от внутренней энергии(U) по площади поверхности раздела фаз(S) при постоянных энтропии, объеме, числе молей, заряде.

Поверхностое натяжение есть частная производная от любого термодинамического потенциала по площади межфазной поверхности при постоянных соответсвующих параметрах.

Явление перезарядки коллоидных частиц многовалентными ионами.
Большим адсорбционным потенциалом обладают многозарядные ионы(Аl3+,Th4+),органические ионы. Сильно адсорбирующиеся ионы в плотном слое иногда способны не только полностью скомпенсировать поверхностный потенциал, но и создать избыточный заряд со знаком заряда противоионов. Это явление перезарядки. Перезарядка приводит к смене противоионов в диффузном слое на ионы с зарядом другого знака.Из рисунка видно,что при перезарядке поверхностный потенциал фи0 и потенциал диффузного слоя фи сигма имеют разные знаки.

Ионогенные и неионогенные коллоидные ПАВ. ККМ и методы её определения. Механизм моющего действия ПАВ. Применение коллоидных ПАВ в промышленности.
Ионогенные ПАВ диссоциируют в растворах на ионы. Они делятся на Анионные (диссоциируют в воде с образованием поверхносто - активного аниона). Катионные (диссоциируют в воде с образованием поверхносто - активного катиона). Амфолитные (Содержат 2 функциональные группы, одна имеет кислый, а другая основный харак-ер, напр. карбоксильная и аминная группы. В зависимости от pH среды амфолитные ПАВ обладают анионактивными или катионактивными свойствами).
Неионогенные ПАВ НЕ диссоциируют в растворах на ионы.
ККМ-концентрация выше некоторого определенного значения при котором происходит самопроизвольное мицелообразование и истинный раствор переходит в золь (ультрамикрогетерогенную систему).

Методы опрделения ККМ:
1)Кондуктометрический- применяется чаще для ионогенных ПАВ. Строится зависимость эквивалентной электропроводности от концентрации, наблюдается излом.При этих концентрациях начинают формироваться ионные мицеллы, окруженные слоем противоионов. Изменение удельной электропроводности так же позволяет определить ККМ2 концентрацию, при которой происходит перекрывание электрических слоев мицелл при сохранении их сферической формы.

2)Измерение поверхностного натяжения водных растворов ПАВ, которое уменьшается с ростом концентрации до ККМ, а затем постоянно. (как для ионогенных, так и для неионогенных)

3)График зависимости показателя преломления от концентрации ПАВ –ломанная линия из 2 отрезков, пересекающихся в точке ККМ.(определение в водных и неводных средах)
4)Солюбилизация красителей и УВ в мицеллах позволяет определять ККМ ионогенных и неионогенных ПАВ в водных и нет растворах. При достижении в растворе ПАВ концентрации соответствующей ККМ растворимость УВ и красителей увеличивается.
5)Изменение светорассеяния - резкое увеличение наклона концентрационной кривой.
ПАВ находят широкое применение в различных отраслях промышленности. Введением ПАВ можно вызвать понижение прочности материала при дроблении, увеличить пластичность керамических композиций, бетонных смесей, обеспечить лучшую адгезию, применяют в качестве компонентов лакокрасочных материалов, для получения пены при тушении пожаров, являются основой синтетических моющих средств.
Механизм моющего действия включает несколько стадий:
1)моющее средство снижает поверхностное натяжение раствора, что улучшает смачивание загрязненных предметов и проникновение раствора.
2)Адсорбция ПАВ на частицах загрязнений и на поверхности предмета способствует отрыву частиц и их стабилизации в растворе.
3) Образующаяся пена обеспечивает унос загрязнений.


