
- •Дефильность молекул и их ориентация на межфазной поверхности. Стандартная работа адсорбции. Растворимые пав. Уравнение Шишковского. Правило Дюкло-Траубе. Связь уравнения Гиббса с уравнением Ленгмюра.
- •Билет 2 Белые золи. Определение дисперсности белого золя по оптической плотности.
- •Билет 3 Физическая и химическая адсорбция. Природа адсорбционных сил. Полярные и неполярные адсорбенты.
- •Дэс по теории Штерна. Сравнительная хар-ка термодинамич и электрокинетич потенциалов.
- •Стабилизир и моющее действие мыл и пав. Гидрофобизация и гидрофолизация поверхности.
- •Конденсационно-кристаллизационные структуры. Структурообразование разбавленных дисперсных систем – гели, студни. Синерезис.
- •Билет 5 Классиф-ция дисп-ых систем по агрегатному состоянию дисперсн фазы и дис-ой среды
- •Билет 6 Термодинамическая неравномерность и агрегатная неустойчивость дисперсных систем. Основные факторы стабилизации.
- •Адсорбция на границе жидкость – газ. Вывод адсорбционной формулы Гиббса. Применение этой формулы для случая, когда адсорбирующееся веществл растворимо в жидкости. Поверхностная активность.
- •Электрокинетический потенциал. Влияние различных факторов на электрокин потенц: индифферентных и неиндифферентных электролитов, разбавления, конц-ия, pH среды и др.
- •Ионообменная адсорбция и ее особенности. Уравнение Никольского. Ионообменная адсорбция в природе и технике.
- •Высокопористые адсорбенты корпускулярной, пористой и губчатой структуры и методы их получения. Пористость. Интегральная и дифференциальная структурные кривые адсорбции.
- •Билет 9 Поверхностное натяжение и электрический потенциал. Механизмы образования дэс. Связь межфазного электрического потенциала с поверхностным натяжением – уравнение Липмана.
- •Газообразные и конденсированные слои на границе: раствор-газ (кривая сжатия пленки нерастворимых пав). Поверхностное давление. Весы Ленгмюра. Определение размеров молекул пав с помощью весов Ленгмюра.
- •Коагуляция коллоидных систем электролитами. Порог коагуляции. Правило Шульца-Гарди. Критическое значение электрокинетического потенциала.
- •Билет 10 Кинетическая и агрегативная устойчивость колл систем. Молекулярные и ионные стабилизаторы. Механизм их действия. Приведите примы стабилизации колл систем.
- •Билет 12 Основы теории устойчивости и коагуляции длфо. Потенциальные кривые взаимодействия частиц. Расклинивающее давление. Электростатическая и молекулярная составляющие
- •Адсорбция на границе жидкость-газ. Поверхностное натяжение растворов. Пав и пиав. Мера поверхностной и адсорбционной активности. Правило Дюкло-Траубе.
- •Дисперсность. Коллоидные системы как “предельно-дисперсные системы”, их роль в создании новых материалов, применяемых в технике.
- •Билет 13 Эффективная вязкость структурированных жидкостей и пластических тел. Зависимость ее от действующего напряжения сдвига.
- •Адсорбция электролитов. Основные закономерности. Влияние радиуса и гидратации ионов на адсорбцию. Лиотропные ряды ионов.
- •Поведение дисперсных систем в постоянном электрическом поле. Электрокинетические явления. Работы Рейса.
- •Билет 15 Теория кинетики быстрой коагуляции Смолуховского. Вывод уравнения для расчетов частиц в золе. Время половинной коагуляции.
- •Адсорбция на границе раздела фаз твердое тело-жидкость. Молекулярная адсорбция из растворов: влияние природы адсорбента, растворенного вещества и растворителя на адсорбцию.
- •Получение коллоидных частиц методом конденсации. Механизм процесса конденсации. Примеры физ и хим конденсации.
- •Билет 18 Основные реологические величины при исследовании упруго-кинетических свойств структурированных частиц.
- •Особенности адсорбции паров на пористых адсорбентах. Капилярная конденсация. Уравнение Томпсона.
- •Пептизация, как метод получения золей. Способы пептизации. Правило осадка.
- •Билет 19 Определение констант уравнения Ленгмюра: их физ смысл. Константа адсорбционно-десорбционного равновесия и её связь с температурой и теплотой адсорбции.
- •Назовите виды устойчивости дисперсных систем в соотвествии с классификацией Пескова. В чем заключается различие между лиофильными и лиофобоными колл системами?
- •Оптические методы исследования коллоидных систем. Ультрамикроскопия. Нефелометрия.
- •Билет 21 Что такое хроматография? Рассмотрите физико-химические принципы хроматографического разделения.
- •Билет 22 Нерастворимые пав. Тип пленок. Анализ кривой сжатия пленки нерастворимых пав.
- •Модели Ньютона и Бингама, ньютоновские и бингамовские жидкости. Физический смысл Ps и Pd.
- •Вязкое течение жидкостей. Уравнение Ньютона и Пуазейля. Причины неподчинения коллоидных растворов этим законам.
- •Классификация дисперсных структурированных систем по Ребиндеру. Дисперсные системы с конденсационно-кристаллической структурой.
- •Билет 28 Термодинамика поверхностных явлений. Общая характеристика поверхностных явлений. Поверхностная энергия в общем уравнении 1-го и 2-го законов термодинамики.
- •Устойчивость дисперсных систем. Потенциальные кривые взаимодействия частиц дисперсной фазы. Потенциальный барьер и его зависимость от толщины диффузного слоя.
- •Что представляют собой явления тиксотропии и реопексии? Чем обусловлены эти явления и для каких структурированных систем они характерны? Приведите примеры таких структурированных дисперсных систем
- •Билет 29 Ультрамикроскопия. Определение концентрации золей и размеров частиц. Поточный ультрамикроскоп.
- •Жидкообразные и твердообразные условно-пластичные структурированные системы: их отличие от ньютоновских жидкостей. Уравнение Ньютона и Пуазейля и их анализ.
- •Капиллярная конденсация паров в пористых адсорбентах. Сорбционно-десорбционный гистерезис. Возможные механизмы этого явления.
Дисперсность. Коллоидные системы как “предельно-дисперсные системы”, их роль в создании новых материалов, применяемых в технике.
Дисперсность (D) – мера раздробленности системы, величина, обратная поперечному размеру частицы: D = l/a.
Дисперсными (микрогетерогенными) системами называются системы их двух (или нескольких) фаз, одна из которых состоит и отдельных весьма мелких частиц (дисперсная фаза), распределенных в другой фазе (дисперсионной среде) или растворителе, когда говорят коллоидных растворах.
Дисперсность определяется как отношение суммарной поверхносп раздела дисперсной фазы с дисперсионной средой к суммарному объему этих частиц.
Наночастицы способствуют миниатюризации и образованию микросхем для записи информации, преобразованию измерений, создание принципиально новых материалов в электронике.
Билет 13 Эффективная вязкость структурированных жидкостей и пластических тел. Зависимость ее от действующего напряжения сдвига.
Реологические свойства идеально вязких тел (идеальных жидкостей) подчиняются закону Ньютона и описываются уравнением:
 , (6.1)
, (6.1)
где Р – напряжение сдвига, Па; η –
вязкость жидкости, Па·с;
 – скорость деформации (изменение
деформации во времени) или скорость
течения жидкости.
– скорость деформации (изменение
деформации во времени) или скорость
течения жидкости.
Величина, обратная вязкости
 ,
называется текучестью.
,
называется текучестью.
Для характеристики течения структурированных жидкостей и пластических тел используют эффективную вязкость, которая уменьшается с ростом действующего напряжения сдвига.
При небольших P жидкость имеет неразрушенную структуру и наибольшее значение эффективной вязкости, при более высоких P происходит разрушение структуры что соответствует минимальному значению эфф. Вязкости.

Адсорбция электролитов. Основные закономерности. Влияние радиуса и гидратации ионов на адсорбцию. Лиотропные ряды ионов.
Ионная адсорбция – адсорбция сильных электролитов из водных растворов, обусловленная химическими и электростатическими силами.
Ионы избирательно адсорбируются на поверхностях, состоящих из ионов или полярных молекул.
1. С увеличением заряда иона его адсорбционная способность увеличивается.

2. С увеличением радиуса иона его адсорбционная способность увеличивается.
Ионы одинаковой валентности адсорбируются тем лучше, чем больше их ионный радиус, т.к. с увеличением радиуса уменьшается степень гидратации ионов, наличие гидратной оболочки ослабляет электростатическое взаимодействие ионов, препятствуя адсорбции.
Ионы, расположенные в порядке возрастания адсорбционной способности образуют лиотропные ряды (ряды Гофмейстера).
а) лиотропный ряд гидратированных катионов щелочных металлов:

б) лиотропный ряд двухвалентных катионов:

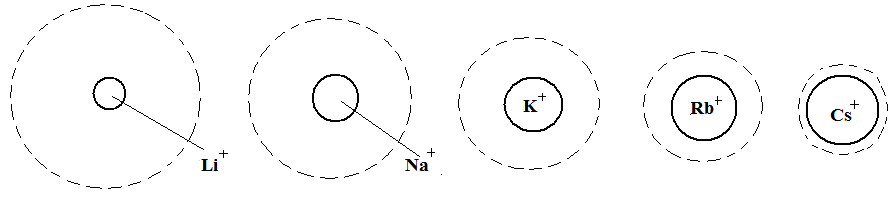
Рис. 3.41. Соотношение между истинными радиусами одновалентных катионов и их радиусами в гидратированном состоянии
3. С увеличением поляризуемости иона его адсорбционная способность увеличивается. Так как поляризуемость анионов всегда больше поляризуемости катионов, то на твердой поверхности преимущественно будут адсорбироваться анионы. Поэтому в природе чаще встречаются отрицательно заряженные поверхности. Лиотропный ряд некоторых анионов:

Это имеет большое значение для стабилизации и коагуляции коллоидных систем электролитами. В природе часто наблюдается избирательная адсорбция калия, бария, никеля, радиоактивных элементов и др.
Вывод формулы Смолуховского для определения электрокинетического потенциала по скорости электрофореза. Неточности, допускаемые при выводе формул.
Электрокинетический потенциал связан с электрофоретической (электроосмотической) подвижностью, уравнением Гельмгольца – Смолуховского:
 , (4.3)
, (4.3)
где ζ – величина электрокинетического
потенциала, В; η – вязкость дисперсионной
среды, Н·с/м2; ε – диэлектрическая
проницаемость среды, для водной среды
равная 81 (безразмерная величина);
 – электрическая константа (диэлектрическая
проницаемость вакуума), равная 8,85·10–12
Ф/м; U – линейная
скорость движения границы золь-боковая
жидкость, м/с; H –
напряженность электрического поля,
В/м.
– электрическая константа (диэлектрическая
проницаемость вакуума), равная 8,85·10–12
Ф/м; U – линейная
скорость движения границы золь-боковая
жидкость, м/с; H –
напряженность электрического поля,
В/м.
Билет 14 Седиментация. Уравнение седиментационного анализа. Принципы построения кривых оседания частиц и кривых распределения массы частиц по размерам. Уравнение Сведберга-Одена.
Седиментация – осаждение частиц под действием силы тяжести.
 . (8.11)
. (8.11)
 – разность между плотностью частицы
дисперсной фазы и плотностью дисперсионной
среды; g – ускорение
свободного падения;
– разность между плотностью частицы
дисперсной фазы и плотностью дисперсионной
среды; g – ускорение
свободного падения;
 – скорость оседания (седиментации)
частицы – скорость движения частицы;
η – вязкость дисперсионной среды; r
– радиус частицы дисперсной фазы
– скорость оседания (седиментации)
частицы – скорость движения частицы;
η – вязкость дисперсионной среды; r
– радиус частицы дисперсной фазы

q – вес частиц
скорость увеличения веса осадка dP/dt в любой заданный момент времени t обусловлена оседанием частиц размером, меньшим ri = r(t)
Полимолекулярная адсорбция. Теория БЭТ. Уравнения изотермы адсорбции. Анализ уравнения и определение константы. Емкость монослоя. Расчет удельной поверхности адсорбента.
Основные положения теории Поляни
1. Адсорбция обусловлена физическими силами (силами Ван-дер-Ваальса). Основной вклад вносят дальнодействующие дисперсионные силы аддитивные и не зависящие от температуры.
2. На поверхности адсорбента нет активных центров (энергетически однородная поверхность).
3. Адсорбционные силы действуют на больших расстояниях, что приводит к образованию полимолекулярного слоя. По мере удаления от поверхности действие адсорбционных сил уменьшается и на некотором расстоянии практически становится равным нулю.
4. Адсорбционные силы не зависят от температуры.
5. Практически все адсорбированное вещество на поверхности адсорбента находится в жидком состоянии
Основные положения теории БЭТ
1. На поверхности адсорбента имеется определенное число равноценных в энергетическом отношении активных центров (поверхность однородна, все активные центры одинаковой силы).
2. Взаимодействие соседних адсорбированных молекул в первом и последующих слоях отсутствуют.
3. Каждая молекула предыдущего слоя представляет собой возможный активный центр для адсорбции молекулы следующего адсорбционного слоя (адсорбция многослойна).
4. Первый слой адсорбата образуется в результате действия сил Ван-дер-Ваальса между адсорбентом и адсорбатом, последующие в результате конденсации.
5. Все молекулы во втором и более далеких слоях ведут себя подобно молекулам жидкости.
6. Возможно построение последующих слоев при незаполненном первом.
Уравнения изотермы адсорбции
 . (3.24)
. (3.24)
уравнение полимолекулярной адсорбции БЭТ:
 , (3.22)
, (3.22)
где
 – емкость одного адсорбционного
монослоя, зависящая от геометрии молекул
и определяемая площадью, которую занимает
одна молекула в насыщенном монослое;
– емкость одного адсорбционного
монослоя, зависящая от геометрии молекул
и определяемая площадью, которую занимает
одна молекула в насыщенном монослое;
 – относительное давление пара (р –
равновесное давление пара, рS
– давление насыщенного пара); С –
константа, характеризующая энергию
взаимодействия в адсорбционном слое:
– относительное давление пара (р –
равновесное давление пара, рS
– давление насыщенного пара); С –
константа, характеризующая энергию
взаимодействия в адсорбционном слое:
 , (3.23)
, (3.23)
где К – константа адсорбционного равновесия в уравнении Лэнгмюра; КL – константа конденсации пара; рS – давление насыщенного пара (константа для каждого вещества)
Определяют емкость адсорбционного монослоя как котангенс угла наклона прямой линии:
 .
.

Экспериментальное определение A∞
позволяет рассчитать удельную поверхность
адсорбента (поверхность единицы массы
адсорбента):
![]() .
.
