
- •Дефильность молекул и их ориентация на межфазной поверхности. Стандартная работа адсорбции. Растворимые пав. Уравнение Шишковского. Правило Дюкло-Траубе. Связь уравнения Гиббса с уравнением Ленгмюра.
- •Билет 2 Белые золи. Определение дисперсности белого золя по оптической плотности.
- •Билет 3 Физическая и химическая адсорбция. Природа адсорбционных сил. Полярные и неполярные адсорбенты.
- •Дэс по теории Штерна. Сравнительная хар-ка термодинамич и электрокинетич потенциалов.
- •Стабилизир и моющее действие мыл и пав. Гидрофобизация и гидрофолизация поверхности.
- •Конденсационно-кристаллизационные структуры. Структурообразование разбавленных дисперсных систем – гели, студни. Синерезис.
- •Билет 5 Классиф-ция дисп-ых систем по агрегатному состоянию дисперсн фазы и дис-ой среды
- •Билет 6 Термодинамическая неравномерность и агрегатная неустойчивость дисперсных систем. Основные факторы стабилизации.
- •Адсорбция на границе жидкость – газ. Вывод адсорбционной формулы Гиббса. Применение этой формулы для случая, когда адсорбирующееся веществл растворимо в жидкости. Поверхностная активность.
- •Электрокинетический потенциал. Влияние различных факторов на электрокин потенц: индифферентных и неиндифферентных электролитов, разбавления, конц-ия, pH среды и др.
- •Ионообменная адсорбция и ее особенности. Уравнение Никольского. Ионообменная адсорбция в природе и технике.
- •Высокопористые адсорбенты корпускулярной, пористой и губчатой структуры и методы их получения. Пористость. Интегральная и дифференциальная структурные кривые адсорбции.
- •Билет 9 Поверхностное натяжение и электрический потенциал. Механизмы образования дэс. Связь межфазного электрического потенциала с поверхностным натяжением – уравнение Липмана.
- •Газообразные и конденсированные слои на границе: раствор-газ (кривая сжатия пленки нерастворимых пав). Поверхностное давление. Весы Ленгмюра. Определение размеров молекул пав с помощью весов Ленгмюра.
- •Коагуляция коллоидных систем электролитами. Порог коагуляции. Правило Шульца-Гарди. Критическое значение электрокинетического потенциала.
- •Билет 10 Кинетическая и агрегативная устойчивость колл систем. Молекулярные и ионные стабилизаторы. Механизм их действия. Приведите примы стабилизации колл систем.
- •Билет 12 Основы теории устойчивости и коагуляции длфо. Потенциальные кривые взаимодействия частиц. Расклинивающее давление. Электростатическая и молекулярная составляющие
- •Адсорбция на границе жидкость-газ. Поверхностное натяжение растворов. Пав и пиав. Мера поверхностной и адсорбционной активности. Правило Дюкло-Траубе.
- •Дисперсность. Коллоидные системы как “предельно-дисперсные системы”, их роль в создании новых материалов, применяемых в технике.
- •Билет 13 Эффективная вязкость структурированных жидкостей и пластических тел. Зависимость ее от действующего напряжения сдвига.
- •Адсорбция электролитов. Основные закономерности. Влияние радиуса и гидратации ионов на адсорбцию. Лиотропные ряды ионов.
- •Поведение дисперсных систем в постоянном электрическом поле. Электрокинетические явления. Работы Рейса.
- •Билет 15 Теория кинетики быстрой коагуляции Смолуховского. Вывод уравнения для расчетов частиц в золе. Время половинной коагуляции.
- •Адсорбция на границе раздела фаз твердое тело-жидкость. Молекулярная адсорбция из растворов: влияние природы адсорбента, растворенного вещества и растворителя на адсорбцию.
- •Получение коллоидных частиц методом конденсации. Механизм процесса конденсации. Примеры физ и хим конденсации.
- •Билет 18 Основные реологические величины при исследовании упруго-кинетических свойств структурированных частиц.
- •Особенности адсорбции паров на пористых адсорбентах. Капилярная конденсация. Уравнение Томпсона.
- •Пептизация, как метод получения золей. Способы пептизации. Правило осадка.
- •Билет 19 Определение констант уравнения Ленгмюра: их физ смысл. Константа адсорбционно-десорбционного равновесия и её связь с температурой и теплотой адсорбции.
- •Назовите виды устойчивости дисперсных систем в соотвествии с классификацией Пескова. В чем заключается различие между лиофильными и лиофобоными колл системами?
- •Оптические методы исследования коллоидных систем. Ультрамикроскопия. Нефелометрия.
- •Билет 21 Что такое хроматография? Рассмотрите физико-химические принципы хроматографического разделения.
- •Билет 22 Нерастворимые пав. Тип пленок. Анализ кривой сжатия пленки нерастворимых пав.
- •Модели Ньютона и Бингама, ньютоновские и бингамовские жидкости. Физический смысл Ps и Pd.
- •Вязкое течение жидкостей. Уравнение Ньютона и Пуазейля. Причины неподчинения коллоидных растворов этим законам.
- •Классификация дисперсных структурированных систем по Ребиндеру. Дисперсные системы с конденсационно-кристаллической структурой.
- •Билет 28 Термодинамика поверхностных явлений. Общая характеристика поверхностных явлений. Поверхностная энергия в общем уравнении 1-го и 2-го законов термодинамики.
- •Устойчивость дисперсных систем. Потенциальные кривые взаимодействия частиц дисперсной фазы. Потенциальный барьер и его зависимость от толщины диффузного слоя.
- •Что представляют собой явления тиксотропии и реопексии? Чем обусловлены эти явления и для каких структурированных систем они характерны? Приведите примеры таких структурированных дисперсных систем
- •Билет 29 Ультрамикроскопия. Определение концентрации золей и размеров частиц. Поточный ультрамикроскоп.
- •Жидкообразные и твердообразные условно-пластичные структурированные системы: их отличие от ньютоновских жидкостей. Уравнение Ньютона и Пуазейля и их анализ.
- •Капиллярная конденсация паров в пористых адсорбентах. Сорбционно-десорбционный гистерезис. Возможные механизмы этого явления.
Классификация дисперсных структурированных систем по Ребиндеру. Дисперсные системы с конденсационно-кристаллической структурой.
По классификации П. А. Ребиндера гели делят на: I) коагуляционные структуры и 2) конденсационно-кристаллизационные структуры. Коагуляционные структуры характеризуются небольшой прочностью. Между частицами дисперсной фазы в этих системах обычно сохраняются прослойки дисперсионной среды, благодаря чему проявляется некоторая пластичность или даже эластичность. Чем тоньше прослойки среды, тем больше механическая прочность структуры, но и больше ее хрупкость. Специфическим свойством коагуляционных структур является их способность к тиксотропным превращениям, т. е. к изотермическому переходу гель < золь. Из других свойств гелей следует отметить способность к ползучести — медленному течению без заметного разрушения пространственной структуры — и синерезису — постепенному уплотнению структуры геля, сопровождающемуся выделением дисперсионной среды из петель сетки.
Конденсационно-кристаллизационные структуры (хрупкие гели) образуются за счет химических связей между частицами либо путем сращивания кристалликов твердой фазы. Таким образом, между частицами дисперсной фазы возникают непосредственные фазовые контакты. Эти структуры жестки и хрупки; они не способны к набуханию и в них не происходит синерезис. Прочность таких структур выше, чем коагуляционных, однако после механического разрушения химические и кристаллизационные связи не восстанавливаются самопроизвольно. Вследствие этого в таких системах отсутствуют тиксотропные свойства, а также эластичность и пластичность. Типичным представителем конденсационных структур является гель кремниевой кислоты. Кристаллизационные структуры образуются при твердении минеральных вяжущих материалов: цементов, гипса, извести.
Билет 28 Термодинамика поверхностных явлений. Общая характеристика поверхностных явлений. Поверхностная энергия в общем уравнении 1-го и 2-го законов термодинамики.
В дисперсных системах большая часть всех молекул или атомов, составляющих вещество, находится на поверхности раздела фаз. Эти поверхностные молекулы отличаются от молекул, находящихся внутри фазы по своему энергетическому состоянию, что приводит к возникновению избыточной поверхностной энергии. Избыточная поверхностная энергия равна произведению поверхностного натяжения на площадь межфазной поверхности:
 .
.
Любая термодинамическая система стремиться уменьшить свою поверхностную энергию. Избыточная поверхностная энергия может уменьшиться за счет:
-
уменьшения поверхностного натяжения: адсорбция, адгезия, смачивание, образование двойного электрического слоя;
-
уменьшения площади поверхности: сферическая форма капель (сглаживание поверхности), объединение частиц (коагуляция, агрегация, коалесценция).
Причина поверхностных явлений – это разное энергетическое состояние частиц на поверхности и в объеме фазы. Силы, действующие на молекулы, находящиеся внутри жидкости, одинаковы со всех сторон, и равнодействующая этих сил Fм равна нулю. Силы, действующие на молекулы поверхностного слоя со стороны жидкости и газа неодинаковы. Равнодействующая молекулярных сил Fм не равна нулю и направлена вглубь жидкости (см. рис.29.1).
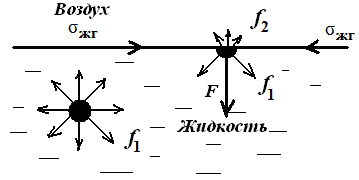
Рис.29.1. Межмолекулярные силы, действующие на частицу на поверхности и внутри фазы.
Частицы на поверхности обладают избыточной энергией по сравнению с частицами внутри фазы. Общую свободную энергию G системы с развитой поверхностью раздела фаз (дисперсной системы) можно разделить на энергию Гиббса объемной фазы и поверхностную энергию Гиббса:
G=Gv+Gs
Энергия Гиббса объемной фазы пропорциональна ее массе, а, следовательно, объему:
Gv=kV
Все поверхности раздела в зависимости от агрегатного состояния граничных фаз делят: 1) подвижные поверхности раздела: жидкость – газ, жидкость – жидкость; 2) неподвижные поверхности раздела: твердое тело – газ, твердое тело – жидкость.
Рассмотрим классификацию поверхностных явлений в соответствии с объединенным уравнением первого и второго начал термодинамики для поверхностного слоя относительно изменения энергии Гиббса:
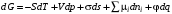 ,
(2.1)
,
(2.1)
где Т – температура; S
– энтропия; р – давление; V
– объем; s – площадь
поверхности;
 – поверхностное натяжение;
– поверхностное натяжение;
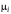 – химический потенциал i-го
компонента; ni
– число моль i-го
компонента;
– химический потенциал i-го
компонента; ni
– число моль i-го
компонента;
 – электрический потенциал; q
– количество электричества.
– электрический потенциал; q
– количество электричества.
