
- •Дефильность молекул и их ориентация на межфазной поверхности. Стандартная работа адсорбции. Растворимые пав. Уравнение Шишковского. Правило Дюкло-Траубе. Связь уравнения Гиббса с уравнением Ленгмюра.
- •Билет 2 Белые золи. Определение дисперсности белого золя по оптической плотности.
- •Билет 3 Физическая и химическая адсорбция. Природа адсорбционных сил. Полярные и неполярные адсорбенты.
- •Дэс по теории Штерна. Сравнительная хар-ка термодинамич и электрокинетич потенциалов.
- •Стабилизир и моющее действие мыл и пав. Гидрофобизация и гидрофолизация поверхности.
- •Конденсационно-кристаллизационные структуры. Структурообразование разбавленных дисперсных систем – гели, студни. Синерезис.
- •Билет 5 Классиф-ция дисп-ых систем по агрегатному состоянию дисперсн фазы и дис-ой среды
- •Билет 6 Термодинамическая неравномерность и агрегатная неустойчивость дисперсных систем. Основные факторы стабилизации.
- •Адсорбция на границе жидкость – газ. Вывод адсорбционной формулы Гиббса. Применение этой формулы для случая, когда адсорбирующееся веществл растворимо в жидкости. Поверхностная активность.
- •Электрокинетический потенциал. Влияние различных факторов на электрокин потенц: индифферентных и неиндифферентных электролитов, разбавления, конц-ия, pH среды и др.
- •Ионообменная адсорбция и ее особенности. Уравнение Никольского. Ионообменная адсорбция в природе и технике.
- •Высокопористые адсорбенты корпускулярной, пористой и губчатой структуры и методы их получения. Пористость. Интегральная и дифференциальная структурные кривые адсорбции.
- •Билет 9 Поверхностное натяжение и электрический потенциал. Механизмы образования дэс. Связь межфазного электрического потенциала с поверхностным натяжением – уравнение Липмана.
- •Газообразные и конденсированные слои на границе: раствор-газ (кривая сжатия пленки нерастворимых пав). Поверхностное давление. Весы Ленгмюра. Определение размеров молекул пав с помощью весов Ленгмюра.
- •Коагуляция коллоидных систем электролитами. Порог коагуляции. Правило Шульца-Гарди. Критическое значение электрокинетического потенциала.
- •Билет 10 Кинетическая и агрегативная устойчивость колл систем. Молекулярные и ионные стабилизаторы. Механизм их действия. Приведите примы стабилизации колл систем.
- •Билет 12 Основы теории устойчивости и коагуляции длфо. Потенциальные кривые взаимодействия частиц. Расклинивающее давление. Электростатическая и молекулярная составляющие
- •Адсорбция на границе жидкость-газ. Поверхностное натяжение растворов. Пав и пиав. Мера поверхностной и адсорбционной активности. Правило Дюкло-Траубе.
- •Дисперсность. Коллоидные системы как “предельно-дисперсные системы”, их роль в создании новых материалов, применяемых в технике.
- •Билет 13 Эффективная вязкость структурированных жидкостей и пластических тел. Зависимость ее от действующего напряжения сдвига.
- •Адсорбция электролитов. Основные закономерности. Влияние радиуса и гидратации ионов на адсорбцию. Лиотропные ряды ионов.
- •Поведение дисперсных систем в постоянном электрическом поле. Электрокинетические явления. Работы Рейса.
- •Билет 15 Теория кинетики быстрой коагуляции Смолуховского. Вывод уравнения для расчетов частиц в золе. Время половинной коагуляции.
- •Адсорбция на границе раздела фаз твердое тело-жидкость. Молекулярная адсорбция из растворов: влияние природы адсорбента, растворенного вещества и растворителя на адсорбцию.
- •Получение коллоидных частиц методом конденсации. Механизм процесса конденсации. Примеры физ и хим конденсации.
- •Билет 18 Основные реологические величины при исследовании упруго-кинетических свойств структурированных частиц.
- •Особенности адсорбции паров на пористых адсорбентах. Капилярная конденсация. Уравнение Томпсона.
- •Пептизация, как метод получения золей. Способы пептизации. Правило осадка.
- •Билет 19 Определение констант уравнения Ленгмюра: их физ смысл. Константа адсорбционно-десорбционного равновесия и её связь с температурой и теплотой адсорбции.
- •Назовите виды устойчивости дисперсных систем в соотвествии с классификацией Пескова. В чем заключается различие между лиофильными и лиофобоными колл системами?
- •Оптические методы исследования коллоидных систем. Ультрамикроскопия. Нефелометрия.
- •Билет 21 Что такое хроматография? Рассмотрите физико-химические принципы хроматографического разделения.
- •Билет 22 Нерастворимые пав. Тип пленок. Анализ кривой сжатия пленки нерастворимых пав.
- •Модели Ньютона и Бингама, ньютоновские и бингамовские жидкости. Физический смысл Ps и Pd.
- •Вязкое течение жидкостей. Уравнение Ньютона и Пуазейля. Причины неподчинения коллоидных растворов этим законам.
- •Классификация дисперсных структурированных систем по Ребиндеру. Дисперсные системы с конденсационно-кристаллической структурой.
- •Билет 28 Термодинамика поверхностных явлений. Общая характеристика поверхностных явлений. Поверхностная энергия в общем уравнении 1-го и 2-го законов термодинамики.
- •Устойчивость дисперсных систем. Потенциальные кривые взаимодействия частиц дисперсной фазы. Потенциальный барьер и его зависимость от толщины диффузного слоя.
- •Что представляют собой явления тиксотропии и реопексии? Чем обусловлены эти явления и для каких структурированных систем они характерны? Приведите примеры таких структурированных дисперсных систем
- •Билет 29 Ультрамикроскопия. Определение концентрации золей и размеров частиц. Поточный ультрамикроскоп.
- •Жидкообразные и твердообразные условно-пластичные структурированные системы: их отличие от ньютоновских жидкостей. Уравнение Ньютона и Пуазейля и их анализ.
- •Капиллярная конденсация паров в пористых адсорбентах. Сорбционно-десорбционный гистерезис. Возможные механизмы этого явления.
Билет 1 Кинетика коагуляции. Основные положения теории Смолуховского быстрой коагуляции. Кривые кинетики коагуляции.
Коагуляция – слипание частиц дисперсной фазы.
Скорость коагуляции – изменение частичной концентрации дисперсных частиц в единице объема в единицу времени.
Скорость коагуляции может быть самой разной в различных системах (от нескольких секунд до нескольких лет). Система тем более устойчива, чем медленнее она коагулирует.
Различают: быструю коагуляцию, при которой каждое столкновение частиц приводит к их слипанию (все соударения эффективны); и медленную коагуляцию, когда не все столкновения частиц являются эффективными.
Основные положения теории быстрой коагуляции Смолуховского:
• частицы дисперсной фазы сближаются в результате броуновского движения, слипаются, образуют агрегат, который совершает дальнейшее броуновское движение как единое целое;
• скорость сближения частиц определяется коэффициентом диффузии и средним расстоянием между частицами;
• в каждом элементарном акте участвуют только две частицы дисперсной фазы;
• все частицы имеют одинаковый размер и обладают одинаковой подвижностью, форму частиц считают сферической.
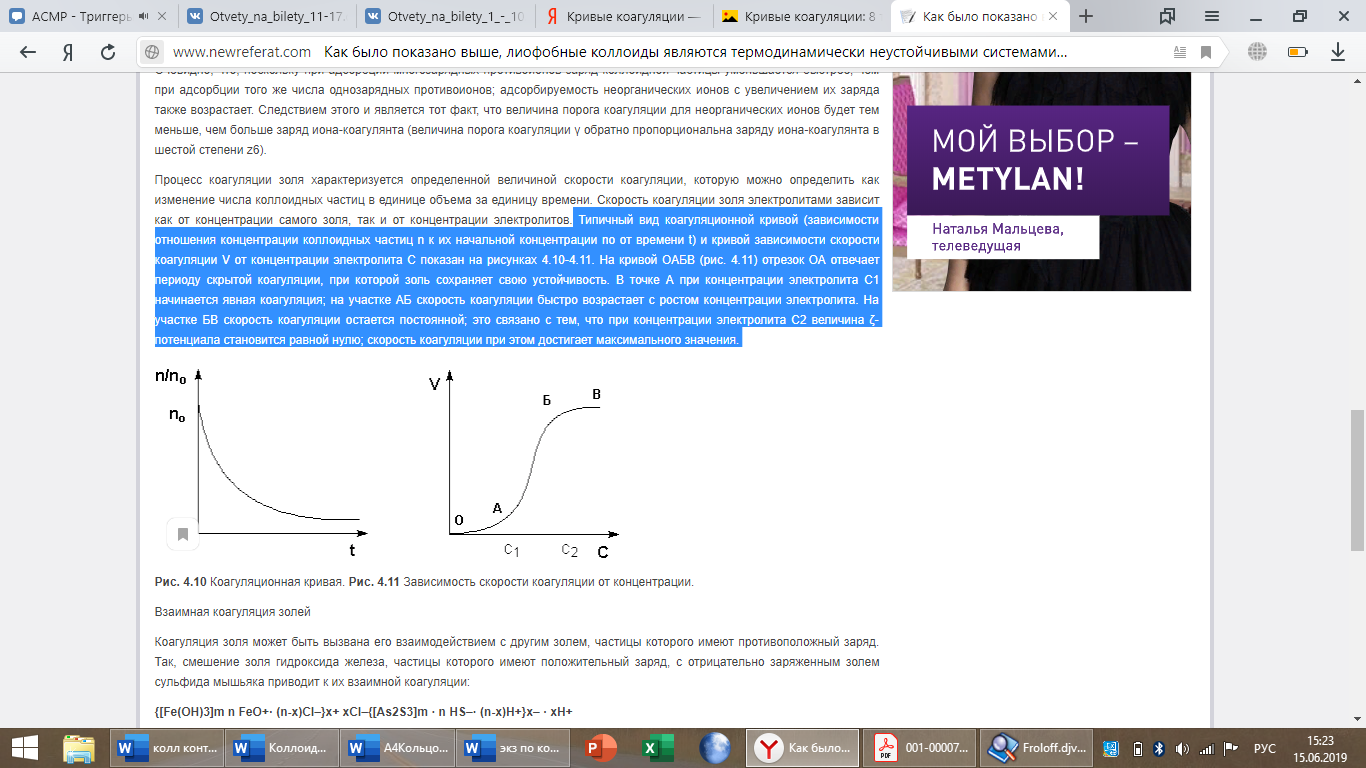
Типичный вид коагуляционной кривой (зависимости отношения концентрации коллоидных частиц n к их начальной концентрации nо от времени t) и кривой зависимости скорости коагуляции V от концентрации электролита С показан на рисунках 4.10-4.11. На кривой ОАБВ (рис. 4.11) отрезок ОА отвечает периоду скрытой коагуляции, при которой золь сохраняет свою устойчивость. В точке А при концентрации электролита С1 начинается явная коагуляция; на участке АБ скорость коагуляции быстро возрастает с ростом концентрации электролита. На участке БВ скорость коагуляции остается постоянной; это связано с тем, что при концентрации электролита С2 величина ζ-потенциала становится равной нулю; скорость коагуляции при этом достигает максимального значения.
Дефильность молекул и их ориентация на межфазной поверхности. Стандартная работа адсорбции. Растворимые пав. Уравнение Шишковского. Правило Дюкло-Траубе. Связь уравнения Гиббса с уравнением Ленгмюра.
Молекулы ПАВ имеют дифильное строение, т.е. состоят из гидрофильной (полярная группа) и гидрофобной (углеводородная цепь, радикал) группировок. В качестве полярных групп могут выступать: –OH, –COOH, –CNS, –NH2, –NO
Гидрофильная часть молекул, обладающая сродством к полярным молекулам воды, взаимодействует с водой и находится в водной фазе, а неполярная гидрофобная часть выталкивается в неполярную фазу (воздух).
При малых концентрациях ПАВ в поверхностном слое тепловое движение нарушает пространственную ориентацию молекул и молекулы в основном расположены в поверхностном слое горизонтально, при этом полярные группы остаются в воде, а углеводородные цепи лежат на ее поверхности (псевдогазовые пленки).
![]()
Рис. 3.21. Псевдогазовые пленки
При повышении концентрации ПАВ усиливается взаимодействие углеводородных цепей между собой, их углеводородные радикалы отрываются от поверхности воды, образуя крупные конденсированные кластеры «острова», в которых тепловое движение сильно затруднено (псевдожидкие пленки).
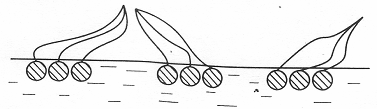
Рис. 3.22. Псевдожидкие пленки
При насыщении адсорбционного слоя (Г∞) образуется «молекулярный частокол Ленгмюра» из вертикально расположенных молекул. В этом состоянии площадь, занимаемая молекулой, определяется лишь площадью полярной группы, постоянной для всех членной гомологического ряда.

Рис. 3.23. Молекулярный частокол
Работа адсорбции ( )
– работа перемещения 1 моль ПАВ из объема
раствора в поверхностный слой при
Т = const:
)
– работа перемещения 1 моль ПАВ из объема
раствора в поверхностный слой при
Т = const:

 ,
,
где
 – свободная поверхностная энергия; К
– константа адсорбционного равновесия.
– свободная поверхностная энергия; К
– константа адсорбционного равновесия.
К растворимым ПАВ относится большой класс растворимых в воде дифильных органических соединений с небольшим углеводородным радикалом, например низшие спирты, фенолы, кислоты и их соли, амины. Вещества этого типа в растворе находятся в молекулярно-дисперсном состоянии вплоть до концентраций, соответствующих их насыщенным растворам и разделению системы на две сплошные фазы.
зависимость уменьшения поверхностного натяжения с увеличением концентрации ПАВ описывается эмпирическим уравнением Шишковского:
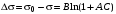 ,(3.31)
,(3.31)
где
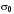 – поверхностное натяжение чистого
растворителя;
– поверхностное натяжение чистого
растворителя;
 – поверхностное натяжение раствора
ПАВ; В – константа для всего
гомологического ряда ПАВ; А –
константа для конкретного ПАВ.
– поверхностное натяжение раствора
ПАВ; В – константа для всего
гомологического ряда ПАВ; А –
константа для конкретного ПАВ.
Высокая поверхностная активность коллоидных ПАВ зависит, главным образом, от длины УВ радикала. Увеличение длины радикала на одну группу СН2 приводит к возрастанию поверхностной активности приблизительно в 3-3,5 раза (правило Дюклю—Траубе). Это правило соблюдается в основном для истинно растворимых ПАВ.
Связь уравнения Гиббса с уравнением Ленгмюра.
Уравнение Шишковского в дифференциальной форме имеет вид:
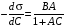 . (3.32)
. (3.32)
Величина гиббсовской адсорбции (Г) связана с константами в уравнении Шишковского:
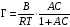 . (3.33)
. (3.33)
С другой стороны величина адсорбция ПАВ в поверхностном слое связана с его концентрацией уравнением Лэнгмюра:
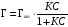 , (3.34)
, (3.34)
где Г∞ – предельная адсорбция; С – концентрация адсорбата (ПАВ); К – константа адсорбционного равновесия.
Отсюда константы в уравнении Шишковского А и В приобретают определенный физический смысл:
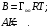 (3.35)
(3.35)
Естественные и искусственные адсорбенты для адсорбции из растворов. Катиониты и аниониты. Регенерация.
Адсорбент – тело на поверхности, которого происходит адсорбция.
Естественные: цеолиты (алюмосиликаты, молекулярные сита) апатиты, гумусовые в-ва
Искусственные: ионообменные смолы, гели гидроксидов Al, Fe, пермутиты (искусственные цеолиты)
Катиониты – дисп системы, состоящие из отриц заряж частиц или макромолекул, окруженных диффузным слоем образованным катионами, способными к обмену (обменивают катион)
Аниониты – дисп системы состоящие из положит заряжен частиц или макромолекул окруженным диффузным слоем образованным анионами способными к обмену.
Регенерация адсорбента – процесс восстановл-я исх состоян адсорбента, как правило сопровождается десорбцией.
