
- •Гетерогенность и дисперсность
- •Классификация по размерам частиц дисперсной фазы
- •Поверхностное натяжение
- •Метод избыточных величин Гиббса. Вывод уравнения для свободной энергии системы.
- •Уравнение Гиббса для плоского поверхностного слоя
- •Понятие об адсорбции. Причины адсорбции. Количественные характеристики адсорбции.
- •Вывод адсорбционного уравнения Гиббса для разбавленных растворов и его анализ.
- •Поверхностная активность по Ребиндеру. Графическое определение поверхностной активности.
- •Влияние пав на адсорбцию. Правило Траубе, аналитическое выражение и физическое обоснование
- •Диаграммы состояния поверхностных пленок.
- •Уравнение состояния двумерного газа. Уравнение Фрумкина для реального газа.
- •Классификация пав по химическому строению
- •Мицеллообразование. Строение мицелл.
- •Ккм. Определение ккм. Влияние различных факторов на ккм.
- •Влияние температуры на растворимость ионогенных пав. Диаграмма состояния системы. Точка крафта.
- •Влияние температуры на растворимость неионогенных пав. Диаграмма состояния системы. Точка помутнения и точка высаливания.
- •Теория мономолекулярной адсорбции Ленгмюра. Анализ уравнения Ленгмюра
- •Линейная форма уравнения Ленгмюра. Нахождение константы уравнения графическим методом. Определение удельной поверхности адсорбента.
- •Адсорбция как обратимый экзотермический процесс. Интегральная и дифференциальная теплота адсорбции. Изобара адсорбции.
- •Сравнительная характеристика физической адсорбции и хемосорбции.
- •Природа адсорбционных сил. Уравнение Леннард-Джонса.
- •Смачивание. Краевой угол и теплота смачивания. Уравнение Юнга. Влияние пав на смачивание.
- •Когезия и адгезия. Характер разрушения адгезионного соединения. Условие разрушения адгезионного соединения. Уравнение Дюпре для работы адгезии.
- •Методы диспергирования. Уравнение Ребиндера для работы измельчения
- •Эффект Ребиндера и его роль в диспергировании.
- •Конденсационное образование лиофобных дисперсных систем. Уравнение для радиуса и работы образования критического зародыша
- •Химические и физические методы создания метастабильности в системе. Зависимость размера частиц от различных факторов
- •Гетерогенная конденсация
- •Принцип построения мицелл ионостабилизированных золей. Пример
- •Пептизация
- •Получение лиофильных коллоидных систем
-
Понятие об адсорбции. Причины адсорбции. Количественные характеристики адсорбции.
Адсорбцию
можно определить как процесс выравнивания
химических потенциалов компонентов
между поверхностью и объемом, приводящий
к изменению концентрации на поверхности.
Межфазный слой обогащается тем
компонентом, который характеризуется
меньшей работой извлечения из объема
и снижает поверхностное натяжение. Это
приводит к убыли свободной поверхностной
энергии (движущая сила процесса адсорбции)
 .
В отличие от других процессов адсорбция
идет не в сторону выравнивания
концентраций, а в сторону их расхождения.
Происходит накачка поверхностного слоя
компонентом, снижающим поверхностное
натяжение. Адсорбентом
является жидкость. Адсорбтивом
является
растворенное вещество.
.
В отличие от других процессов адсорбция
идет не в сторону выравнивания
концентраций, а в сторону их расхождения.
Происходит накачка поверхностного слоя
компонентом, снижающим поверхностное
натяжение. Адсорбентом
является жидкость. Адсорбтивом
является
растворенное вещество.
Поверхность
жидкости энергетически однородна, на
ней отсутствуют активные центры, поэтому
адсорбция физическая и всегда
нелокализована. Путь понижения свободной
поверхностной энергии - перераспределение
молекул в растворе, приводящее к изменению
состава поверхностного слоя.
 .
Изменение состава поверхностного слоя
влияет, на поверхностное натяжение ,
которое связано с величиной адсорбции.
.
Изменение состава поверхностного слоя
влияет, на поверхностное натяжение ,
которое связано с величиной адсорбции.
Избыточная концентрация i-го компонента, рассчитанная на единицу площади разделяющей поверхности, называется гиббсовой адсорбцией. Гиббсова, или абсолютная адсорбция, является удельной величиной, применяемой для описания состава поверхностного слоя независимо от его площади.
 ,
моль/м2
,
моль/м2
Поверхностная концентрация адсорбата , равная общей концентрации вещества в поверхностном слое рассчитанной на единицу площади поверхности. При малых концентрациях адсорбата Гi и совпадают, при больших - различаются.
Поверхность адсорбента неизвестна, величину адсорбции измеряют емкостью поверхностного слоя a и выражают в моль/кг.

-
Вывод адсорбционного уравнения Гиббса для разбавленных растворов и его анализ.
Запишем
фундаментальное уравнение Гиббса для
поверхностного слоя. .
.
Введем полную (внутреннюю) энергию поверхностного слоя.




По теореме Эйлера его можно интегрировать. После интегрирования это уравнение принимает вид

Постоянная интегрирования равна нулю с=0. Рассмотрим любые возможные изменения системы, т.е. возьмем полный дифференциал от выражения.

Термодинамические функции не зависят от пути процесса, dUs – полный дифференциал.

Это общий вид адсорбционного уравнения Гиббса. Введем некоторые ограничения. При Tconst уравнение Гиббса принимает вид:

Все экстенсивные параметры поверхности зависят от площади поверхности и, поэтому их удобно относить к единице площади.


Для бинарной системы:

Где индекс 1 относится к растворителю, 2 – к растворенному веществу. Изменение связано с адсорбцией и с изменением концентрации растворителя и растворенного вещества. Это уравнение содержит два неизвестных, Г1 Г2 и поэтому однозначное его решение отсутствует.
Пусть
Г1
=
0, тогда



-
Поверхностная активность по Ребиндеру. Графическое определение поверхностной активности.
Поверхностная активность не является абсолютным свойством веществ, а зависит от природы поверхности раздела фаз
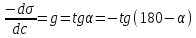
Поверхностная активность является динамическим явлением, так как конечное состояние поверхности или межфазного слоя определяется равновесием между адсорбцией и полным смешением вследствие теплового движения молекул.

