
- •4.1. Введение
- •4.2. Растворы электролитов
- •4.4. Процессы переноса в электрохимических системах
- •4.5. Предмет электрохимии
- •4.6. Электрохимическое равновесие
- •4.7. Стандартный электродный потенциал. Водородный электрод
- •4.8. Электрохимическая кинетика
- •4.9. Библиографический список
- •4.10. Предметный указатель
Электрохимия
4.7. Стандартный электродный потенциал. Водородный электрод
Стандартный электродный потенциал это потенциал обратимого электрода, при отношение окисленной и восстановленной форм под логарифмом равно единице. Он представляет собой величину, характерную для данного электродного процесса и зависит от температуры и природы растворителя.
Абсолютную величину потенциала каждого отдельного электрода невозможно. Поэтому, принимают потенциал какого-либо электрода равным нулю и относят к нему значения потенциалов всех других электродов. При этом потенциалы электродов выражаются в некоторой условной шкале, и их величины зависят от природы электрода, выбранного за основу шкалы. Нернст предложил считать таким условным нулем
(eH0 2 ,H+ =0), при любой температуре, активности водо-
родных ионов в растворе, равной единице, и давлении газообразного водорода, равном 1 атм. Эта условная шкала потенциалов называется водородной шкалой. Значения некоторых электродов по водородной шкале приведены в приложении (Табл. 4.1). Водородный электрод используются в качестве стандартного.
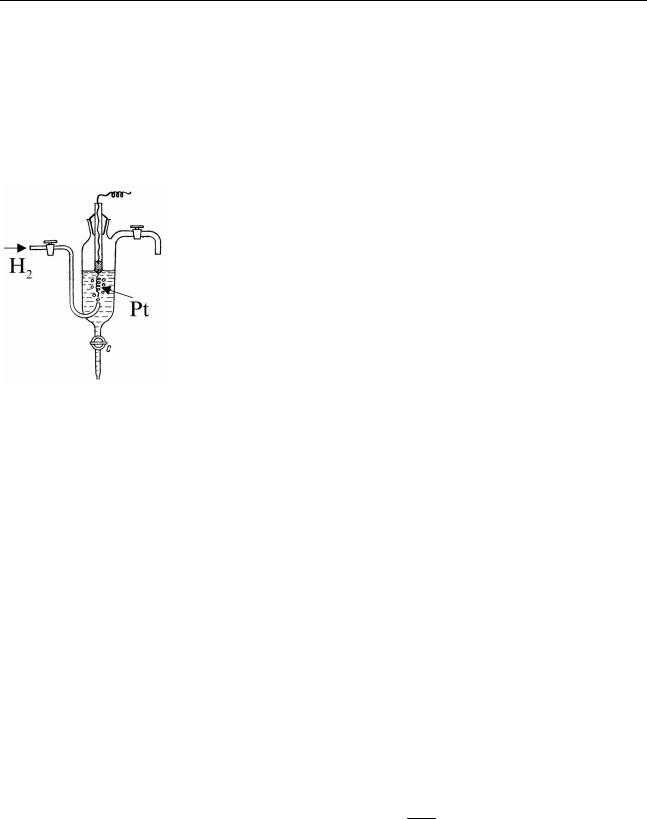
На рис. 4.5 схематически изображена конструкция водородного электрода. Электродная реакция и запись полуэлемента имеют вид:
H2 −2e =2H+ |
Pt,(H2 / H+ ), |
а его потенциал определяется уравнением:
eH2 ,H+ = eH0 2 ,H+ + RTF ln apH+ , H2
При pH2 =1 и температуре 298 K потенциал электрода связан с pH раствора соотношением:
eH ,H+ = −0,0591pH |
(4.38) |
2 |
|
34 |
|
Электрохимия
4.1.1.Классификация электродов
Воснову классификации электродов положены свойства веществ, участ-
вующие в потенциал–определяющих процессах. Принято различать электроды
первого рода, второго рода, газовые, окислительно-восстановительные и др.
Расчет равновесных электродных потенциалов, для электродов всех описанных типов выполняется по уравнению Нернста (4.36). Значение электродного потенциала зависит от степени окисления потенциал определяющих ионов. Активность чистых металлов, металлоидов и газов принимается равной единице, поэтому расчетах потенциалов электродов первого и второго рода, либо знаменатель, либо числитель подлогарифмического выражения aокисл. / aвосст. равен единице например:
ln |
a |
3+ |
=ln |
a |
3+ |
; ln |
pCl |
=ln |
1 |
|
; |
ln |
|
aAgCl |
|
=ln |
1 |
|
и т. д., |
|||
Cr |
|
|
Cr |
|
|
2 |
|
|
|
|
|
|
|
|
||||||||
a |
|
|
1 |
|
a |
|
a |
|
a |
|
0 a |
|
a |
|
||||||||
|
|
0 |
|
|
|
− |
|
− |
|
Ag |
− |
− |
||||||||||
|
Cr |
|
|
|
|
|
Cl |
|
|
Cl |
|
|
|
|
Cl |
|
|
Cl |
|
|
||
а у окислительно–восстановительных (редокси) – электродов ln aокисл. =ln aFe3+ .
aвосст. aFe2+
Электроды первого рода – это электроды, в которых твердой фазой является металл или металлоид. Потенциал электрода первого рода зависит от активности лишь одного определенного сорта ионов. В случае металлических электродов первого рода такими ионами будут катионы металла, а в случае металлоидных — анионы металлоида (и электроды называют, соответственно
обратимыми относительно катиона или аниона). Расчет равновесных элек-
тродных потенциалов выполняется по уравнению Нернста (4.36). а) обратимого относительно катиона
eGr3+,Cr2+ =eGr0 3+,Cr2+ + RT3F ln aaGr3+ =eGr0 3+,Cr2+ + RT3F ln aGr13+ Gr0
б) обратимого относительно аниона
e 0 |
|
− =e0 0 |
|
− + |
RT |
ln |
aCl0,5 |
=e0 0 |
|
− + |
RT |
ln |
1 |
|
|
|
|
1 F |
|
2 |
|
1 F |
|
|
|||||||
|
|
a |
|
|
a |
|
|||||||||
Cl |
,Cl |
Cl |
,Cl |
|
|
− |
Cl |
,Cl |
|
|
− |
||||
|
|
|
|
|
|
|
Cl |
|
|
|
|
|
|
Cl |
|
(4.39)
(4.40)
35

Электрохимия
Металлические электроды первого рода имеют большое практическое значение и они легче реализуются, чем металлоидные. В последнем случае для измерения величины потенциала в систему металлоид—ионы металлоида приходится, как правило, вводить металлический проводник из индифферентного металла.
Газовые электроды, выделены в особую группу электродов, которые представляет собой полуэлемент, состоящие из металлического проводника (обычно платинового), контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Газовый электрод невозможен без участия металлического проводника, так же как любой электрод немыслим без проводника с электронной проводимостью. Потенциал металла в газовом электроде не должен зависеть от активности других ионов, присутствующих в растворе, в частности, от активности собственных металлических ионов. Металл газового электрода должен быть инертным по отношению к другим возможным реакциям и поэтому чаще всего используют платину или углерод. Газовые электроды очень чувствительны к изменению состояния поверхности платины, в частности, к отравлению ее каталитическими ядами. Кроме того, при работе с газовыми электродами необходимо поддерживать постоянным парциальное давление газа, так как потенциал газового электрода зависит и от него.
Электроды второго рода представляют собой полуэлементы, состоящие из металла, покрытого слоем его труднорастворимого соединения (соли, оксида или гидрооксида) и погруженного в раствор, содержащий тот же анион, что и труднорастворимое соединение электродного металла.
Например, в хлорсеребряном электроде протекают реакции, в которых участвуют и ионы серебра, и ионы хлора:
+ AgCl Ag+ +Cl−
Ag+ +e = Ag0
AgCl +e = Ag0 +Cl−
Равновесный потенциал хлорсеребряного электрода будет:
36

Электрохимия
e |
|
|
− = e0 0 |
|
− + |
RT ln |
|
aAgCl |
|
= e0 0 |
|
− + |
RT ln |
|
1 |
|
. |
(4.41) |
|
0 |
|
|
a |
|
0 a |
|
|
1 a |
|
||||||||||
|
Ag |
, AgCl,Cl |
Ag |
, AgCl,Cl |
|
1 F |
|
− |
Ag |
, AgCl,Cl |
|
1 F |
− |
|
|||||
|
|
|
|
|
|
|
|
Ag |
Cl |
|
|
|
|
|
|
Cl |
|
|
|
Его можно рассчитать по активности катиона:
e 0 |
+ = e0 |
0 |
+ + |
RT ln a |
|
+ , |
(4.42) |
Ag , Ag |
Ag , Ag |
|
F |
Ag |
|
|
|
|
|
|
|
||||
или используя произведение растворимости ПрAgCl = aAg+ aCl− , которое, решив
относительно активности ионов серебра a |
+ |
= |
ПрAgCl |
, и подставив последнее |
||||||||||
|
||||||||||||||
|
|
|
|
|
|
|
Ag |
|
|
aCl− |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в уравнение (4.42), получим: |
|
|
|
|
|
|
|
|
|
|
||||
e |
|
|
− = e0 0 |
|
+ + |
RT ln Пр |
|
+ RT ln |
1 |
, |
(4.43) |
|||
0 |
, AgCl,Cl |
, Ag |
|
|
||||||||||
|
Ag |
Ag |
|
F |
AgCl |
|
F |
aCl− |
|
|||||
|
|
|
|
|
|
|
|
|
|
|||||
так как произведение растворимости постоянная величина, то ее можно внести в выражение стандартного потенциала
|
|
e0 |
0 |
, AgCl,Cl |
− = e0 |
0 |
, Ag |
+ + RT ln Пр , |
|||||||
|
|
|
Ag |
|
Ag |
|
F |
|
AgCl |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
тогда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
e |
0 |
,Cl |
− |
= e0 0 |
, AgCl,Cl |
− |
− |
RT ln a |
− . |
(4.44) |
|||||
|
Ag |
|
|
Ag |
|
|
|
F |
Cl |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Величины потенциалов электродов второго рода легко воспроизводимы и устойчивы. Эти электроды часто применяются в качестве электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Наи-
более часто применяются каломельные электроды Hg,Hg2Cl2 |Cl− в которых протекает суммарная реакция Hg2Cl2 +2e =2Hg0 +2Cl− , а так же ртутно– сульфатные, хлор–серебряные, ртутно–окисные и сурьмяные.
Электроды второго рода просты в конструктивном исполнении. величины потенциалов второго рода хорошо воспроизводимы и устойчивы. Эти электроды часто применяют в качестве электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Наиболее часто применяются
каломельные электроды Hg,Hg2Cl2 |Cl− , в которых протекает суммарная ре-
37
Электрохимия
акция реакции Hg2Cl2 +2e =2Hg0 +2Cl− , и ртутно-сульфатные и сурмянные
электроды.
Окислительно-восстановительные или редокси-электроды представляют собой инертную (обычно платиновую) пластинку, погруженную в раствор, со-
держащий |
одновременно ионы в двух |
формах окисления (например, |
||||
Pt |
|
Fe2+,Fe3+ |
или Pt |
|
MnO24−,Mn4− ), а электродная реакция сводится к перемене |
|
|
|
|||||
валентности |
ионов, без изменения |
их состава (Fe3+ +e =Fe2+ , |
||||
MnO4− +e =MnO24− ). Инертный электрод играет роль донора и акцептора элек-
тронов. Выражение для равновесного потенциала редокс электродов имеет вид:
0 |
|
|
RT |
|
a |
3 |
+ |
. |
(4.45) |
|
eFe2+,Fe3+ = eFe2 |
+,Fe3 |
+ − |
|
ln |
Fe |
|
|
|||
F |
aFe2 |
+ |
||||||||
|
|
|
|
|
|
|||||
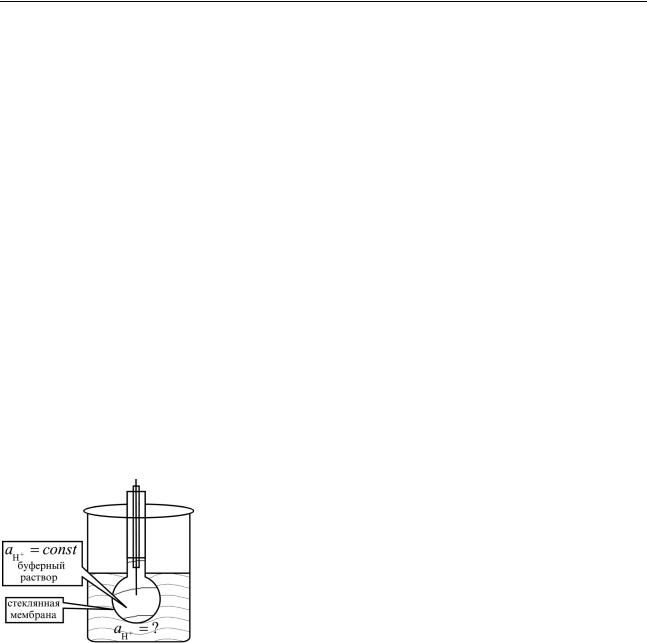
Стеклянный электрод представляет собой тонкую мембрану из специаль-
|
ного стекла по обе стороны которой находятся |
||||
|
растворы |
с |
различным |
pH с активностями |
|
|
′ |
и |
aH+ = ? (рис. |
4.6). От уже рассмот- |
|
|
aH+ =const |
||||
|
ренных электродов он отличается тем, что элек- |
||||
|
тродная реакция сводится к обмену ионами водо- |
||||
Рис. 4.7. Схема стеклян- |
рода между двумя фазами – раствором и стеклом, |
||||
поэтому стеклянный электрод относят к ионооб- |
|||||
ного электрода |
|||||
менных (ионоселективных) электродов. На границе раздела, скачок потенциа-
ла возникает вследствие разницы концентраций ионов. Это позволяет использовать стеклянный электрод для измерения pH растворов.
Стеклянный электрод отличается от уже рассмотренных электродов тем, что в соответствующей ему электродной реакции не участвуют электроны. Электродная реакция сводится здесь к обмену ионами водорода между двумя
фазами — раствором и стеклом: H+р-р H+ст. .
38

Электрохимия
Заряд водородного иона соответствует элементарному положительному количеству электричества, и переход иона водорода из одной фазы в другую эквивалентен перемещению единичного заряда, т. е. в уравнении для потенциала стеклянного электрода z следует принять равным единице
e |
=e |
0 |
+ |
RT |
ln |
a |
+ |
. |
(4.46) |
|
|
H |
|
||||||
|
|
|
|
||||||
ст. |
ст. |
|
zF |
|
aH+ст. |
|
|
||
|
|
|
|
|
|
|
|||
При некоторых допущениях учитывающих участие входящих в состав стекла ионов щелочного металла можно записать:
aH+ |
= |
aH+ |
, |
(4.47) |
|
||||
|
|
aH+ст. |
|
|
замена в уравнении (1.18) для подлогарифмического выражения активностью ионов водорода из уравнения (1.19) приводит к выражению:
e |
=e |
0 |
+ |
RT |
ln a |
= |
2,3RT |
lg |
a |
+ |
=e |
0 |
+ |
RT |
ln pH . (4.48) |
|
|
|
H |
|
|
|
|||||||||
|
|
|
|
|
|
|
|||||||||
ст. |
ст. |
|
zF |
H+ |
|
zF |
|
aH+ст. |
ст. |
|
zF |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||||
Таким образом, потенциал стеклянного электрода в общем случае определяется активностью ионов водорода, что позволяет использовать стеклянный электрод индикаторным электродом при определении рН кислых и щелочных растворов. Для измерения потенциала стеклянного электрода его включают в электрическую систему в виде тонкой мембраны, с одной стороны которой находится исследуемый раствор, а с другой — раствор с неизменной величиной рН. К каждому из растворов подводят электроды сравнения, обычно хлор–серебряные. Потенциалы на каждой из сторон стеклянной мембраны определяются соответствующими реакциями обмена, однако на одной из сторон он остается постоянным, а на другой — изменяется вместе с составом раствора согласно выведенным выше уравнениям. Таким образом потенциал стеклянного электрода представляет собой разность потенциалов между двумя сторонами мембраны.
39

Электрохимия
4.1.2. Электродвижущая сила
Из полуэлементов, обладающих различными равновесными электродными потенциалами, можно составить электрохимическую систему (рис. 4.8). По внешней цепи (по проводникам первого рода) электроны переходят с электрода на ион, при этом этот ион восстанавливается на втором электроде наоборот электроны от иона переходят на электрод и при этом ион окисляется. При этом энергия реакции превращается в электрическую энергию.
Zn |
|
ZnSO |
|
|
|
CuSO |
4 |
|
Cu |
(4.49) |
|
|
|
|
|||||||
|
|
4 |
|
|
|
|
|
|
|
Схематически любую электрохимическую систему принято записывать следующим образом: слева указывается тот электрод, на котором идет процесс окисления, затем примыкающий к нему электролит, далее раствор, контактирующий со вторым электродом и, наконец, второй электрод на котором идет процесс восстановления.
Если ток протекающий в цепи очень мал (внешнее сопротивление цепи очень велико) электрохимический процесс будет медленным и осуществляться в условиях близких к равновесным. В этом случае работа, совершаемая системой будет близка к максимальной, а разность потенциалов в цепи – наибольшей. Такая наибольшая разность потенциалов в электрохимической
цепи называется электродвижущей силой (ЭДС).
Zn ZnCl2 
 CuCl2 Cu
CuCl2 Cu
электродные реакции и потенциал электродов:
Zn-2e = Zn |
2+ |
e 2 |
|
|
=e |
0 |
|
|
|
+ |
RT |
ln |
a |
|
2+ |
|
|
|||
|
+,Zn |
0 |
0 |
|
2 |
+ |
|
|
Znn |
|
|
|
||||||||
|
|
2F |
|
1 |
|
|
|
|
||||||||||||
|
|
|
|
Zn |
|
|
Zn |
,Sn |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Cu |
2+ |
+2e =Cu |
0 |
|
e 0 |
|
=e |
0 |
|
|
2 + |
RT |
ln |
a |
2+ |
|||||
|
|
|
|
|
|
|
|
|
|
Cu |
|
|||||||||
|
|
|
2 |
|
0 |
|
2F |
|
|
1 |
|
|||||||||
|
|
|
|
|
Cu ,Cu + |
|
Cu ,Cu + |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
уравнение для ЭДС будет:
40

Электрохимия
E = eCu0 0 ,Cu2+ + RT2F ln aCu2+ −eZn0 0 ,Zn2+ + RT2F ln aZn2+
ЭДС цепи E представляет собой алгебраическую сумму отдельных скачков потенциала, возникающих на границе раздела между различными фазами, участвующими в образовании цепи. В самом простом случае, когда прочие скачки потенциала устранены или пренебрежимо малы, ЭДС рассчитывается как разность потенциалов электродов, на котором идет процесс восстановле-
ния (e2 ), и электрода на котором идет процесс окисления (e1 ):
|
E =e2 −e1 |
(4.50) |
|
Поскольку всегда e2 |
> e1 , то E >0 (ЭДС всегда положительна). |
|
|
При равновесных |
потенциалах |
электродов измеряется |
стандартная |
ЭДС (E0 ) |
|
|
|
|
E0 = e2 −e0 |
(4.51) |
|
|
2 |
1 |
|
При стандартных условиях, когда подлогарифмические выражения обоих
электродов равны единице, стандартная ЭДС |
|
|
E0 = e0 |
−e0 . |
(4.52) |
2 |
1 |
|
Диффузионный потенциал в гальванических элементах.
В общем случае, при расчете ЭДС цепи следует учитывать не только скачки потенциала на границе между проводниками первого и второго рода, но и на границе между растворами электролитов, возникающими вследствие того, что скорости диффузии катионов и анионов различны. Для двух растворов с одинаковым растворителем такой скачок называется диффузионным потен-
циалом (eд ). В этом случае ЭДС цепи с учетом диффузионного потенциала
(4.53)
Диффузионный потенциал можно устранить с помощью электролитического мостика, заполненного раствором такого электролита, у которого подвижности аниона и катиона близки по величине (например, KCl , KNO3 ,
41

Электрохимия
NH4NO3 ). Если диффузионный потенциал между двумя различными раство-
рами полностью устранен, то такие цепи носят название цепей без переноса, и на схеме растворы отделяются друг от друга двумя сплошными вертикальны-
ми линиями (||), а если не устранен – вертикальной пунктирной линией ( ).
Цепи, в которых он не устранен и происходит непосредственный перенос электролита из одного раствора в другой, называют цепями с переносом.
Существуют определенные правила по написанию составных частей электрохимической системы, суммарной электрохимической реакции и частных электродных реакций. Любая электрохимическая система записывается следующим образом: сначала указывается один из двух образующих ее электродов, затем примыкающий к нему раствор, далее раствор, контактирующий со вторым электродом и, наконец, материал второго электрода. При такой схематической записи электрод отделяется от раствора одной вертикальной чертой, а различные растворы — двумя вертикальными чертами в том случае, если диффузионный потенциал между ними полностью устранен, и пунктирной прямой, если он остается, а затем, в зависимости от характера границы, между растворами ставится одна (при наличии диффузионного потенциала) или две (при присутствии диффузионного потенциала) вертикальные черты. Так, например, следующая схематическая запись:
Pt,H2 |HCl ||CuSO4 |Cu |
(4.54) |
отвечает электрохимической системе, составленной из водородного электрода, погруженного в раствор соляной кислоты, и металлической меди, опущенной в раствор сульфата меди; диффузионный потенциал на границе двух растворов в этой системе полностью устранен. Водородный электрод представляет собой металлическую пластину (обычно с развитой поверхностью), омываемую газообразным водородом и опущенную в раствор, содержащий ионы водорода. Вместо соединений, находящихся в растворах, можно записывать только потенциалопределяющие ионы:
Pt,H |H+ ||Cu2+ |Cu |
(4.55) |
2 |
|
42 |
|

Электрохимия
поскольку потенциал левого электрода зависит от концентрации водородных ионов, а потенциал правого — от концентрации ионов меди. ЭДС системы принимают положительной.
4.1.3. Термодинамическое выражение для равновесного электродного потенциала в гальваническом элементе
Если в электрохимической системе обратимо и изотермически протекает реакция
±zF |
|
|
|
νAA+νBB +... = νLL +νMM +... ±Q |
, |
(4.56) |
|
то при постоянном давлении изменение термодинамического потенциала G соответствует электрической энергии системы
−∆GT , p = zFET , p |
(4.57) |
|||
и обратимая электродвижущая сила (ЭДС) системы определяется как |
|
|||
E |
= − |
∆GT , p |
. |
(4.58) |
|
||||
T , p |
|
zF |
|
|
|
|
|
||
В то же время, в известно [1], что
∆G = ∑µiνi ,
где νi — стехиометрический коэффициент, отвечающий компоненту, обладающему химическим потенциалом µi ; все величины νi принимаются здесь
отрицательными для исходных веществ и положительными — для продуктов реакции. Так как
µi =µ0i + RT ln ai
то для реакции (4.56) можно написать
0 |
νi |
+ RT ln |
aLνL aMνM ... |
, |
(4.59) |
|||
∆G = ∑µi |
ν |
|
ν |
B ... |
||||
|
|
|
a |
A a |
|
|
||
|
|
|
A |
B |
|
|
||
где теперь всем стехиометрическим коэффициентам νi под знаком логарифма
приписывается положительное значение. Если активности всех участвующих в реакции веществ равны единице, т. е. если для любого из них ai=1, или если ai ≠1, но
aLνL aMνM ... =1,
aAνA aBνB ...
43

Электрохимия
то ∆G = ∆G0 = ∑µ0i νi = RT lnKi ,
где ∆G0 — стандартное изменение термодинамического потенциала, а К — константа равновесия данной химической реакции при определенных темпе-
ратуре и давлении. Величины ∆G0 и К имеют здесь тот же смысл, что и в уравнении изотермы химической реакции
∆G = RT lnK + RT ln πaiνi
На основании уравнений (4.58) и (4.59) можно написать, что
E = − |
RT |
lnK − |
RT |
ln |
aνL aνM ... |
. |
zF |
zF |
L M |
||||
|
|
|
aνA aνB ... |
|
||
|
|
|
|
|
A B |
|
(4.60)
(4.61)
Из (4.61) следует, что при ai = 1 для каждого компонента, а также когда подлогарифмическое выражение во втором слагаемом правой части уравнения (1.6) равно единице:
E = −RTzF lnK .
Это значение ЭДС, отвечающее константе равновесия токообразующей электрохимической реакции, обозначается через E° и называется стандартной ЭДС электрохимической системы. Таким образом ЭДС любой равновесной электрохимической системы является функцией стандартной ЭДС и активностей участников электрохимической реакции и описывается уравнением
E = E0 − RT ln aLνL aMνM ... . |
(4.62) |
zF aνA aνB ... |
|
A B |
|
Уравнение (4.62) неопределенное в том смысле, что не всегда можно достаточно четко установить, какие именно из участников реакции следует принимать за исходные вещества, а какие— за ее продукты. Поэтому если не ввести дополнительных условий, может получиться, что для одной и той же электрохимической системы значения ЭДС будут с разными знаками. В настоящее время такие дополнительные условия разработаны и рекомендованы Международным союзом чистой и прикладной химии – ЭДС всегда должна быть положительна.
44

Электрохимия
При этой температуре 25 °С определено наибольшее число значений различных электрохимических величин.
Одна из основных особенностей электрохимической системы заключается в пространственном разделении участников протекающей в ней реакции. Поэтому общая токообразующая реакция разделяется здесь на две частные реакции, каждая из которых совершается на отдельном электроде. В соответствии с этим ЭДС электрохимической системы, как отражение изменения ее химической энергии в ходе суммарной реакции, также должна представлять собой сумму двух электродных потенциалов. Каждый из них отвечает изменению химической энергии при протекании частной электродной реакции. Таким образом,
E =eпол. −eотр. ,
где eпол. и eотр. — электродные νBB +...±=zF νMM +... потенциалы приводящие к возникновению электродного потенциала, следует всегда записывать так, чтобы в левой части уравнения находились окисленные компоненты (исходные вещества), а в правой — восстановленные компоненты (продукты реакции)
Если на первом электроде протекает частная реакция
νAA +...+=zF νLL +... ±Q ,
а на втором — частная реакция
νAB +...−=zF νLM +... ±Q
то вместо выражения (VII-7) можно написать
E = e |
+e |
= e0 |
+ |
RT ln aAνA + e0 |
нач. |
кон. |
нач. |
|
zF aνL кон. |
|
|
|
|
L |
+RT ln aBνB zF aMνM
(4.63)
(4.64)
(4.65)
где eнач0 . и eкон0 . °— стандартные электродные потенциалы, начальных и исход-
ных веществ, соответственно. Причем
E0 = e0 |
−e0 |
. |
(4.66) |
нач. |
кон. |
|
|
45

Электрохимия
4.7.1. Классификация обратимых электрохимических систем
В термодинамически обратимых системах обе электрохимические реакции таковы, что их можно провести термодинамически обратимо. В термодинамически необратимых системах хотя бы одна электрохимическая реакция не является обратимой.
Если термодинамически необратимую систему, например Zn|H2SO4(aq) |Cu замкнуть на очень большое внешнее сопротивление так,
чтобы электрохимические реакции протекали очень медленно, то на отрицательном электроде начнется реакция ионизации металлического цинка
Zn −2e = Zn2+ . Электроны во внешней цепи потекут к медному электроду, на котором единственной восстановительной реакцией будет реакция восстановления ионов гидроксония 2Н++2е=H2.
Если же подключить эту систему к внешнему источнику напряжения (отрицательный полюс к цинковому электроду, а положительный — к медному) и отрегулировать напряжение внешнего источника тока так, чтобы очень малый ток пошел бы в обратном направлении, то на цинковом электроде будет протекать восстановительная реакция 2Н++2е=Н2, а на медном — окисление металлической меди Cu—2e=Cu2+. Здесь электрохимические реакции, протекающие на электродах при прохождении очень малого тока в одном направлении, отличаются от электрохимических реакций, протекающих при прохождении тока в обратном направлении. Следовательно, в данной электрохимической системе в условиях, наиболее приближающихся к обратимости, обе электрохимические реакции не являются термодинамически обратимыми, и вся система термодинамически необратима.
В термодинамически обратимой системе, например
(-)Cu|CuCl2(aq)||CuCl2(aq), AgCl(тв.)|Ag(+) c1 c2
(здесь c — концентрация), если она отдает бесконечно малый ток во внешнюю цепь, идут реакции:
46

Электрохимия
Cu −2e =Cu2+
2AgClтв+2e=2Ag+2Cl−
Cu +2AgClтв =2Ag+Cu2+ +2Cl−
Если же система подключена к внешнему источнику напряжения, и бесконечно малый ток течет в обратном направлении, то протекают реакции;
Cu2+ +2e =Cu
2Ag+2Cl− −2e=2AgClтв
2Ag+Cl2+ +2Cl=Cu+2AgClтв
Как электрохимические реакции, так и химическая реакция в системе меняют свое направление при изменении направления тока.
4.1.4. Химические и концентрационные цепи
Из уравнения Нернста (4.36) видно, что величина равновесного потенциала отдельного электрода зависит и от природы потенциалопределяющих ионов и от активностей ионов, участвующих в электродных реакциях. Поэтому электрохимические цепи можно разделить на два типа: химические и концен-
трационные.
Химические цепи состоят из различных электродов с различными химическими реакциями и ЭДС возникает за счет суммарной химической реакции, например:
Zn Zn2+ 
 Cu2+ Cu
Cu2+ Cu
в которой протекает реакция:
Zn0 +Cu2+ Zn2+ +Cu0 ,
и ЭДС:
0 |
0 |
|
RT |
|
RT |
0 |
|
RT |
|
a 2 |
+ |
. |
|
E = eCu2+,Cu0 |
−eZn2+,Zn0 |
+ |
|
ln aCu2+ − |
|
ln aZn2+ = ECu, Zn |
+ |
|
ln |
Cu |
|||
2F |
2F |
2F |
aZn2 |
+ |
|||||||||
|
|
|
|
|
|
|
|
||||||
Электрохимические цепи, такого типа имеют широкое практическое применение в, например, химических источниках тока.
47

Электрохимия
Концентрационные цепи состоят из одинаковых электродов с одинаковыми химическими реакциями, но ЭДС возникает за счет различной активности
(a1 ≠ a2 ) потенциалопределяющих ионов, например:
Zn |
|
Zn2+ |
|
|
Zn2+ |
|
Zn |
|
|
|||
|
|
|
|
|||||||||
|
|
|
|
a1 |
≠ a2 |
|
|
|
|
|||
в которой протекает реакция: |
|
|
|
|
|
|
|
|
|
|
|
|
Zn2+ |
+Zn0 |
|
|
Zn0 |
+Zn2+ , |
|||||||
a |
|
|
|
a |
1 |
2 |
|
|||||
1 |
|
2 |
|
|
|
|
|
|
|
|
||
и ЭДС: |
|
|
|
|
|
|
|
|
|
|
|
|
E =eZn0 |
2+,Zn0 + |
|
|
RT ln |
a1, Zn2 |
+ |
. |
|||||
|
|
a2, Zn2 |
|
|||||||||
|
|
|
|
|
|
|
2F |
|
+ |
|
||
Например, концентрационной цепью является стеклянный электрод, у ко-
торого активность ионов H+ в растворах по обе стороны мембраны различна, а ЭДС представляет собой разность потенциалов между двумя сторонами мембраны.
4.7.2.Возникновение электродного потенциала. Строение двойного электрического слоя
При равновесии избыточный заряд не распределяется равномерно в объеме твердой или жидкой фазы.
Например, избыточные электроны в цинковой пластине под влиянием электростатического притяжения положительно заряженных ионов в растворе сосредоточены вблизи поверхности электрода, а катионы Zn2+ скапливаются у поверхности электрода, образуя плотную часть двойного электрического слоя, за пределами которого существует диффузная часть двойного электри-
ческого слоя, образующаяся вследствие теплового движения частиц. В результате между металлом и раствором, как между обкладками конденсатора, возникает скачок потенциала.
Поверхностный слой частиц какой-либо фазы находится в иных физических и энергетических условиях, чем такие же частицы внутри объема данной
48

Электрохимия
фазы. Между поверхностными частицами возникает взаимодействие, между соприкасающимся фазам.
Если две фазы построены из «самостоятельно» существующих заряженных частиц, то при соприкосновении их возможен переход таких частиц в неэквивалентном количестве из одной фазы в другую. При этом в поверхностных слоях каждой из фаз возникают электрические заряды, равные по величине, но противоположные по знаку. Образуется так называемый двойной электрический слой, разность зарядов между обкладками которого определяет скачок потенциала. Примером может служить поверхность раздела между металлом и водным раствором. Ионы металла, покидая кристаллическую решетку и перейдя в раствор, приносят в него свои положительные заряды, то время как поверхность металла, на которой остается избыток электронов, заряжается отрицательно. При этом образуется двойной электрический слой за счет перехода заряженных частиц из одной фазы в другую.
При достижении определенной концентрации наступает состояние равновесия, характеризуемое макроскопической неизменностью системы во времени. Эта неизменность не означает, что в системе не протекают никакие процессы. Обмен частицами между твердой и жидкой фазами продолжается, но скорость растворения становится равной скорости осаждения, что и обусловливает макроскопическую неизменность системы во времени, отвечающую равновесию. Условие равновесия в таком случае выражается равенством химических потенциалов вещества в обеих фазах.
Схематически взаимодействие между металлом и раствором можно описать следующим образом. Кристаллическая решетка металла построена из его катионов, занимающих определенные места в узлах решетки, и относительно свободных валентных электронов, движущихся между катионами (так называемый электронный газ). В металлическом теле, не имеющем избыточного электрического заряда, число положительных заряженных катионов равно числу электронов электронного газа.
49

Электрохимия
Катионы и электроны, находящиеся на его поверхности, вследствие разности химических потенциалов между металлом и средой, могут покинуть поверхность.
При погружении металла в воду или другую жидкость с достаточно высокой диэлектрической проницаемостью, полярные молекулы, ориентируясь около катионов металла на поверхности, облегчают переход их в раствор. Этот процесс сопровождается освобождением энергии сольватации.
На рис. 4.8 приведена диаграмма, описывающая энергетические изменения при переходе в раствор катиона. По оси ординат отложен средний уровень энергии W, по оси абсцисс — расстояние х от поверхности металла по нормали. Поверхности металла соответствует линия mm. Катион, находящийся на поверхности, имеет в среднем запас энергии, отвечающий точке а. Перемещение иона влево, т. е. как бы «вдавливание» его в металл или сближение с соседними катионами решетки требует производства большой работы для преодоления сил отталкивания, что выражается круто восходящей энергетической кривой ba. Перемещение вправо по диаграмме, т. е. отрыв катиона от поверхности с переходом в вакуум, также требует затраты работы; при испарении иона в вакуум запас его энергии будет расти по кривой aKc, пока не достигнет некоторой почти постоянной величины, практически отвечающей потере связи катиона с поверхностью металла. Возрастание энергии при этом настолько велико, что этот процесс очень мало вероятен (при обычной температуре металлы практически не испаряются в виде катионов).
На рис. 4.8 это выражается тем, что катион, находящийся в растворе, на ближайшем возможном расстоянии σ0 от поверхности металла имеет уровень энергии, отвечающий точке l. Кривая lK показывает возрастание энергии при отрыве катиона от сольватирующих его молекул растворителя. Ветвь ld выра-
50

Электрохимия
жает резкое возрастание энергии при сближении катиона с молекулами растворителя на расстояния, меньшие, чем в самопроизвольно образованном сольватном комплексе.
Из рис. 4.8 видно, что если для испарения в вакуум катион должен увеличить запас энергии на величину Wисп то для перехода в раствор он должен преодолеть лишь энергетический барьер W, причем W<<Wисп. Следовательно, если испарение катионов металла в вакуум процесс практически невозможный (очень мало вероятный), то переход в раствор представляется процессом значительно более вероятным. Разность уровней энергии между катионом на поверхности и в растворе (А) равна работе процесса перехода иона в раствор. Этот процесс называется окислением, ибо катион из металлического тела, представляющего собой простое вещество, перешел в раствор и получился металл в окисленном состоянии. Работа А характеризует, следовательно, работу окисления данного металла.
Переход катиона в раствор нарушает электрическую нейтральность металла и раствора. Состав металла будет представлен выражением:
(N −1)M+zEe + Nzke |
(4.67) |
где N – число катионов в металле, M – катион, z –валентность, e – заряд электрона.
Число катионов уменьшилось на единицу, в то время как число электронов осталось неизменным. Следовательно, теперь металлическая поверхность приобрела избыточный отрицательный заряд. Вместе с тем раствор приобрел избыточный положительный заряд за счет перешедшего в него катиона. Поэтому отрыв второго катиона происходит с преодолением более высокого энергетического барьера. Каждый следующий катион, переходящий в раствор, преодолевает все более высокий энергетический барьер (рис 4.8).
Повышение концентрации катионов у поверхности металла сопровождается ростом запаса энергии их. Действительно, если бы катионы не притягивались отрицательно заряженной поверхностью металла, то они отошли бы друг
51

Электрохимия
от друга на возможно большие расстояния. Сближение катионов потребовало бы совершения определенной работы. В то же время отрыв каждого следующего катиона от поверхности требует преодоления все более высокого энергетического барьера, ибо катионы удерживаются отрицательно заряженной поверхностью металла, причем средняя энергия их уменьшается. На рис. 4.8 это выражается тем, что точка l по мере растворения катионов перемещается вверх по линии llравн. Одновременно точка а передвигается вниз в направлении
к aравн.
Каждый катион, перешедший в раствор, вызывает сходные изменения энергии у металла (точка i ) и у раствора (точка l) и перемещение точек на одинаковую величину, ибо такой переход увеличивает в одинаковой мере заряд металла и раствора. Когда средняя энергия катионов в растворе у поверхности металла дойдет до значения, определяемого точкой lравн, равного средней энергии катионов на поверхности металла, наступит равновесие, и дальнейшее увеличение концентрации катионов у поверхности металла прекратится. Энергетический барьер, который катионы преодолевают при переходе в раствор, возрастет при этом от величины W до W0.
Кроме возможности растворения катионов, имеется еще возможность обратного их осаждения на поверхность металла (восстановление). Этот процесс будет происходить если точка l будет иметь большую энергию, чем точка a.
При равновесии скорость окисления равна скорости восстановления
vок. =vвосст. . |
(4.68) |
Это выражение показывает, что равновесие не означает прекращения всяких процессов в системе, а лишь равенство скоростей двух противоположных по смыслу процессов, в данном случае — окисления и восстановления.
На равновесие, кроме концентрации катионов на поверхности металла и в растворе, влияет также электрический заряд поверхности металла и прилегающего к ней слоя раствора. Между ними существует разность потенциалов
(скачок потенциала). Накопление зарядов приводит к изменению уровня энер-
52
Электрохимия
гии катионов на поверхности металла и в растворе, что выражается на рис 4.8 перемещением точки а вниз и l вверх. По мере накопления зарядов возрастает разность потенциалов между поверхностью металла и прилегающим слоем раствора. Когда точки а и l окажутся на одном уровне, скачок потенциала примет значение, отвечающее равновесию (равновесный потенциал), который соответствует работе А. Эта величина его служит мерой работы, которую совершает 1 грамм-атом металла, переходя в окисленное состояние.
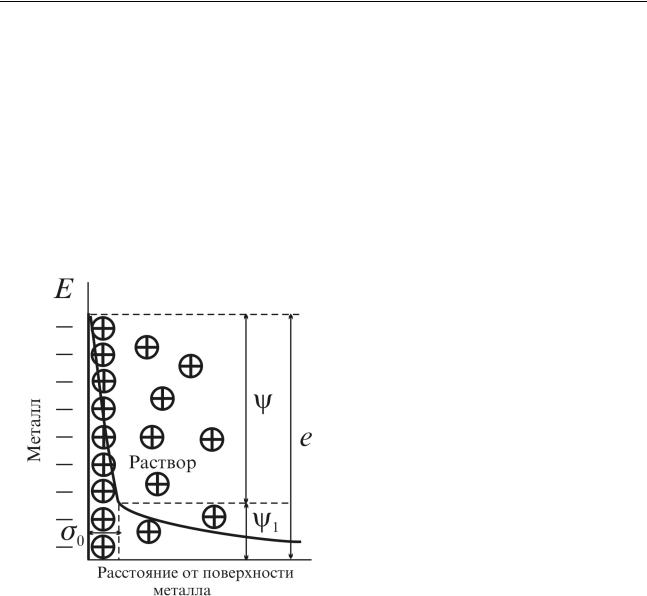
Катионы, скопившиеся у поверхности металла в концентрации, отвечающей равновесию, не могут удалиться от нее в глубь раствора. Этому препятствует электростатическое притяжение между катионами и избыточными электронами на поверхности металла. Вследствие притяжения образуется двойной электрический слой, схематически показанный на рис. 4.9. Значительное количество катионов находится в первом ряду, непосредственно прилегающем к поверхности металла – плотная часть. Здесь часто реализуется почти весь
скачок потенциала. Дальше идет «размытая» — диффузная — часть. Расстояние от поверхности металла двойного слоя, где концентрация ио-
нов постепенно падает, достигая концентрации, свойственной данному раствору в целом. На этом участке тоже имеется некоторое падение потенциала, но обычно меньшее по величине и с меньшим градиентом (рис. 3), Потенциал плотной части двойного слоя обозначим буквой ψ а диффузной части — ψ1 .
Общее падение потенциала
53

Электрохимия
(4.69)
Двойной электрический слой можно уподобить конденсатору, одна из обкладок которого представляет собой поверхность металла, а другая — слой ионов в растворе у поверхности металла. Между разноименно заряженными обкладками и возникает разность, или скачок, потенциала.
До сих пор, рассматривая возникновение скачка потенциала на границе между металлом и электролитом, мы предполагали, что химический потенциал катионов на поверхности металла выше, чем в растворе. Вследствие этого вероятность перехода в раствор катионов металла больше вероятности обратного осаждения из раствора. Такое соотношение уровней энергии и скоростей vок. и vвосст. в начальный момент являлось следствием достаточно легкой окис-
ляемости металла и малой концентрации катионов данного металла в растворе у поверхности. Но возможен и противоположный случай, когда металл окисляется с трудом, уровень энергии катионов в растворе выше, чем на поверхности металла, а концентрация его катионов в растворе достаточно велика. Тогда скорость vвосст. будет больше, чем vок. , и начнется осаждение (восстановление)
катионов металла, которое будет происходить до достижения равновесия. При этом, поверхность металла приобретает избыточный положительный
заряд за счет катионов, осаждающихся на ней, а остающийся в растворе избыток анионов сообщает ему отрицательный заряд. По мере увеличения этих зарядов скорость осаждения vвосст. будет уменьшаться, а скорость обратного рас-
творения vок. расти; при наступившем равновесии снова будет соблюдено условие равенства этих скоростей vок. =vвосст. .
Скачок потенциала осуществляется между двумя обкладками двойного слоя, имеющими относительно друг друга противоположные заряды. По принятой шкале потенциалов считается, что скачок потенциала отрицателен в том случае, если металл заряжен отрицательно, и положителен, если металл заряжен положительно относительно обкладки двойного слоя, находящейся в растворе.
54

Электрохимия
Рассмотрение взаимодействия металла с раствором, приводящего к равновесию, показывает, что скачок потенциала на границе металл — раствор, возникающий вследствие перехода катионов металла из одной фазы в другую, препятствует дальнейшему окислению или восстановлению. Поэтому, как было сказано выше, равновесный потенциал может служить мерой максимальной работы того процесса, который стремится самопроизвольно совершиться на электроде.
Известно, что величина работы зависит не только от природы протекающего процесса, но и от количества прореагировавшего вещества. Обычно ее относят к 1 г-иону металла, заряд которого равен zF (где z — валентность иона, F — число Фарадея). В таком случае работа, выраженная в электрических единицах:
A =eвост.zF .
Часто нужно бывает учесть в таком выражении знак электрического скачка потенциала. Из рассмотрения диаграммы, приведенной на рис. 4.??, видно, что чем больше положительная работа окисления, тем большее отрицательное значение должен иметь равновесный потенциал. Если же работа окисления отрицательна, а следовательно положительна работа восстановления, то потенциал положителен. Чтобы учесть это соотношение, нужно потенциалу и работе приписать противоположные знаки.
Если потенциал, в силу тех или иных причин, сохраняет значение, отличное от равновесного, то ea ≠ eaокисл. и должен протекать с какой-то определенной скоростью процесс окисления или восстановления. Работа такого процесса тоже измеряется величиной потенциала. В самом деле, при текущем процессе заряд 1 г-иона переносится через двойной слой, в котором имеется скачок потенциала сра. Поэтому для протекающего процесса
eazF = A′.
Здесь А' < А, так как работа процесса, совершающегося не бесконечно медленно, всегда меньше максимальной работы.
55
