
- •4.1. Введение
- •4.2. Растворы электролитов
- •4.4. Процессы переноса в электрохимических системах
- •4.5. Предмет электрохимии
- •4.6. Электрохимическое равновесие
- •4.7. Стандартный электродный потенциал. Водородный электрод
- •4.8. Электрохимическая кинетика
- •4.9. Библиографический список
- •4.10. Предметный указатель

Электрохимия
Этот закон справедлив только в узкой области концентраций: он применим для растворов ионная сила которых не превышает 0,02, а для растворов с низкой диэлектрической проницаемостью концентрационный предел еще ниже.
Во втором приближении теории Дебая–Хюккеля в это уравнение вводят эмпирические коэффициенты a и b, учитывающие размеры иона:
lg γ± = −A |
|
z+z− |
|
J |
|
1 |
|
(4.10) |
|
|
|
|
|||||
|
|
|
|
|
||||
|
|
|
+ ab |
|
||||
|
|
|
|
1 |
J |
|||
(для водных растворов часто ab =1).
Введение этих поправок расширяет применимость закона до концентрации растворов с ионной силой 0,1.
В третьем приближении для учета влияния растворенного электролита на
диэлектрические свойства раствора вводится параметр d: |
|
||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
||||
lg γ± = −A |
z+z− |
J |
|
|
+ d J |
, |
(4.11) |
|
+ ab J |
||||||
|
|
1 |
|
|
|
||
что расширяет пределы его применимости до ионной силы 0,2–0,3. Коэффициенты активности, вычисленные с помощью уравнений теории
Дебая–Хюккеля, позволяют рассчитывать различные термодинамические свойства растворов.
4.4.Процессы переноса в электрохимических системах
Вэлектрохимических реакциях участвуют электроны, ионы, а также в ряде
случаев, нейтральные частицы. Поэтому необходимо знать законы переноса электронов в проводниках первого рода, и ионов в проводниках второго рода.
В электрохимических системах поток вещества к гетерогенной границе раздела (а также удаление продуктов реакции из зоны реакции) может осуществляться четырьмя способами: а) в результате движения ионов в электрическом поле (так называемая миграция); б) диффузией; в) конвекцией; г) благодаря наличию градиента температуры.
17

Электрохимия
4.4.1.Электрическая проводимость
4.4.2.Абсолютная скорость и подвижность ионов
Способность растворов электролитов проводить электрический ток зави-
сит от природы электролита и растворителя, концентрации и температуры. В растворе электролита сольватированные ионы находятся в беспорядочном тепловом движении. При наложении электрического поля возникает упорядоченное движение ионов к противоположно заряженным электродам – миграция (перенос). Движение ионов происходит под действием силы, сообщающей им ускорение, однако одновременно с возрастанием скорости их движения увеличивается сопротивление среды. В результате скорость движения ионов через малый промежуток времени становится постоянной.
Сравнение скоростей движения различных видов ионов производится при одинаковом градиенте потенциала поля, равном 1 В/м. Скорость движения ио-
нов в этих условиях называют абсолютной скоростью ионов3 (u), она измеряется в м2·В-1·с-1.
Движение гидратированного иона может быть уподоблено движению микроскопического шарика в вязкой среде. Данный факт позволяет оценить абсолютную скорость ионов i -го вида формулой Стокса:
u = |
f |
, |
(4.12) |
|
6πηr |
||||
i |
|
|
||
|
i |
|
|
где f – сила, действующая на ион; η – коэффициент вязкости среды; ri – эффек-
тивный радиус частицы, который зависит от размера иона и его гидратации. Из уравнения (4.12) следует, что чем больше эффективный радиус иона,
тем меньше скорость его движения. Например, размеры ионов щелочных металлов увеличиваются в ряду
rLi+ < rNa+ < rK+ < rRb+ < rCs+ ,
3 Величину u называют также электрической подвижностью или абсолютной подвижностью ионов
18

Электрохимия
в то время как способность к гидратации уменьшается в этой же последова-
тельности (ион Li+ гидратирован сильнее остальных ионов). В результате эффективные радиусы уменьшаются, а абсолютные скорости при переходе от
Li+ к Cs+ возрастают:
uLi+ <uNa+ <uK+ <uRb+ <uCs+ .
Наряду с абсолютной скоростью ионов часто пользуются понятием подвижности ионов. Произведение абсолютной скорости ионов на постоянную Фарадея F . Произведения u+F и u−F называется подвижностью иона. Число Фарадея равно 964864,6 Кл/моль [7] это суммарный заряд одного моля электронов F =eNA , т. е. то количество электричества при электролизе,
которое необходимо затратить для изменения степени окисления 1 моль вещества на единицу. Единица измерения подвижности ионов – См м2 моль-1, где См – (сименс4) единица измерения электрической проводимости, обратная единице измерения сопротивления (Ом), т.е. 1 См=1 Ом.
Подвижность многовалентных ионов относят к единице валентности, т.е.
говорят, например, о подвижности катионов K+ , Ag+ , но 1/2 Mg2+ и анионов
Cl− , CH3COO− , но 1/2 SO24− .
4.4.3. Числа переноса
Каждый вид ионов переносит определенное количество электричества, зависящее от заряда и концентрации ионов, а также скорости их движения в электрическом поле. Отношение количества электричества qi , перенесенного ионами i-го вида, к общему количеству электричества q , перенесенному все-
ми ионами, находящимися в растворе, называют числом переноса ионов:
ti =qi / q . |
(4.13) |
4 Обозначение единицы электрической проводимости сименс, как и всех других единиц, происходящих от имен собственных, пишется с прописной буквы (См). Это обозначение
нельзя путать с обозначением единицы измерения длины – сантиметр (см).
19

Электрохимия
В соответствии с этим определением сумма чисел переноса всех видов ионов в растворе равна единице.
Для симметричного электролита KA, диссоциирующего на два вида ионов
K z+ и Az− , количество электричества, перенесенное катионами и анионами, составит соответственно:
q+ =ez+c+u+; q− =ez−c−u−, (4.14)
где e – элементарный заряд; z+, z− – заряд катиона и аниона; c+, c− – молярная концентрация катионов и анионов (c+ =c− =c); u+, u− – абсолютные скорости
ионов. Отношение чисел переноса катионов t+ и анионов t− |
равно отношению |
||||||||||
их абсолютных скоростей или подвижностей: |
|
||||||||||
|
t+ |
= q+ |
= |
u+ |
, |
|
|
||||
|
t |
|
|
|
|||||||
|
q |
− |
|
u |
− |
|
|||||
|
|
− |
|
|
|
|
|||||
а поскольку t+ +t− =1, то |
|
|
|
|
|
|
|
|
|
|
|
t = |
u+ |
|
и |
|
t = |
|
|
u− |
. |
(4.15) |
|
u+ +u− |
|
|
|
|
|||||||
+ |
|
|
− |
|
u+ +u− |
|
|||||
Из уравнений видно, что число переноса данного вида иона зависит от абсолютной скорости и подвижности обоих видов ионов, т.е. в растворах разных электролитах числа переноса одного и того же иона различны.
На степень гидратации ионов, величины их абсолютной скорости и числа переноса влияют концентрация раствора и температура. С ростом концентрации примерно до 0,1 моль/л для большинства электролитов числа переноса ионов изменяются незначительно; в области более высоких концентраций это изменение заметнее. При повышении температуры размеры гидратных оболочек слабо гидратированных ионов уменьшаются менее резко, чем сильно гидратированных (а иногда даже увеличиваются). В результате величины абсолютной подвижности катионов и анионов сближаются, и их числа переноса стремятся к 0,5.
20

Электрохимия
4.4.4. Удельная электрическая проводимость
Мерой способности веществ проводить электрический ток является электрическая проводимость величина, обратная электрическому сопротивлению R . Так как по закону Ома R =ρl / S , то
|
1 |
= |
1 S |
= σS |
σ = |
l |
|
(4.16) |
|
R |
ρ l |
RS |
|||||
|
|
l |
|
|
||||
где ρ – удельное сопротивление, Ом/м; l – длина проводника, м; S |
– его по- |
|||||||
перечное сечение, м2; σ – удельная электрическая проводимость См м–1.
Удельная электрическая проводимость раствора электролита – это элек-
трическая проводимость 1 м3 раствора, заключенного между двумя параллельными электродами, имеющими площадь по 1 м2 и расположенными на расстоянии 1 м друг от друга.
Исходя из того, что удельная электрическая проводимость раствора электролита определяется количеством всех видов ионов, переносящих электриче-
ство, их скоростью и зарядом |
|
σ = F ∑ziciui . |
(4.17) |
Для раствора симметричного электролита z+ = z− = z |
при концентрации |
c (моль/ л), и при степени диссоциации α имеем |
|
σ = αzFc(u+ + u− ). |
(4.18) |
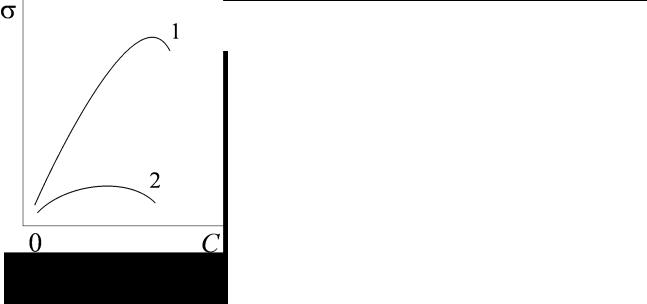
Ход кривых концентрационной зависимости, удельной электрической проводимости растворов электролитов, показан на рис. 4.1.
При c=0 удельная проводимость раствора определяется удельной проводимостью чистого растворителя. Поскольку вода является очень слабым элек-
тролитом, то для водных растворов σ0 =0 : кривые σ = f (c) исходят из начала координат.
21
Электрохимия
Рис. 4.1. Зависимость удельной электрической проводимости растворов сильных (1) и слабых (2) электролитов от концентрации
Усильных электролитов степень диссоциации равна 1. Поэтому удельная проводимость должна возрастать пропорционально росту концентрации, что и наблюдается в области значительных разбавлений. Но при дальнейшем увеличении количества ионов в растворе усиливаются межионные взаимодействия, и темп роста проводимости замедляется, а в области высоких концентраций влияние тормозящих эффектов может привести даже к уменьшению удельной проводимости.
Услабых электролитов при росте концен-
трации степень диссоциации (α) и следова-
тельно, количество заряженных частиц уменьшается. Поэтому удельная проводимость таких растворов значительно меньше проводимости растворов сильных электролитов.
Силы торможения определяются ионной силой раствора, природой растворителя и температурой. Для одного и того же электролита при прочих равных условиях они возрастают с увеличением концентрации раствора.
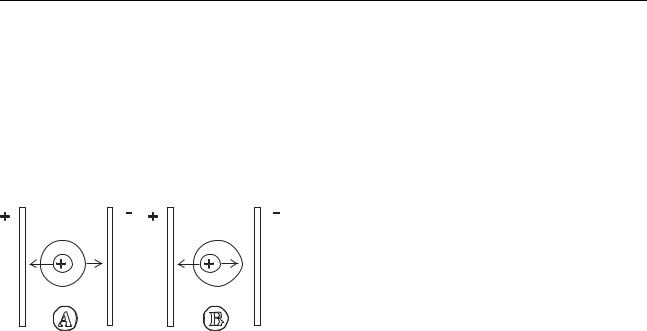
Эффект электрофоретического торможения (рис. 4.3 (А)) возникает вследствие того, что центральный ион и его ионная атмосфера обладают противоположными по знаку зарядами. При наложении на раствор электролита электрического поля ионы, входящие в ионную атмосферу, движутся в навстречу центральному иону. Следовательно, движущийся центральный ион находится под влиянием тормозящей силы, названной электрофоретической силой трения, что приводит к снижению его скорости.
Эффект релаксационного торможения (рис. 4.2 (В)), возникает вследст-
вие того, что при движении иона в электрическом поле нарушается центральная симметрия ионной атмосферы: перемещение иона сопровождается разру-
шением ионной атмосферы в одном положении иона и формированием ее в
22
Электрохимия
другом, новом. Данный процесс протекает с конечной скоростью в течение некоторого времени, называемого временем релаксации. Позади движущегося иона, потерявшего центральную симметрию, всегда будет некоторый избыток заряда противоположного знака. Силы электростатического притяжения, возникающие при этом, будут тормозить движение иона.
В электрических полях высокого на-
пряжения ( 107 В/ м) скорость движе-
ния ионов становится настолько большой, что ионная атмосфера не успевает образоваться, вследствие чего оба тормозящих эффекта отсутствуют (эффект
Вина).
В электрических полях высокой частоты ( 104 Гц) центральный ион очень быстро колеблется не выходя за пределы окружающей его атмосферы, которая не успевает разрушиться. Вследствие этого релаксационное торможение исчезает и остается лишь электрофоретическое торможение (эффект Де-
бая – Фалькенгагена).
Характер зависимости удельной электрической проводимости растворов электролитов от концентрации представлен на рис. 2.1.
В 1 м3 растворов разных концентраций содержатся различные количества растворенного вещества, что исключает возможность сопоставления значений их удельной электрической проводимости. По этой причине введено поня-
тие молярной электрической проводимости
4.4.5. Молярная электрическая проводимость
Молярная электрическая проводимость раствора электролита – это электрическая проводимость такого объема раствора, который содержит 1 моль растворенного вещества и заключен между двумя параллельными электродами, расположенными на расстоянии 1 м друг от друга. Каждый электрод имеет такую площадь, чтобы в этом объеме содержался 1 моль растворенного
23

Электрохимия
вещества (т. е. площадь должна быть тем больше, чем меньше концентрация раствора).
Молярная электрическая проводимость Λc (cм м2 моль-1) связана с удель-
ной соотношением
Λc |
= |
σ |
, |
(4.19) |
|
|
c |
|
|
где σ – удельная электрическая проводимость, См/м; с – |
концентрация, |
|||
моль/м3. |
|
|
|
|
При выражении концентрации раствора в моль/л уравнение (4.19) записывается в виде
Λ = |
10−3 |
σ |
. |
(4.20) |
c |
|
|||
|
|
|
|
Исходя из уравнений (4.18) и (4.20) с учетом, для бинарного электролита, следует
Λc = αzF (u+ + u− )= αz(λ+ +λ− ) |
(4.21) |
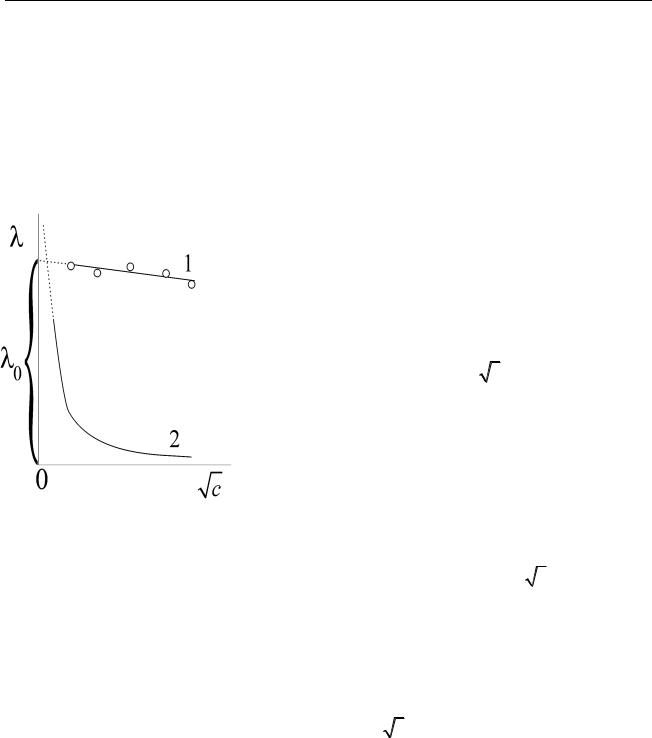
Ход кривых концентрационной зависимости, молярной электрической проводимости растворов электролитов, показан на рис. 4.2.
При c=0 молярная проводимость раствора не равна молярной проводимости чистого растворителя ( Λc ≠ 0). Величина Λ0 называемая предельной элек-
трической проводимостью5 и отвечает электрической проводимости гипотетического бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита и отсутствием сил электростатического взаимодействия между ионами.
При росте концентрации молярная проводимость растворов и сильных и слабых электролитов уменьшается(Λc < Λ0 ).
5 Электрической проводимостью при бесконечном разбавлении, т.е. при бесконечно малой концентрации, и обозначают как Λ∞ ,
24
Электрохимия
У сильных электролитов (α =1) количество заряженных частиц, способ-
ных участвовать в переносе тока, при любой концентрации остается постоянной. Некоторое уменьшение молярной проводимости с ростом концентрации происходит только под влиянием тормозящих эффектов и вследствие увеличения вязкости растворов.
Молярная проводимость растворов сильных электролитов в области малых концентраций линейно зависит от корня квадратного из концентрации (рис. 4.3) и может быть описана эм-
|
пирическим уравнением |
|
|
|
|
|
|
Λc = Λ0 −a c , |
|
(4.22) |
|
|
где a – эмпирическая константа. |
|
|||
|
Уравнение |
(4.22) |
называют |
уравнением |
|
|
Кольрауша или законом квадратного корня. С |
||||
|
достаточной степенью точности Λ0 может быть |
||||
Рис. 4.3. Зависимость мо- |
определена экспериментально |
экстраполяцией |
|||
лярной электрической про- |
линейной зависимости |
Λc = f |
( c ) |
на беско- |
|
водимости растворов силь- |
|
|
|
|
|
ных (1) и слабых (2) элек- |
нечное разведение (рис. 4.3). |
При |
несколько |
||
тролитов от корня квадрат- |
|||||
ного из концентрации |
более высоких |
концентрациях |
сильных элек- |
||
тролитов лучшее согласие с опытом дает уравнение |
|
|
|
||
|
Λc = Λ0 −a3 c , |
|
|
(4.23) |
|
известное под названием закона кубического корня.
Для выражения зависимости молярной электрической проводимости растворов электролитов от концентрации предложен ряд уравнений, в которые входят константы, полученные с учетом сил релаксационного и электрофоретического торможения и зависящие от диэлектрической проницаемости, вязкости растворителя и температуры. Таковы, например, константы A и B в формуле Шидловского
25

Электрохимия
Λ0 |
= |
Λc + A |
c |
−Dc , |
(4.24) |
|
|
1− B |
c |
|
|
которая является наиболее удачной среди эмпирических формулам, является для концентрированных растворов пользуются (в ней D – эмпирический коэффициент).
У слабых электролитов, в соответствии с законом разведения Оствальда, количество заряженных частиц в растворе резко уменьшается вследствие ас-
социации (α<<1) и соответственно наблюдается резкое понижение молярной
проводимости.
Зависимость Λc = f ( c ) для растворов слабых электролитов нелинейна
(рис. 4.3). Для разбавленных растворов слабых электролитов справедливо уравнение:
lg Λc = const − |
1 lg c . |
(4.25) |
|
2 |
|
При уменьшении концентрации (c →0)кривая, |
выражающая эту зависи- |
|
мость, асимптотически приближается к ординате, и Λ0 слабого электролита может быть больше Λ0 сильного электролита.
В случае слабых электролитов Λ0 нельзя определить экспериментально.
Ее находят по закону независимости движения ионов при бесконечном раз-
бавлении (закону Кольрауша). Согласно этому закону, справедливому как для сильных, так и для слабых электролитов, при бесконечном разбавлении, когда
(α ≈1) молярная электрическая проводимость равна сумме ионных электриче-
ских проводимостей (подвижностей ионов). |
|
Λ0 = z+λ0,+ +z−λ0,− , |
(4.26) |
где λ0,+ и λ0,− – предельная молярная электрическая проводимость катиона и аниона, или применительно к 1–1–электролиту:
Λ0 = λ0,+ +λ0,− . |
(4.27) |
26 |
|

Электрохимия
Все сказанное выше позволяет сделать два практически важных заключения. Во-первых, выражения для чисел переноса справедливы также и для предельно разбавленных растворов. Исходя из этого с учетом закона независимости движения ионов Кольрауша можно записать
t |
= |
|
λ0,+ |
|
= |
λ0,+ |
, |
t |
= |
|
λ0,− |
|
= |
λ0,− |
. |
(4.28) |
||||
λ |
|
+λ |
|
|
λ |
|
+λ |
|
|
|||||||||||
+ |
|
0,+ |
0,− |
|
Λ |
0 |
|
− |
|
0,+ |
0,− |
|
Λ |
0 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Во-вторых, закон Кольрауша дает возможность по известным значениям Λ0 для некоторых электролитов расчетным путем найти значение Λ0 для дан-
ного электролита, если он состоит из тех же ионов. Таким образом, определяя значения Λ0 для ряда сильных электролитов графическим методом из экспе-
риментальных данных (рис. 2.2), можно рассчитать значение Λ0 для слабого электролита. Например,
|
|
|
|
|
Λ0, CH COOH = Λ0, CH COONa + Λ0, HCl −Λ0,NaCl = |
|
|||||||||||
|
|
|
|
|
3 |
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= λ0, CH COO− +λ0, Na+ +λ0,H+ |
+λ0,Cl− −λ0, Na+ −λ0, Cl− = |
|||||||||||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= λ0,CH COO− +λ0, H+ |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Из уравнений (4.21) для электролита с концентрацией c следует: |
||||||||||||||
|
|
|
|
|
Λc |
=α |
|
u+ +u− |
= α |
|
f |
λ |
, |
(4.29) |
|||
|
|
|
|
|
Λ |
0 |
c u |
+u |
c |
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
0,+ |
0,− |
|
|
|
|
|
|
|||
|
|
где |
αc |
— степень диссоциации |
при |
данной |
концентрации c ; |
||||||||||
f |
λ |
= |
u+ +u− |
– коэффициент электрической проводимости, введенный Бьер- |
|||||||||||||
u |
+u |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
0,+ |
0− |
|
|
|
|
|
|
|
|
|
|
|
|
|
румом и вносящий поправку на силы взаимодействия при прохождении тока через растворы электролитов.
Межионное взаимодействие при неравновесных процессах, в частности при прохождении электрического тока через растворы электролитов (явление электрической проводимости), должно иметь иной характер, чем в условиях равновесия. Поэтому коэффициент электрической проводимости отличается от коэффициента активности, относящегося только к равновесным растворам.
27
