
5. Количественный анализ
Количественный анализ позволяет установить количественное соотношение составляющих анализируемый объект компонентов.
-
Химические методы
К химическим методам количественного анализа относятся гравиметрия и титриметрия.
Гравиметрия
Гравиметрический анализ - метод количественного химического анализа, основанный на измерении массы определяемого вещества или его составных частей, выделяемых в химически чистом состоянии или в виде соответствующего соединения точно известного состава, полученного с помощью химической реакции или в результате физических или физико-химических процессов.
Основной приём метода – взвешивание, заключается в сравнении массы данного вещества с известной массой гирь.
Метод осаждения основан на измерении массы малорастворимого вещества (роданида меди). Ход анализа. К 100 мл слабокислого или нейтрального раствора пробы добавляют 5—6 % раствор сернистой кислоты Н2SОз по 20 мл на 100 мг Сu2+. Нейтрализуют раствор по каплям 2 н. раствором аммиака до появления мути, которую растворяют добавлением по каплям 5— 6% H2SO3. Для осаждения 100 мг Сu2+ добавляют 20 мл 0,1 н. раствора роданида аммония или калия из бюретки, перемешивая смесь после осаждения еще 5 мин. Через 2 —3 ч осадок отфильтровывают через стеклянный фильтрующий тигель и промывают 3—4 раза холодной водой. Сушат осадок роданида меди (I) CuSCN при 120 °С. Уравнение реакции:
2Cu(NO3)2 + 4KSCN = 2CuSCN + (SCN)2 + 4KNO3
Осаждаемой и гравиметрической формой является CuSCN
g(Cu(NO3)2) = F* m(CuSCN),
ω%( Cu(NO3)2)=m*100% /a
F-гравиметрический фактор
а -навеска образца
Титриметрия
Титриметрический анализ объединяет группу методов количественного химического анализа, основанных на измерении объёма раствора реагента точной концентрации, необходимого для взаимодействия с определённым количеством анализируемого вещества.
Основной приём метода-титрование, заключается в постепенном добавлении к определяемому веществу раствора реагента точной концентрации до достижения эквивалентного соотношения между ними.
Заместительное титрование - взаимодействие анализируемого вещества со вспомогательным реагентом, в результате которого выделяется эквивалентное количество продукта реакции, который титруют титрованным раствором.
Определение массовой доли нитрата меди в образце йодометрическим методом (вариант титрования по заместителю)
Определение основано на восстановлении Cu2+ вспомогательным реагентом йодидом калия до Cu+ c выделением эквивалентного количества молекулярного йода, который оттитровывается раствором тиосульфата натрия.
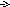 2
Cu(NO3)2
+4KI I2+Cu2I2
+2KNO3
2
Cu(NO3)2
+4KI I2+Cu2I2
+2KNO3
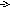 I2+2Na2S2O3
2NaI+Na2S4O6
I2+2Na2S2O3
2NaI+Na2S4O6
М (Cu(NO3)2)=187,56 г/моль
fэ(Cu(NO3)2)=1, Mэ(Cu(NO3)2)= fэ*MI2=159,69г/моль
TNa2S2O3/ Cu(NO3)2 =CэNa2S2O3 *КпNa2S2O3*Мэ Cu(NO3)2 /1000
Q Cu(NO3)2 =TNa2S2O3/ Cu(NO3)2 *VNa2S2O3
=Q Cu(NO3)2 *100% /a Cu(NO3)2
Комплексонометрический метод основан на образовании прочных, растворимых в воде внутрикомплексных соединений 2-,3-,4-х, зарядных ионов металлов с комплексонами.
Комплексоны представляют собой полидентатные аминополикарбоновые кислоты, образующие с 2-,3-,4-х-зарядными ионами металлов растворимые в воде комплексные соединения в соотношении 1:1 , называемые комплексонатами металлов.
Наибольшее распространение получил титрант: дигидрат динатриевой соли этилендиаминтетрауксусной кислоты Na2H2C10H12O8*2H2O (трилон Б, комплексон 3, условное обозначение Na2H2Y).
Me2+ + H2Y2- = MeY2- + 2H+
Определение массовой доли сульфата меди комплексонометрическим методом:
1. Hind2- + Cu2+ = CuInd- + H+
2. H+ + NH3*H2O ↔ NH4+ + H2O
3. Cu2+ + H2Y2- = CuY2- + 2H+
4. CuInd- + H2Y2- + OH- = CuY2- + Hind2- + H2O
К раствору сульфата меди добавляют аммиачный буфер, сухую индикаторную смесь кислотного хрома тёмно-синего и титруют 0,05 М раствором трилона Б до перехода красно-фиолетовой окраски раствора
