
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «ПЕРМСКАЯ ГОСУДАРСТВЕННАЯ ФАРМАЦЕВТИЧЕСКАЯ АКАДЕМИЯ» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Кафедра аналитической химии
Нитрат меди II
Пермь 2019
Оглавление
-
Формула соединения
-
Описание
-
Растворимость, PH
-
Качественный анализ
-
Физико-химические методы
-
Химические методы
-
-
Количественный анализ
-
Сущность статистической обработки результатов анализа
-
Формула соединения
Cu(NO3)2
Нитрат меди (II)
Молярная масса = 187,57 г/моль
-
Описание
Безводный: бесцветные кристаллы
Кристаллогидрат: голубые кристаллы
-
Растворимость, pH
Нитрат меди (II) хорошо растворим в воде, этаноле, метаноле, этилацетате, ацетонитриле. При кристаллизации образуются три- и гекса- гидраты.
pH (Cu(NO3)2) <7, кислая среда
-
Качественный анализ
Качественный химический анализ предназначен для обнаружения компонентов анализируемого объекта и его идентификации.
-
Физические и физико-химические методы
Физические методы используют физические свойства веществ, такие как состав и концентрация.
Плотность (Cu(NO3)2*3 H2O) = 2,32 г/см3
Температура плавления:
(Cu(NO3)2*3 H2O = 114,5° С
(Cu(NO3)2 = 255° С
Растворимость (Cu(NO3)2) = 124,7 г/100 мл
Удельное вращение (Cu(NO3)2*3 H2O) = 1,12 нм
-
Химические методы
Химический метод – используются химические реакции с видимыми внешними изменениями
Характерные реакции катионов VI группы, на ион меди ( II) Cu2+ :
1) С концентрированным раствором NH4OH (ГФ) с выпадением основной соли зеленоватого цвета, легко растворимой в избытке реагента с образованием аммиачного комплекса меди(II) интенсивно синего цвета
2CuSO4
+ 2 NH4OH
![]() (CuOH)2SO4
+ (NH4)2SO4
(CuOH)2SO4
+ (NH4)2SO4
(CuOH)2SO4
+ 8 NH4OH
![]() [Cu(NH3)4]SO4
+ [Cu(NH3)4](OH)2
+ 8 H2O
[Cu(NH3)4]SO4
+ [Cu(NH3)4](OH)2
+ 8 H2O
Комплексный ион разрушается при подкислении или действии S2-:
[Сu(NH3)4]
2+ + 4
H+![]() Cu2+ +
4 NH4+
Cu2+ +
4 NH4+
[Cu(NH3)4]
2+ + S2-![]() CuS
+ 4 NH3
CuS
+ 4 NH3
Реакция высокочувствительна и специфична.
2) Реакция выделения меди на железной пластинке. На пластинке образуется красноватое пятно меди.
CuSO4
+ Fe![]() Cu
+ FeSO4
Cu
+ FeSO4
Реакция используется для отделения Cu2+ от Cd2+.
3) С гексацианоферратом(II) калия K4[Fe(CN)6] с образованием красно-бурого осадка гексацианоферрата(II) меди(II), нерастворимого в разбавленных кислотах, растворимого в растворе аммиака, разлагаемого щелочами.
2
CuSO4+
K4[Fe(CN)6]
![]() Cu2[Fe(CN)6]
+ 2 K2SO4
Cu2[Fe(CN)6]
+ 2 K2SO4
4) С иодидом калия KI с образованием осадка иодида меди(I) цвета «слоновой кости», одновременно выделившийся свободный иод окрашивает раствор в буро-коричневый цвет.
2
CuSO4 + 4 KI![]() Cu2I2 +
I2 + 2 K2SO4
Cu2I2 +
I2 + 2 K2SO4
-
С тиосульфатом натрия Na2S2O3 при кипячении в кислой среде (восстановление меди(II) в медь(I)) с образованием черного осадка Cu2S, растворимого в 2 моль/дм3 растворе HNO3.
2
CuSO4
+ 3 Na2S2O3![]() Cu2S2O3
+ Na2S4O6
+ 2 Na2SO4
Cu2S2O3
+ Na2S4O6
+ 2 Na2SO4
Cu2S2O3
+ H2O
![]() Cu2S
+ H2SO4
Cu2S
+ H2SO4
В избытке Na2S2O3 также осаждается сера:
CuCl2
+ 2 Na2S2O3
+ 2 H2O
![]() Cu2S
+ S +
4 HCl + 2 Na2S
Cu2S
+ S +
4 HCl + 2 Na2S
6)С сульфидом натрия образуется черный осадок, растворимый в азотной кислоте.
3 2
 CuS↓-2ē→
Cu2+ +S↓
CuS↓-2ē→
Cu2+ +S↓
NO3˗+4H++3ē →NO↑+2H2O
Характерные реакции для анионов IV группы, на нитрат-ион (NO3)
-
При взаимодействии с сульфидами и сероводородом образует оксид азота (IV) («лисий хвост»)
H2S+8HNO3 (конц.) →H2SO4 + 8NO2↑ + 4H2O
С умеренно разбавленной азотной кислотой образуется NO и выпадающая в осадок сера
H 2S+8HNO3 (развбавл.) → 3S↓ + 2NO↑ + 4 H2O
-
С дифениламином в сернокислой среде (ГФ).
Дифениламин вначале димеризуется в бесцветный N,N-дифенилбензидин, который затем окисляется в «дифенилбензидин фиолетовый»
-
С сульфатом железа (II)
2Cr(NO3)3+6FeSO4+4H2SO4→3Fe2(SO4)3+ Cr2(SO4)3+4H2O+2NO↑
NO+FeSO4→[Fe(NO)]SO4
В результате выделения сульфата нитрозожелеза появляется коричневое кольцо
-
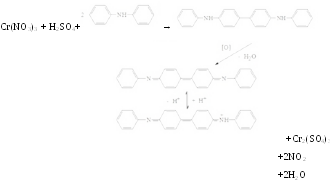
С антипирином с среде концентрированной серной кислоты с образованием нитроантипирина красного цвета:
 +H2SO4+
Cr(NO3)3→
+H2SO4+
Cr(NO3)3→
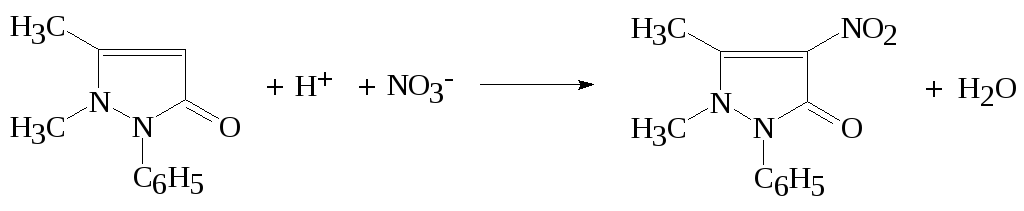 +H2O+
Cr(HSO4)3
+H2O+
Cr(HSO4)3
Наблюдается интенсивное красное окрашивание
-
С раствором KMnO4 в сернокислой среде (ГФ). Наблюдается исчезающая розовая окраска.
Обнаружению NO3-иона препятствуют NO2-ионы. Для правильного результат используют методы разрушения NO2-ионов.
-
Осторожное нагревание с твёрдым хлоридом аммония
NH4Cl + NaNO2 → N2 + NaCl + H2O
-
Осторожное нагревание с мочевиной в кислой среде
H2NCONH2 + 2NaNO2 + HCl → CO2↑ + 2N2 + 3H2O + 2NaCl
-
Кипячение с сульфаминовой кислотой
H2NSO3H + NaNO2 → N2↑ + NaHSO4 + H2O
