
Определение универсальной газовой постоянной на установке фпт1-12 и ее компьютерном имитаторе
Методические указания к лабораторной работе
Цель работы – изучение газовых законов и экспериментальное определение универсальной газовой постоянной.
Приборы и принадлежности – установка ФПТ1-12, лабораторный термометр, IBM–совместимый персональный компьютер и пакет компьютерных программ, имитирующих работу лабораторной установки ФПТ1-12.
Теоретическое введение
Уравнение состояния идеального газа. В молекулярно-кинетической теории идеальным называют теоретическую модель газа, удовлетворяющую следующим условиям:
собственный объем молекул пренебрежимо мал по сравнению с объемом сосуда, в котором находится газ;
потенциальная энергия взаимодействия молекул пренебрежимо мала по сравнению с кинетической энергией их хаотического движения;
удары молекул газа о стенки сосуда являются абсолютно упругими.
Модель идеального газа была предложена Дж.Герапатом в 1847 г.
Состояние газа определяется рядом параметров, важнейшими из которых являются температура и давление. В термодинамике температура – это величина, характеризующая состояние термодинамического равновесия макроскопической системы, а давление – сила, действующая на единицу площади поверхности в направлении нормали к ней. Молекулярно-кинетическая теория, опираясь на модель идеального газа, связывает температуру и давление с усредненными характеристиками движения молекул газа. В результате температура определяется как физическая величина, являющаяся мерой средней кинетической энергии поступательного движения молекул газа. Давление определяется суммарным импульсом, передаваемым молекулами в единицу времени единице площади поверхности сосуда, в котором находится газ.
Параметры состояния идеального газа связаны уравнением
![]() , (1)
, (1)
где
|
соответственно давление, объем и масса газа; |
– |
молярная масса, т. е. масса одного моля газа; |
|
термодинамическая температура, измеряемая в кельвинах; |
|
универсальная газовая постоянная. |
Отношение
![]() определяет количество вещества или
число молей идеального газа. Эту же
величину можно получить, разделив число
молекул
определяет количество вещества или
число молей идеального газа. Эту же
величину можно получить, разделив число
молекул
![]() в данной массе газа на постоянную
Авогадро
в данной массе газа на постоянную
Авогадро
![]() ,
определяющую число молекул в одном
моле, т.е.
,
определяющую число молекул в одном
моле, т.е.
![]() . (2)
. (2)
После подстановки второго из выражений (2) в соотношение (1) уравнение состояния идеального газа принимает вид
![]() , (3)
, (3)
где
![]() – постоянная Больцмана.
– постоянная Больцмана.
Значения трех часто используемых в молекулярной физике постоянных приведены в табл.1.
Таблица 1
Наименование физической постоянной |
Обозна-чение |
Приближенное значение |
Наиболее точно измеренное (табличное) значение |
Постоянная Больцмана |
|
1,3810-23 ДжК |
1,380662(44)10-23 ДжК |
Постоянная Авогадро |
|
6,021023 моль-1 |
6,022045(31)1023 моль-1 |
Универсальная газовая постоянная |
|
8,31 Дж(мольК) |
8,31441 Дж(мольК) |
Из уравнения (1) легко выводятся три опытных газовых закона:
закон Бойля (1662 г.) Мариотта (1676 г):
![]() const
при
const
при
![]() и
и
![]() ; (4)
; (4)
закон Шарля (1787 г.):
![]() const
при
и
const
при
и
![]() ; (5)
; (5)
закон Гей-Люссака (1802 г.):
![]() const
при
и
const
при
и
![]() const. (6)
const. (6)
Из уравнения (3) непосредственно следует закон Авогадро (1811 г.): в равных объемах газов при одинаковых давлении и температуре содержится одинаковое число молекул. Из этого уравнения также можно вывести закон Дальтона (1801 г.). Действительно, в случае смеси химически невзаимодействующих газов величина , входящая в уравнение (3), определяет полное число молекул, т.е. сумму чисел молекул разных сортов:
![]() , (7)
, (7)
где
|
число
молекул
|
|
число компонент смеси. |
Подставив выражение (7) в уравнение (3), получим:
![]() . (8)
. (8)
С
другой стороны, если бы весь объем
занимали только молекулы
-го
сорта, то давление
![]() (парциальное давление) удовлетворяло
бы соотношению
(парциальное давление) удовлетворяло
бы соотношению
![]() . (9)
. (9)
Подставляя левую часть выражения (9) в правую часть уравнения (8), получим после сокращения на :
![]() , (10)
, (10)
что и является законом Дальтона: давление смеси химически невзаимодействующих идеальных газов равно сумме парциальных давлений.
Уравнение (1) часто называют уравнением Клапейрона–Менделеева. Обоснованием этому послужили следующие обстоятельства. Сначала Б.П.Э.Клапейрон (1834 г.) объединил законы (4)-(6) и записал уравнение состояния идеального газа в виде
![]() , (11)
, (11)
где
коэффициент пропорциональности
![]() зависит от массы газа и его молярной
массы. Затем Д.И.Менделеев (1874 г.) объединил
закон Авогадро с уравнением Клапейрона,
ввел в него универсальную газовую
постоянную и записал уравнение состояния
в виде соотношения (1).
зависит от массы газа и его молярной
массы. Затем Д.И.Менделеев (1874 г.) объединил
закон Авогадро с уравнением Клапейрона,
ввел в него универсальную газовую
постоянную и записал уравнение состояния
в виде соотношения (1).
Ф

![]() воздействия газа на поршень площадью
воздействия газа на поршень площадью
![]() равна
равна
![]() ,
и, следовательно, формулу для работы,
совершаемой при бесконечно малом
перемещении поршня
,
и, следовательно, формулу для работы,
совершаемой при бесконечно малом
перемещении поршня
![]() ,
можно записать в виде
,
можно записать в виде
![]() ,
,![]() (12)
(12)
где
![]() – изменение объема газа.
– изменение объема газа.
Из
уравнения (12) следует, что при расширении
газа от объема
![]() до объема
до объема
![]() он совершает работу
он совершает работу
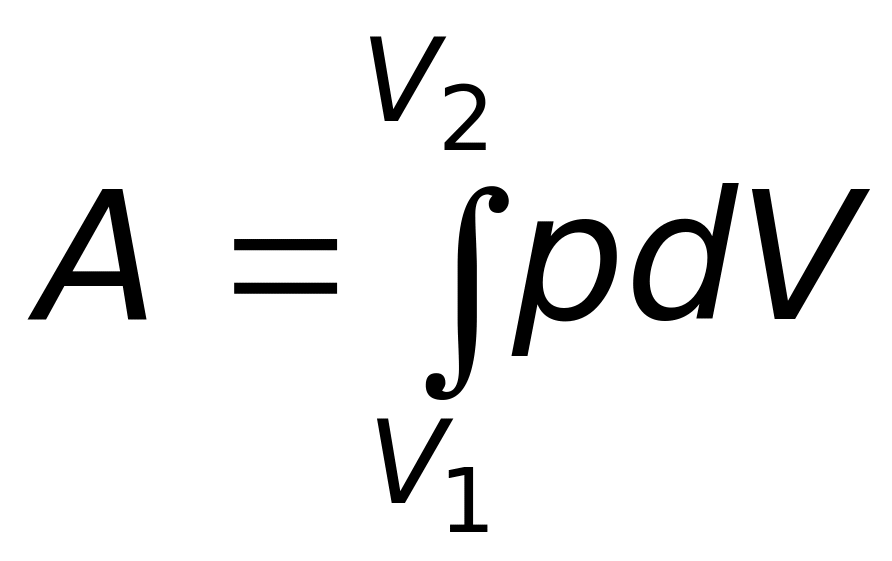 . (13)
. (13)
Применим
формулу (13) к изобарному (![]() )
расширению газа и воспользуемся
соотношениями (1) и (2). В результате
получим:
)
расширению газа и воспользуемся
соотношениями (1) и (2). В результате
получим:
![]() , (14)
, (14)
откуда
![]() . (15)
. (15)
Формула (15) и раскрывает физический смысл постоянной : универсальная газовая постоянная – это величина, численно равная работе, которую совершает один моль идеального газа при его изобарном расширении в результате нагревания на 1 К.
