
- •Растворы Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Электролитическая диссоциация Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Гидролиз солей Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 8
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 18
- •Вариант 20
- •Термодинамика
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Химическая кинетика и равновесие Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Окислительно-восстановительные реакции Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Химические свойства металлов Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Коррозия металлов Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Комплексные соединения Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Строение атома Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Химическая связь Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Вариант 6
- •Вариант 7
- •Вариант 8
- •Вариант 9
- •Вариант 10
- •Вариант 11
- •Вариант 12
- •Вариант 13
- •Вариант 14
- •Вариант 15
- •Вариант 16
- •Вариант 17
- •Вариант 18
- •Вариант 19
- •Вариант 20
- •Вариант 21
- •Вариант 22
- •Вариант 23
- •Вариант 24
- •Вариант 25
- •Приложение
- •Стандартные абсолютные энтропии s некоторых веществ
- •Константы диссоциации слабых электролитов
- •Растворимость солей и оснований в воде
- •Ряд стандартных электродных потенциалов металлов
- •Библиографический список
- •Содержание
Вариант 19
Физические опыты, доказывающие корпускулярную природу электронов (М. Фарадей, А.Г. Столетов).
Каковы недостатки и достоинства планетарной модели строения атома?
В чем причина периодического изменения свойств элементов и их соединений?
Наружный электронный слой элемента выражается формулой 3s23p4. Определите порядковый номер и название элемента.
Вариант 20
Перечислите основные правила, используемые при заполнении электронами энергетических уровней и подуровней в атомах.
В соответствии со значениями квантовых чисел определите количество энергетических уровней в атоме водорода. Дайте понятие основного и возбужденного состояния атома. С какого энергетического уровня может происходить отрыв от атома электрона и переход его в свободное состояние?
Охарактеризуйте элементы III группы, исходя из строения их атомов и положения в периодической системе.
Какие частицы атомов являются изоэлектронными, т. е. содержат одинаковое число электронов: Mg , Na
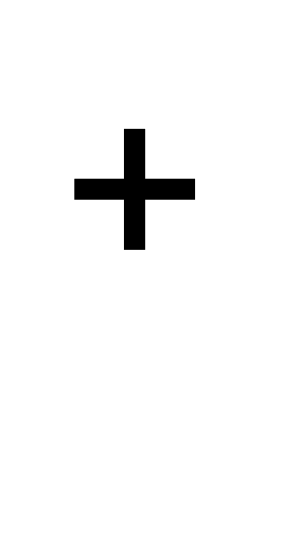 ,
Si
,
Si ,
P
,
P
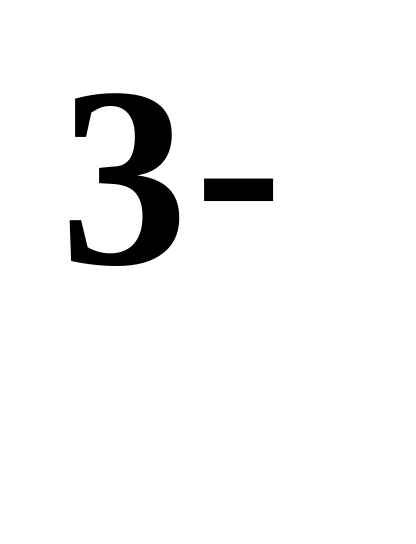 ?
?
Вариант 21
Физические явления, подтверждающие волновую природу электрона. Почему у элементарных частиц обнаруживается корпускулярно-волновой дуализм?
Дайте определение явления радиоактивности. Кем было открыто это явление? Какие ученые внесли большой вклад в изучение радиоактивности?
Приведите математическую зависимость между количеством электронов на энергетическом уровне и главным квантовым числом.
Сколько вакантных 3p-орбиталей имеет атом кремния в стационарном и возбужденном состоянии?
Вариант 22
Почему у р-элементов IV группы физические свойства (радиус атома, потенциал ионизации и т.п.) изменяются немонотонно (нелинейно)?
Чем отличается естественная радиоактивность от искусственной радиоактивности?
В чем сущность теории строения атома, предложенной Дж. Томсоном? Назовите недостатки и достоинства этой теории?
Какие орбитали атома заполняются электронами раньше: 4f или 5s; 6d или 5р? Почему? Составьте электронную формулу атома элемента с порядковым номером 27.
Вариант 23
В периодической системе элементов принято водород записывать дважды – в первой и седьмой группах. Какие свойства водорода служат основанием для того, чтобы считать его аналогом щелочных металлов и галогенов?
Укажите особенности электронных конфигураций атомов меди и хрома. Сколько 4s-электронов содержат невозбужденные атомы этих элементов? Определите максимальную степень окисления атомов меди и хрома.
Значения какого квантового числа, определяют количество s-, p-, d- и f-орбиталей на энергетическом уровне? Сколько всего s-, p- и d-электронов в атоме кобальта?
Напишите электронные формулы атомов фосфора и ванадия. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
