
6.3. Изотермы реальных газов.
Обозначим
![]() .
.
Умножив уравнение (2) на
![]() ,
получаем
,
получаем
![]() (3)
(3)
Все реальные газы с уменьшением
плотности приближаются по своим свойствам
к идеальным газам, поэтому уравнение
Ван-дер-Ваальса при
![]() переходит в уравнение Менделеева -
Клапейрона.
переходит в уравнение Менделеева -
Клапейрона.
Раскрыв скобки в уравнении (3) и умножив
на
![]() ,
получаем
,
получаем
![]() (4)
(4)
Мы получили кубическое уравнение
относительно
![]() ,
коэффициенты которого зависят от
параметров
,
коэффициенты которого зависят от
параметров
![]() .
.
В зависимости от соотношения между коэффициентами решения уравнения могут быть либо все три вещественными, либо одно вещественное и два комплексных, не имеющих физического смысла.
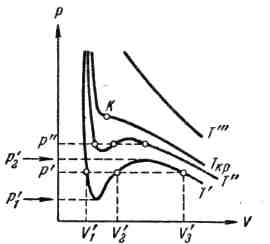 На рис.6.5 изображены изотермы
Ван-дер-Ваальса для нескольких значений
температуры.
На рис.6.5 изображены изотермы
Ван-дер-Ваальса для нескольких значений
температуры.
При температуре
![]() и давлении в пределах от
и давлении в пределах от
![]() до
до
![]() коэффициенты в (4) таковы, что все три
решения вещественные; при других
коэффициентах уравнение имеет только
одно вещественное решение.
коэффициенты в (4) таковы, что все три
решения вещественные; при других
коэффициентах уравнение имеет только
одно вещественное решение.
Различие между тремя вещественными
решениями с ростом температуры уменьшается
(ср. изотермы
и
![]() ,
,
![]() >
).
>
).
Начиная с определенной, своей для каждого
вещества температуры
![]() вещественным
остается только одно решение уравнения
(4). Температура
,
называемая критической.
вещественным
остается только одно решение уравнения
(4). Температура
,
называемая критической.
Если повышать температуру, то точки,
соответствующие решениям уравнения
![]() ,
,
![]() ,
,
![]() все
больше сближаются, сливаясь при
критической температуре в одну точку
(на рис. Точка К).
все
больше сближаются, сливаясь при
критической температуре в одну точку
(на рис. Точка К).
Точка К называется критической.
Ей соответствуют три совпадающих
вещественных решения уравнения (4).
Касательная к критической изотерме в
точке К является пределом, к
которым стремятся секущие
![]() и
и
![]() и
т.д. при приближении температуры к
критической. Следовательно, эта
касательная , ак и все секущие , параллельна
оси V, так , что производная
и
т.д. при приближении температуры к
критической. Следовательно, эта
касательная , ак и все секущие , параллельна
оси V, так , что производная
![]() в
точке К. Кроме того в точке
перегиба должна быть равна нулю и вторая
производная
в
точке К. Кроме того в точке
перегиба должна быть равна нулю и вторая
производная
![]()
Из уравнения (1) выразим давление:
![]()
Продифференцируем это уравнение по
![]() :
:![]()
В критической точке при
![]() эти
выражения должны обращаться в ноль:
эти
выражения должны обращаться в ноль:
![]()
![]()
Для критической точки
![]()
Мы получили систему из трех уравнений
с неизвестными
![]() .
.
Решение этой системы имеет вид
![]()
Таким образом, зная константы
Ван-дер-Ваальса
![]() и , можно найти соответствующие критической
точке
,
которые называются критическими
величинами. И , наоборот, по известным
критическим величинам могут быть найдены
значения констант Ван-де- Ваальса.
и , можно найти соответствующие критической
точке
,
которые называются критическими
величинами. И , наоборот, по известным
критическим величинам могут быть найдены
значения констант Ван-де- Ваальса.
Для критических величин
![]() ,
в то время как
,
в то время как
согласно уравнению Менделеева -
Клапейрона для идеального газа
![]() .
.
6.4. Внутренняя энергия реального газа.
Взаимодействие между молекулами
реального газа обуславливает их взаимную
потенциальную энергию![]() ,
которая переходит во внутреннюю энергию
газа наряду с кинетической энергией
движения молекул
,
которая переходит во внутреннюю энергию
газа наряду с кинетической энергией
движения молекул
![]() .
.
Найдем энергию ван-дер-ваальсовского газа.
Внутренняя энергия такого газа
![]() ,
где
,
где
— суммарная кинетическая энергия молекул в Ц-системе (связанной с сосудом),
— суммарная энергия взаимодействий молекул (собственная потенциальная энергия).
Найдем
.
: Работа сил притяжения равна убыли
внутренней энергии
![]() .
.
Силы притяжения характеризуются
внутренним давлением
![]() в уравнении Ван-дер-Ваальса.
в уравнении Ван-дер-Ваальса.
Тогда элементарная работа этих сил
![]() ,
где знак минус обусловлен тем, что при
расширении газа (
,
где знак минус обусловлен тем, что при
расширении газа (![]() >0)
работа
>0)
работа
![]() должна быть отрицательной,
< 0.
должна быть отрицательной,
< 0.
Итак,
![]() .
.
Мы представили
![]() как убыль некоторой величины — она и
является энергией
=
как убыль некоторой величины — она и
является энергией
=![]() .
.
При
![]() .
.
Суммарная же кинетическая энергия
зависит от поступательного и внутреннего
движений молекул, и определяется как
![]() .
.
Таким образом, внутренняя энергия
моля ван-дер-ваальсовского газа
![]()
где
![]() .
.
Если газ расширяется в пустоту без теплообмена с окружающими телами, то А = U, Q = 0, и согласно первому началу в этом процессе U= сопst. Значит, с ростом объема температура газа уменьшается (в отличие от идеального газа).
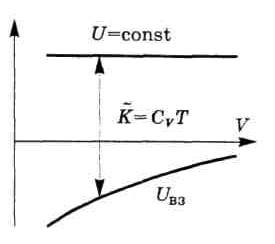 Это
можно представить и наглядно (рис. 6.6).
Это
можно представить и наглядно (рис. 6.6).
Видно, что при расширении газа (увеличении объема V) в случае U=const суммарная кинетическая энергия молекул газа, а значит и температура T, уменьшается. Газ охлаждается.
Теперь получим то же выражение для
внутренней энергии, исходя из того, что
внутренняя энергия является
термодинамическим потенциалом
![]()
Из уравнения состояния ван-дер-ваальсовского
газа следует, что
![]() .
.
Отсюда
![]() .
.
Подставив это выражение, получим
![]() .
.
Произведя интегрирование по V,
найдем, что
![]() .
.
Вид функции f (Т)
можно установить, воспользовавшись
тем, при
![]() выражение для внутренней энергии
ван-дер-ваальсовского газа должно
переходить в выражение для внутренней
энергии идеального газа
выражение для внутренней энергии
ван-дер-ваальсовского газа должно
переходить в выражение для внутренней
энергии идеального газа
U =
![]() T.
T.
В итоге мы приходим к выражению
![]() которое было получено, исходя из других
соображений .
которое было получено, исходя из других
соображений .
Получим для моля ван-дер-ваальсовского
газа этого газа уравнение адиабаты в
переменных T,
V,
если известна его молярная
теплоемкость
![]() .
.
Согласно первому началу термодинамики
![]() .
.
Отсюда
![]()
Интегрируя это уравнение, получаем
![]() ,
,
Или
![]() .
.
Таким образом, уравнение адиабаты
имеет вид
![]() .
.
Определим для ван-дер-ваальсовского
газа разность теплоемкостей
![]() .
.
По определению теплоемкости
![]()
Учитывая, что
![]() получим
получим
![]() .
(4)
.
(4)
Найдем
![]() .
.
Для этого продифференцируем по T уравнение Ван-дер-Ваальса.
В результате получим
![]()
 .
(5)
.
(5)
Подстановка (5) в (4) приводит к искомому
результату: .
.
