
- •Содержание
- •1 Белки
- •1.1 Общие сведения о белках
- •1.2 Аминокислоты
- •1.2.1 Строение аминокислот
- •1.2.2 Оптическая активность аминокислот
- •1.2.3 Номенклатура
- •1.2.4 Способы получения -аминокислот
- •1.2.5 Химические свойства
- •1.3 Белки
- •1.3.1 Классификация белков
- •1.3.2 Синтез белков
- •1.3.3 Структура белков
- •1.3.4 Физические свойства белков
- •1.3.5 Химические свойства белков
- •1.4 Практическая часть: Исследование свойств белка. Аминокислотный состав.
- •1.4.1 Лабораторная работа №1 "Агрегация белка"
- •Порядок выполнения работы
- •Порядок выполнения работы
- •Порядок выполнения работы
- •Порядок выполнения работы
- •Порядок выполнения работы
- •Порядок выполнения работы
- •Порядок выполнения работы
- •Порядок выполнения работы
- •1.5 Контрольные вопросы:
- •2 Ферменты
- •2.1 Общие сведения о ферментах
- •2.2 Строение ферментов
- •2.3 Общие свойства ферментов
- •2.4 Активаторы и ингибиторы ферментов
- •2.5 Классификация ферментов
- •2.6 Практическая часть: Исследование влияния температуры и рН среды на активности амилазы и сахаразы
- •2.6.1 Лабораторная работа №3 "Термолабильность ферментов"
- •Порядок выполнения работы
- •Порядок выполнения работы
- •2.6.2 Лабораторная работа №4 "Ферментативный гидролиз сахарозы в биологических объектах"
- •Порядок выполнения работы
- •2.7 Контрольные вопросы:
- •3.1 Общие сведения о липидах
- •3.2 Строение и классификация липидов
- •3.3 Основные превращения липидов
- •3.4 Практическая часть: Исследование химического состава растительного жира. Синтез «саломассы».
- •3.4.1 Лабораторная работа №5 "Определение свободных жирных кислот в жире"
- •Порядок выполнения работы
- •3.4.2 Лабораторная работа №6 "Синтез "саломассы" из растительных жиров"
- •Порядок выполнения работы
- •3.4.3 Лабораторная работа №7 "Определение суммарного количества непредельных связей в жирных кислотах"
- •Порядок выполнения работы
- •3.5 Контрольные вопросы:
1.3.5 Химические свойства белков
Белки, как производные аминокислот, обладают химическими свойствами, присущими аминокислотам: реакции на амино-, карбоксильные группы, по специфическим для аминокислот группировкам. К последним относятся:
спиртовая группа (–ОН) – оксилизин, треонин, серин;
тиольная группа (–SCH
 )
– метионин;
)
– метионин;
фенольная группировка (–C
 H
H OH)
– тирозин;
OH)
– тирозин;
индольный цикл – триптофан;
пиррольный цикл – пролин;
имидазольный цикл – гистидин.
Таким образом, белки можно отнести к многофункциональным реакционноспособным соединениям.
А) “Цветные реакции белка”.
С помощью “цветных реакций” обнаруживают белок в биологических средах и устанавливают их аминокислотный состав. Различаются два типа цветных реакций:
1) Универсальные – биуретовая (на все белки), нингидриновая (на все природные аминокислоты и белки);
2) Специфические – только на определенные аминокислоты как в молекуле белка, так и в растворах аминокислот.
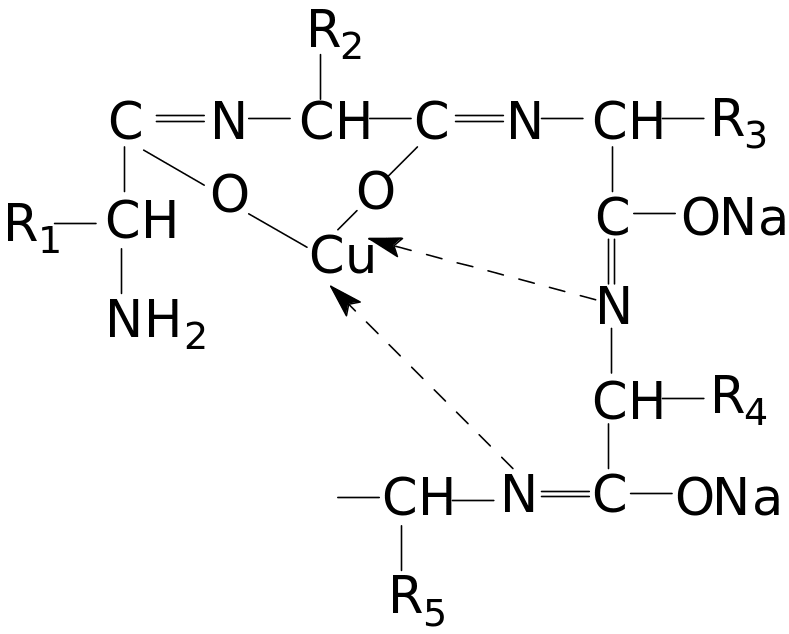
1 Реакция на амидную группировку (биуретовая реакция):
В щелочной среде раствор белка с ионами меди приобретает фиолетовый цвет. Реакция обусловлена образованием биуретового комплекса в результате соединения ионов меди с пептидными группировками белка, переходящими в щелочной среде в енольную форму. Биуретовый медный комплекс можно представить следующим образом:
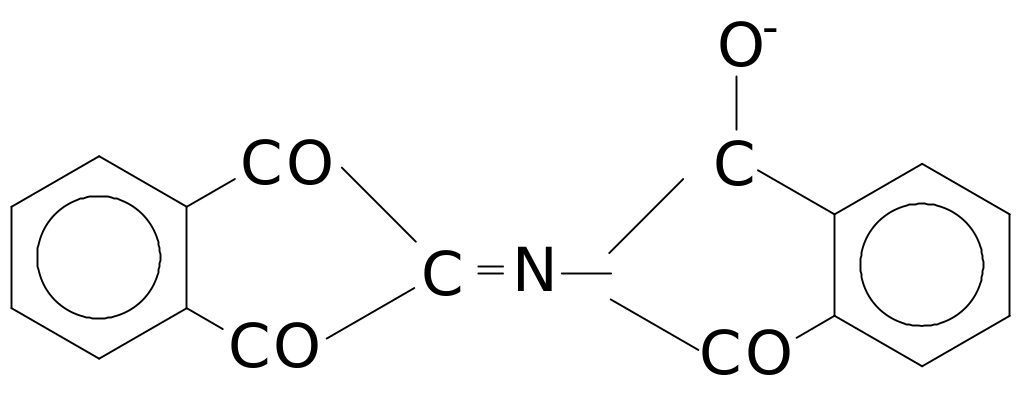
2 Реакция на аминогруппы аминокислот и белков (нингидриновая реакция):
Эта реакция характерна для аминогрупп, находящихся в - положении. Аминокислоты, полипептиды и белки при кипячении с водным раствором нингидрина дают синее или сине-фиолетовое окрашивание. Комплекс называется “сине-фиолетовый комплекс Руэмана”, имеет строение:
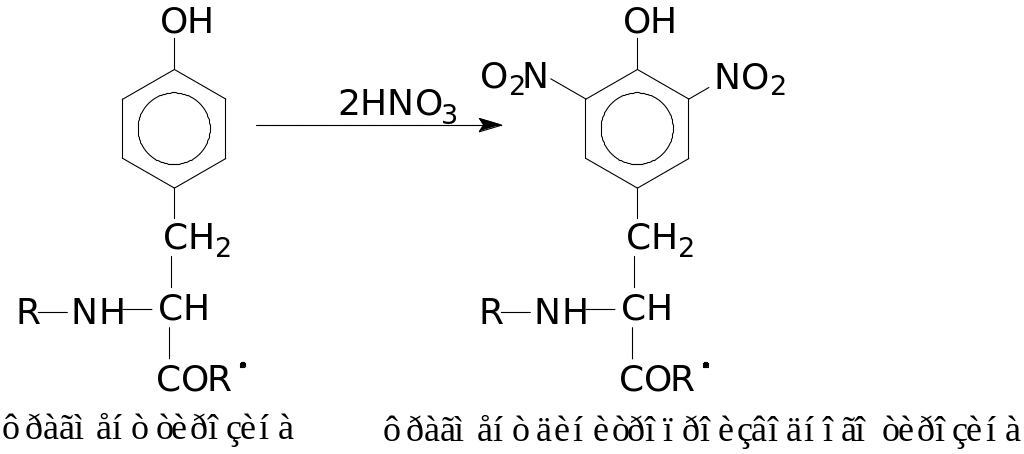
3 Реакция на циклические аминокислоты (ксантопротеиновая реакция):
Реакция открывает наличие в белках циклических аминокислот – триптофана, фенилаланина, тирозина, содержащих в своем составе бензольное кольцо. Цветная реакция обусловлена нитрованием бензольного кольца этих аминокислот с образованием нитросоединения желтого цвета, например:
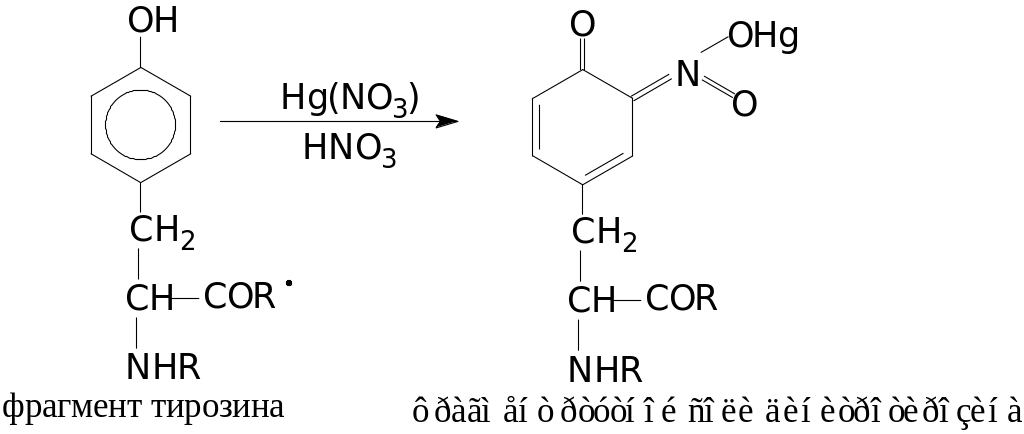
4 Реакция на тирозин (реакция Миллона):
Реакция Миллона открывает в белке тирозин. Аминокислоту тирозин можно рассматривать как производное фенола. Фенолы и их производные образуют ртутные соли красного цвета. Химизм реакции Миллона можно отразить уравнением:
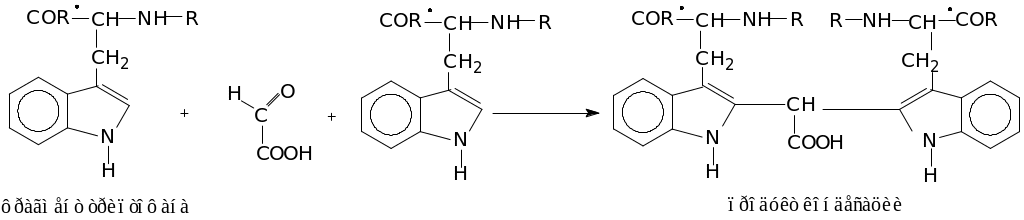
5 Реакция на триптофан (реакция Адамкевича):
Реакция Адамкевича указывает на присутствие в белке аминокислоты триптофана. Реакция заключается в том, что триптофан, реагируя с глиоксилевой кислотой, присутствующей в виде примеси в концентрированной уксусной кислоте, дает окрашенные продукты конденсации.
Концентрированная серная кислота принимает участие в реакции в качестве водоотнимающего средства. Реакция идет по схеме:
6 Реакция на аминокислоты, содержащие слабосвязанную серу (реакция Фоля):
Реакция Фоля
указывает на присутствие в белке
аминокислот цистеина и цистина, содержащих
слабосвязанную серу. Химизм реакции
состоит в том, что при кипячении белка
со щелочью цистеин и цистин отщепляют
серу в виде
![]() ,
который с плюмбитом дает черный или
бурый осадок сульфида свинца, по схеме:
,
который с плюмбитом дает черный или
бурый осадок сульфида свинца, по схеме:
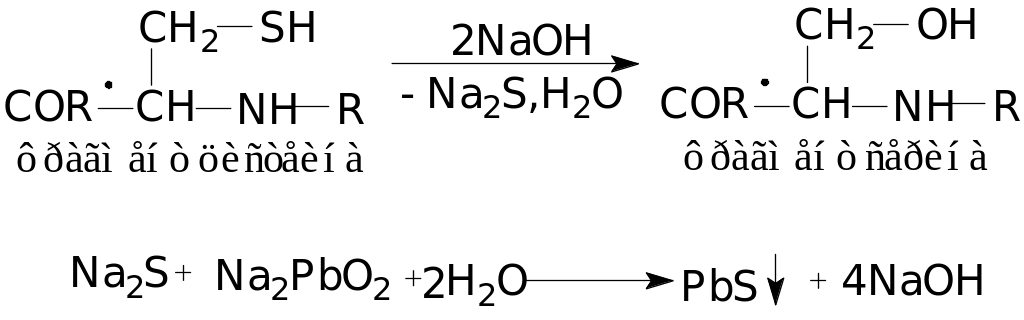
7 Реакция на аргинин:
Аргинин в присутствии - нафтола окисляется гипобромитом, теряя при этом одну аминогруппу. Окисленный аргинин, соединяясь с - нафтолом, образует вещество красного цвета, которое предположительно имеет строение:

Белки, содержащие в составе аргинин, дают красное окрашивание с гипобромитом или гипохлоридом и - нафтолом в щелочной среде.
Б) Гидролиз белка
Гидролиз белков широко применяется в промышленности для получения природных -аминокислот. Осуществляется с помощью горячих минеральных кислот (соляная, серная) или ферментов, по уравнению:
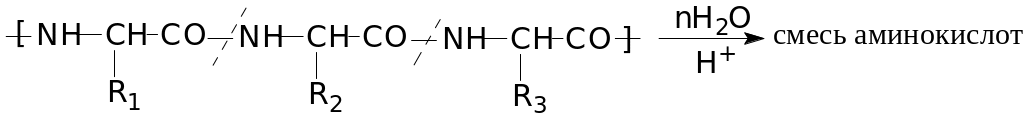
Гидролиз – один из тех процессов, который идет практически непрерывно, начиная со стадии хранения пищевых продуктов, приготовления и в готовой продукции. Разница лишь в скорости этой реакции и катализаторах.
На стадии хранения пищевого сырья эту реакцию катализируют как ферменты (протеазы), так и органические кислоты сырья. При температурной обработке ферменты деструктируются (>80), а на смену им вступают в действие кислые катализаторы (кислоты).
Процесс ускоряется в десятки раз за счет высокой температуры, гидролизуя белок до исходных аминокислот и олигопептидов, облегчая тем самым, будущий процесс пищеварения.
Частичный гидролиз белка мы наблюдаем при тестоведении и получении ряда мясных и молочных продуктов.
Для промышленного гидролиза белка используют соляную кислоту (20%) или серную кислоты (35%). Процесс – длительный, около 20 часов. Щелочи для гидролиза, как правило, не используются, так как кислоты претерпевают значительные изменения.
