
- •Ароматичность
- •Взаимное влияние атомов в молекуле
- •Индуктивный эффект
- •Мезомерный эффект
- •Классификация органических реакций
- •Вопросы для самоконтроля:
- •Упражнения
- •Тесты для самостоятельной работы студентов Вариант 1
- •Вариант 2
- •Вариант 3
- •Вариант 4
- •Вариант 5
- •Ответы к тестам “ Взаимное влияние атомов в молекуле.”
- •Кислотность и основность органических соединений
- •Органические кислоты
- •Зависимость кислотности от гетероатома.
- •Влияние углеводородного радикала и присутствующих в нем заместителей
- •Влияние растворителя.
- •Основность органических соединений.
- •Факторы, влияющие на основность
- •Вопросы для самоконтроля
- •Упражнения
Влияние растворителя.
Взаимодействие молекул или ионов растворенного вещества с растворителем называется процессом сольватации. Стабильность аниона существенно зависит от его сольватации в растворе: чем больше ион сольватирован, тем он устойчивее, а сольватация тем больше, чем меньше размер иона и чем меньше делокализация в нем отрицательного заряда.
Основность органических соединений.
Органические соединения, в состав молекулы которых входят атомы азота, кислорода, серы, могут выступать в роли оснований, присоединяя протон водорода за счет неподеленной пары электронов на внешнем энергетическом уровне. Гетероатом в молекуле органического вещества, присоединяющий протон, называется центром основности.
Основания по Бренстеду делятся на n – основания и π – основания.
n – Основания могут быть нейтральными или отрицательно заряженными частицами. К ним относятся:аммониевые (R3N, R=NH, RCN), оксониевые (RC(O)R1, R-O-R1), сульфониевые (R-S-R1, RC(S)R1).
π-основания (алкины, алкены, диены, арены) в них центром основности являются электроны π-связи. Это очень слабые основания, так как протонируемые электронные пары несвободны.
Сила основания определяется стабильностью образующегося катиона (сопряженной кислоты). Чем стабильнее катион, тем сильнее основание.
Для количественной характеристики основности обычно используют величину pK BH+ - показатель константы основности сопряженной кислоты. Чем больше pK BH+, тем сильнее основание.
Факторы, влияющие на основность
Природа гетероатома в основном центре
Н3С - NH2 > Н3С - OH Н3С - OH > Н3С – SH
Сила оснований зависит от электроотрицательности гетероатома в основном центре. Чем больше ЭО атома, тем слабее основные свойства, поэтому спирты и простые эфиры являются более слабыми основаниями по сравнению с аминами.
Строение радикала, связанного с основным центром.
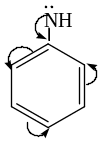 анилин Н3С
→ СН2
→ NH2 этиламин
анилин Н3С
→ СН2
→ NH2 этиламин
Алифатические амины проявляют более сильные основные свойства, чем ароматические. Объясняется это тем, что алкильные радикалы являются электронодонорами (электронная плотность на атоме азота повышается, что облегчает присоединение протона), а бензольное кольцо электроноакцептором (электронная плотность на атоме азота понижается, что затрудняет присоединение протона).
Электронодонорые заместители усиливают основные свойства, а электроноакцепторные – уменьшают, например:
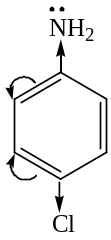 4-хлоранилин
4-хлоранилин  анилин
анилин 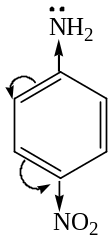 4-нитроанилин
4-нитроанилин
РКВН+ 5,1 4,6 1,0
уменьшение основности
Влияние растворителя
В водной среде важную роль играет уменьшение пространственных препятствий для гидратации, поэтому вторичные амины лучше гидратируются, чем третичные, которые пространственно труднодоступны.
H 3C
- NH – CH3
> H3C
– NH2
> H3C
- N – CH3
3C
- NH – CH3
> H3C
– NH2
> H3C
- N – CH3
CH3

основность уменьшается
В газовой среде основность возрастает с увеличением углеводородных радикалов, так как усиливается их стабилизирующее действие за счет +I-эффекта на катион сопряженной кислоты, поэтому третичные амины проявляют более сильные основные свойства по сравнению с другими аминами.
H 3C
- N – CH3
> H3C
- NH – CH3
> H3C
– NH2
3C
- N – CH3
> H3C
- NH – CH3
> H3C
– NH2
CH3
о сновность
уменьшается
сновность
уменьшается
