
Общая характеристика углерода.
Углерод является элементом IV группы второго периода. Электронное строение его атома - 1s22s22p2. Как видно, число электронов на валентном уровне совпадает с числом валентных орбиталей и это приводит к тому, что в соединениях с ковалентным характером связи атом углерода стремится быть четырехвалентным, образуя четыре ковалентных связи по обменному механизму. Это могут быть и -, и -связи, которые весьма прочны, как и у всех элементов II периода. У углерода нет особого предпочтения ни к тем, ни к другим.
У атома углерода среднее значение ЭО, поэтому для него очень характерно образование прочных гомоатомных связей. Эти связи - короткие и не дестабилизируются межэлектронным расталкиванием, как, например, у кислорода или азота. Отсюда - огромное разнообразие органических соединений.
Степени окисления углерода лежат в интервале от – 4 до + 4, и в этом диапазоне для углерода возможны все степени окисления, причем в одном и том же соединении атомы углерода могут иметь разные степени окисления. У углерода, подобно азоту, невозможно выделить самую устойчивую степень окисления.
Простые вещества. Физические свойства.
По содержанию в земной коре (0,14 ат.%) углерод уступает многим элементам. Тем не менее, углерод – главная составная часть животного и растительного мира. Он входит в состав каменного угля, нефти, природных газов, а также многих минералов: мел, мрамор, известняк CaCO3, магнезит MgCO3, доломит CaCO3·MgCO3, сидерит FeCO3, малахит (CuOH)2CO3 и др. В виде углекислого газа присутствует в воздухе.
Аллотропия углерода. В природе углерод встречается в виде четырех простых веществ различного строения – графит, алмаз (структуры которых представлены на рис.1), карбин и фуллерен.
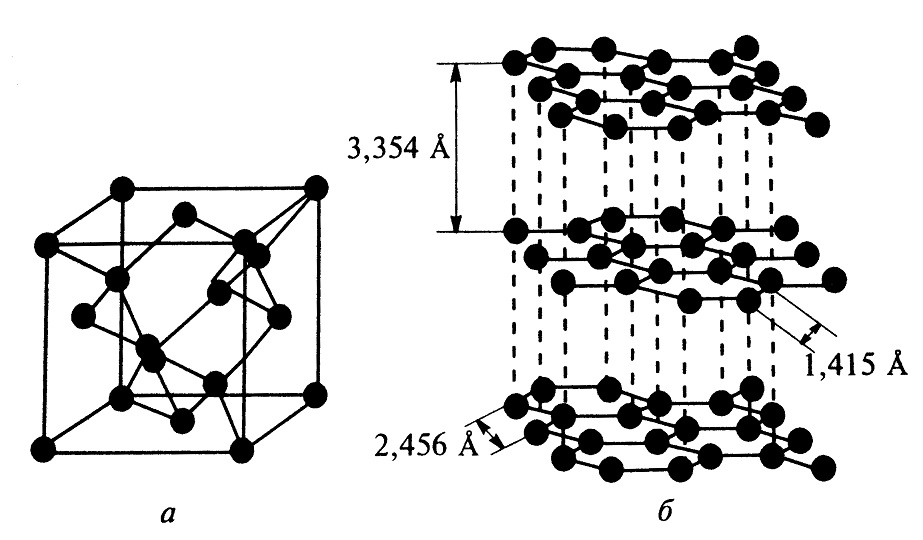
Рис.1 Кристаллические структуры алмаза (а) и графита (б)
Алмаз – бесцветное, прозрачное вещество с плотностью 3,5 г/см3. Он сильно преломляет лучи, не электропроводен, хрупок, плохо проводит тепло, является самым твердым из минералов. За счет sp3-гибридизации каждый атом в алмазе образует четыре равноценные и прочные ковалентные σ-связи с соседними атомами углерода, что объясняет высочайшую твердость и отсутствие электропроводности в обычных условиях.
Графит – мягкое слоистое кристаллическое вещество с гексагональной структурой, серовато-черного цвета, мягкий, жирный на ощупь, с плотностью 2,2 г/см3. Легко царапается ногтем и при трении оставляет черные полосы на бумаге. Хорошо проводит тепло и электрический ток, не пропускает свет, подобно металлам, отражая его своей поверхностью. Атомы углерода в графите находятся в вершинах правильных шестиугольников, расположенных в параллельных слоях. Расстояние между соседними слоями (93,4 Аº) больше, чем расстояние между атомами углерода в плоскости (1,415 Аº), поэтому связь между атомами внутри слоя гораздо прочнее, чем связь между атомами в различных слоях. sp2 – гибридное состояние «слоевых» атомов стабилизируется делокализованной π-связью, образованной оставшимися валентными электронами.
Карбин – черный мелкокристаллический порошок с плотностью 1,9 – 2 г/см3, обладает полупроводниковыми свойствами (ΔЕ ≈ 1 эВ). Под действием света его полупроводниковые свойства значительно возрастают. Решетка карбина гексагональная, построена из прямолинейных цепочек (Сn) двух типов, поэтому различают α-карбин (−С ≡ С−С ≡ С−) и β-карбин (=С=С=С=С=).
Фуллерены – эта аллотропная модификация углерода обнаружена в конце ХХ в. Шарообразные С60 или дынеобразные С70 полые молекулы, поверхность которых состоит из пяти- и шестиугольников из атомов углерода.
В парах углерод содержит двухатомные молекулы, которые при охлаждении разрушаются и переходят в твердую фазу с алмазоподобной структурой.
