
- •Курс лекций по дисциплине «Химия»
- •Омск- 2006 г. Оглавление
- •Периодическое изменение свойств атомов химических элементов
- •Общие представления о химической связи.
- •Характеристики химической связи.
- •Природа химической связи.
- •Типы связей.
- •Метод валентных связей
- •Понятие о методе молекулярных орбиталей
- •Первый закон термодинамики
- •Первое начало термодинамики
- •Энтальпия. Закон Гесса.
- •Тепловые эффекты химических реакций
- •Скорость химической реакции
- •Закон действующих масс.
- •Энергия активации химической реакции
- •Зависимость скорости реакции от катализатора
- •Фундаментальные постоянные
- •П.1. Наименование неорганических веществ
- •Общие понятия об электролизе.
- •Ионная теория электролиза.
- •Электролиз расплавов
- •Количественные законы электролиза.
- •Практическое значение электролиза.
Фундаментальные постоянные
Универсальная
газовая постоянная,
![]() 8,31441
8,31441
![]()
Постоянная
Авогадро,
![]() 6,022045
6,022045![]()
Постоянная
Больцмана,
![]()
![]()
Постоянная
Фарадея, F
9,648456![]()
Молярный объём идеального газа при нормальных
условиях
(273,15 К; 1 атм)
22,41383![]()
Постоянная
Планка
6,626176![]()
Атомная
единица массы
1,6605655![]()
Масса покоя протона 1,6726485
Масса покоя нейтрона 1,6749543
Масса
покоя электрона
9,109534![]()
Отношение массы протона к массе электрона 1836,15152
Элементарный
заряд
1б6021892
![]()
П.1. Наименование неорганических веществ
Таблица П.1.1.
Систематические и традиционные названия некоторых неорганических кислот и солей
Химическая формула |
Кислоты |
Соли |
|
Систематическое название |
Традиционное название |
Традиционное название |
|
H3BO3 B(OH)3 |
Тригидроксид бора |
Борная (ортоборная) |
Бораты (ортобораты) |
H2CO3* |
Триоксокарбонат (IV) водорода |
Угольная |
Карбонаты |
H2SiO3* |
Триоксосиликат (IV) водорода |
Метакремниевая |
Метасиликаты |
H2SiO4* |
Тетраоксосиликат (IV) водорода |
Ортокремниевая |
Ортосиликаты |
HNO2 |
Диоксонитрат (III) водорода |
Азотистая |
Нитриты |
HNO3 |
Триоксонитрат (V) водорода |
Азотная |
Нитраты |
HPO3 |
Триоксофосфат (V) водорода |
Метафосфорная |
Метафосфаты |
HPO4 |
Тетраоксофосфат (V) водорода |
Ортофосфорная |
Ортофосфаты |
H2P2O7 |
Гептаоксодифосфат (V) водорода |
Пирофосфорная |
Дифосфаты |
H3AsO4* |
Тетраоксоарсенат (V) водорода |
Мышьяковая |
Арсенаты |
H2O2 |
Диоксид диводорода |
Пероксид водорода |
Пероксиды |
H2S |
Сульфид водорода |
Сероводородная |
Сульфиды |
H2SO3* |
Триоксосульфат (IV) водорода |
Сернистая |
Сульфиты |
H2SO4 |
Тетраоксосульфат (VI) водорода |
Серная |
Сульфаты |
H2SO3S |
Триоксодисульфат (II) водорода |
Тиосерная |
Тиосульфаты |
HF |
Фторид водорода |
Фторводородная |
Фториды |
HCl |
Хлорид водорода |
Хлорводородная |
Хлориды |
HClO* |
Оксохлорат (I) водорода |
Хлорноватистая |
Гипохлориты |
HClO2* |
Диоксохлорат (III) водорода |
Хлористая |
Хлориты |
HClO3* |
Триоксохлорат (V) водорода |
Хлорноватая |
Хлораты |
HClO4 |
Тетраоксохлорат (VII) водорода |
Хлорная |
Перхлораты |
HBr |
Бромид водорода |
Бромводородная |
Бромиды |
HBrO* |
Оксобромат (I) водорода |
Бромноватистая |
Гипобромиды |
HBrO3* |
Триоксобромат (V) водорода |
Бромноватая |
Броматы |
HBrO4 |
Тетраоксобромат (VII) водорода |
Бромная |
Перброматы |
HI |
Иодид водорода |
Иодводородная |
Иодиды |
HIO* |
Оксоиодат (I) водорода |
Иодноватистая |
Гипоиодиты |
HIO3 |
Тироксоиодат (V) водорода |
Иодноватая |
Иодаты |
H5IO6 |
Гексаоксоиодат (VII) водорода |
Ортопериодная |
Ортопериодаты |
H2CrO4* |
Тетраоксохромат (VI) водорода |
Хромовая |
Хроматы |
H2Cr2O7* |
Гептаоксодихромат (VI) водорода |
Дихромовая |
Дихроматы |
HMnO4* |
Тетраоксоманганат (VI) водорода |
Марганцовая |
Перманганаты |
* - В свободном виде не выделена.
Лекция 11. Химические свойства металлов.
Взаимодействие металлов с простыми окислителями. Отношение металлов к воде, водным растворам кислот, щелочей и солей. Роль оксидной пленки и продуктов окисления. Взаимодействие металлов с азотной и концентрированной серной кислотами.
К металлам относятся все s-, d-, f-элементы, а также р-элементы, располагающиеся в нижней части периодической системы от диагонали, проведенной от бора к астату. В простых веществах этих элементов реализуется металлическая связь. Атомы металлов имеют мало электронов на внешней электронной оболочке, в количестве 1, 2, или 3. Металлы проявляют электроположительные свойства и обладают низкой электроотрицательностью, меньшей двух.
Металлам присуще характерные признаки. Это твердые вещества, тяжелее воды, с металлическим блеском. Металлы обладают высокой теплопроводностью и электропроводностью. Для них характерно испускание электронов под действием различных внешних воздействий: облучения светом, при нагревании, при разрыве (экзоэлектронная эмиссия).
Главным признаком металлов является их способность отдавать электроны атомам и ионам других веществ. Металлы являются восстановителями в подавляющем большинстве случаев. И это их характерное химическое свойство. Рассмотрим отношение металлов к типичным окислителям, к которым относятся из простых веществ – неметаллы, вода, кислоты. В таблице 1 приведены сведения об отношении металлов к простым окислителям.
Таблица 1
Отношение металлов к простым окислителям
Окислитель |
Реагируют |
Реагируют и пассивируют |
Не реагируют |
Основной продукт |
F2 |
Почти все |
Al, Fe, Ni,Cu, Zn – без нагревания |
- |
Фторид |
Cl2 |
Почти все |
Fe – в отсутствии влаги |
- |
Хлорид |
O2 |
Многие |
Al, Ti, Pb, Be, Mg – без нагревания |
Au, Pt |
Оксид |
S |
Многие, но при нагревании |
- |
Большинство (при нормальных условиях и охлаждении) |
Сульфид |
H2 |
Щелочные и щелочноземельные металлы |
- |
Большинство, но многие растворяют водород |
Гидрид |
N2 |
Li, щелочноземельные металлы |
- |
Почти все |
Нитрид |
С фтором реагируют все металлы. Исключение составляют алюминий, железо, никель, медь, цинк в отсутствии влаги. Эти элементы при реакции с фтором в начальный момент образуют пленки фторидов, защищающие металлы от дальнейшего реагирования.
При тех же условиях и причинах, железо пассивируется в реакции с хлором. По отношению к кислороду уже не все, а только ряд металлов образует плотные защитные пленки оксидов. При переходе от фтора к азоту (таблица 1) окислительная активность уменьшается и поэтому все большее число металлов не окисляется. Например, с азотом реагирует только литий и щелочноземельные металлы.
Отношение металлов к воде и водным растворам окислителей.
В водных растворах восстановительная активность металла характеризуется значением его стандартного окислительно-восстановительного потенциала. Из всего ряда стандартных окислительно-восстановительных потенциалов выделяют ряд напряжений металлов, который указан в таблице 2.
Таблица 2
Ряд напряжение металлов
Окислитель |
Уравнение электродного процесса |
Стандартный электродный потенциал φ0, В |
Восстановитель |
Условная активность восстановителей |
Li+ |
Li+ + e- = Li |
-3,045 |
Li |
Активный |
Rb+ |
Rb++ e- = Rb |
-2,925 |
Rb |
Активный |
K+ |
K++ e- = K |
-2,925 |
K |
Активный |
Cs+ |
Cs++ e- = Cs |
-2,923 |
Cs |
Активный |
Ca2+ |
Ca2++ 2e- = Ca |
-2,866 |
Ca |
Активный |
Na+ |
Na++ e- = Na |
-2,714 |
Na |
Активный |
Mg2+ |
Mg2++2 e- = Mg |
-2,363 |
Mg |
Активный |
Al3+ |
Al3++ 3e- = Al |
-1,662 |
Al |
Активный |
Ti2+ |
Ti2++ 2e- = Ti |
-1,628 |
Ti |
Ср. активности |
Mn2+ |
Mn2++ 2e- = Mn |
-1,180 |
Mn |
Ср. активности |
Cr2+ |
Cr2++ 2e- = Cr |
-0,913 |
Cr |
Ср. активности |
H2O |
2H2O+ 2e- =H2 +2OH- |
-0,826 |
H2, рН=14 |
Ср. активности |
Zn2+ |
Zn2++ 2e- = Zn |
-0,763 |
Zn |
Ср. активности |
Cr3+ |
Cr3++3e- = Cr |
-0,744 |
Cr |
Ср. активности |
Fe2+ |
Fe2++ e- = Fe |
-0,440 |
Fe |
Ср. активности |
H2O |
2H2O + e- = H2 +2OH- |
-0,413 |
H2, рН=7 |
Ср. активности |
Cd2+ |
Cd2++ 2e- = Cd |
-0,403 |
Cd |
Ср. активности |
Co2+ |
Co2++2 e- = Co |
-0,227 |
Co |
Ср. активности |
Ni2+ |
Ni2++ 2e- = Ni |
-0,225 |
Ni |
Ср. активности |
Sn2+ |
Sn2++ 2e- = Sn |
-0,136 |
Sn |
Ср. активности |
Pb2+ |
Pb2++ 2e- = Pb |
-0,126 |
Pb |
Ср. активности |
Fe3+ |
Fe3++3e- = Fe |
-0,036 |
Fe |
Ср. активности |
H+ |
2H++ 2e- =H2 |
0 |
H2, рН=0 |
Ср. активности |
Bi3+ |
Bi3++ 3e- = Bi |
0,215 |
Bi |
Малой активн. |
Cu2+ |
Cu2++ 2e- = Cu |
0,337 |
Cu |
Малой активн. |
Cu+ |
Cu++ e- = Cu |
0,521 |
Cu |
Малой активн. |
Hg22+ |
Hg22++ 2e- = Hg |
0,788 |
Hg2 |
Малой активн. |
Ag+ |
Ag++ e- = Ag |
0,799 |
Ag |
Малой активн. |
Hg2+ |
Hg2++2e- = Hg |
0,854 |
Hg |
Малой активн. |
Pt2+ |
Pt2++ 2e- = Pt |
1,2 |
Pt |
Малой активн. |
Au3+ |
Au3++ 3e- = Au |
1,498 |
Au |
Малой активн. |
Au+ |
Au++ e- = Au |
1,691 |
Au |
Малой активн. |
В данном ряду напряжений приведены также значения электродных потенциалов водородного электрода в кислой (рН=0), нейтральной (рН=7), щелочной (рН=14) средах. Положение того или иного металла в ряду напряжений характеризует его способность к окислительно-восстановительным взаимодействиям в водных растворах при стандартных условиях. Ионы металлов являются окислителями, а металлы – восстановителями. Чем дальше расположен металл в ряду напряжений, тем более сильным окислителем в водном растворе являются его ионы. Чем ближе металл к началу ряда, тем более сильным восстановителем он является.
Металлы способны вытеснять друг друга из растворов солей. Направление реакции определяется при этом их взаимным положением в ряду напряжений. Следует иметь в виду, что активные металлы вытесняют водород не только из воды, но и из любого водного раствора. Поэтому взаимное вытеснение металлов из растворов их солей происходит лишь в случае металлов, расположенных в ряду напряжений после магния.
Все металлы разделяют на три условные группы, что отражено в следующей таблице.
Таблица 3
Условное деление металлов
Металлы |
||
Активные |
Средней активности |
Малоактивные |
Li - Al |
Al – H2 |
H2 - Au |
Взаимодействие с водой. Окислителем в воде является ион водорода. Поэтому окисляться водой могут только те металлы, стандартные электродные потенциалы которых ниже потенциала ионов водорода в воде. Он зависит от рН среды и равен
φ = -0,059рН.
В нейтральной среде (рН=7) φ = -0,41 В. Характер взаимодействия металлов с водой представлен в таблице 4.
Металлы из начала ряда, имеющие потенциал, значительно более отрицательный, чем -0,41 В, вытесняют водород из воды. Но уже магний вытесняет водород только из горячей воды. Обычно металлы, расположенные между магнием и свинцом не вытесняют водород из воды. На поверхности этих металлов образуются оксидные пленки, которые обладают защитным действием.
Таблица 4
Взаимодействие металлов с водой в нейтральной среде
Н2О (окислитель Н+) |
||
Активные |
Средней активности |
Малоактивные |
Реагируют |
Реагируют, пассивируются: Al, Ti, Cr, Fe, Co, Ni, Zn, Sn, Cd, Pd |
Не реагируют |
Взаимодействие металлов с хлорводородной кислотой.
Окислителем в соляной кислоте является ион водорода. Стандартный электродный потенциал водородного иона равен нулю. Поэтому все активные металлы и металлы средней активности должны реагировать с кислотой. Только для свинца проявляется пассивация.
Таблица 5
Взаимодействие металлов с соляной кислотой
HCl (окислитель Н+) |
||
Активные |
Средней активности |
Малоактивные |
Реагируют |
Реагируют, реагируют и пассивируется Pb |
Не реагируют |
Медь может быть растворена в очень концентрированной соляной кислоте, не смотря на то, что относится к малоактивным металлам.
Взаимодействие металлов с серной кислотой происходит различно и зависит от её концентрации.
Взаимодействие металлов с разбавленной серной кислотой. Взаимодействие с разбавленной серной кислотой осуществляется так же, как и с соляной кислотой.
Таблица 6
Взаимодействие металлов с разбавленной серной кислотой
H2SO4 (разб.) (окислитель Н+) |
||
Активные |
Средней активности |
Малоактивные |
Реагируют |
Реагируют, реагируют и пассивируется Pb |
Не реагируют |
Разбавленная серная кислота окисляет своим ионом водорода. Она взаимодействует с теми металлами, электродные потенциалы которых ниже, чем у водорода. Свинец не растворяется в серной кислоте при её концентрации ниже 80%, так как образующаяся при взаимодействии свинца с серной кислотой соль PbSO4 нерастворима и создает на поверхности металла защитную пленку.
Взаимодействие металлов с концентрированной серной кислотой.
В концентрированной серной кислоте в роли окислителя выступает сера в степени окисления +6. Она входит в состав сульфат-иона SO42-. Поэтому концентрированной кислотой окисляются все металлы, стандартный электродный потенциал которых меньше, чем у окислителя. Наибольшее значение электродного потенциала в электродных процессах с участием сульфат-иона в качестве окислителя равно 0,36 В. Вследствие этого с концентрированной серной кислотой реагируют и некоторые малоактивные металлы.
Для металлов средней активности (Al, Fe) имеет место пассивация из-за образования плотных пленок оксидов. Олово окисляется до четырехвалентного состояния с образованием сульфата олова (IV):
Sn + 4 H2SO4 (конц.) = Sn(SO4)2 +2SO2 + 2H2O.
Таблица 7
Взаимодействие металлов с концентрированной серной кислотой
H2SO4 (конц.) (окислитель S+6 ) |
|||
Активные |
Средней активности |
Малоактивные |
|
реагируют |
реагируют, реагируют и пассивируются Al, Fe |
реагируют: Cu, Hg |
не реагируют: Ag, Au, Ru, Os, Rh, Ir, Pt |
Кислота восстанавливается в основном до следующих продуктов: |
|||
H2S |
S |
SO2 |
- |
Свинец окисляется до двухвалентного состояния с образованием растворимого гидросульфата свинца. В горячей концентрированной серной кислоте растворяется ртуть с образованием сульфатов ртути (I) и ртути (II). В кипящей концентрированной серной кислоте растворяется даже серебро.
Следует иметь в виду, что чем активнее металл, тем глубже степень восстановления серной кислоты. С активными металлами кислота восстанавливается в основном до сероводорода, хотя присутствуют и другие продукты. Например
Zn + 2H2SO4 = ZnSO4 + SO2↑ + 2H2O;
3Zn + 4H2SO4 = 3ZnSO4 + S↓ +4H2O;
4Zn +5H2SO4 = 4ZnSO4 = 4ZnSO4 +H2S↑ +4H2O.
Взаимодействие металлов с разбавленной азотной кислотой.
В азотной кислоте в качестве окислителя выступает азот в степени окисления +5. Максимальное значение электродного потенциала для нитрат-иона разбавленной кислоты как окислителя равно 0,96 В. Вследствие такого большого значения, азотная кислота более сильный окислитель, чем серная. Это видно из того, что азотная кислота окисляет серебро. Восстанавливается кислота тем глубже, чем активнее металл и чем более разбавлена кислота.
Таблица 8
Взаимодействие металлов с разбавленной азотной кислотой
HNO3 (разбавл.) (окислитель N+5 ) |
|||
Активные |
Средней активности |
Малоактивные |
|
реагируют |
реагируют, пассивируется Ti |
реагируют: Cu, Hg, Ag |
не реагируют: Au, Ru, Os, Rh, Ir, Pt |
Кислота восстанавливается в основном до следующих продуктов: |
|||
NH4NO3 |
N2, N2O |
NO |
- |
Взаимодействие металлов с концентрированной азотной кислотой.
Концентрированная азотная кислота обычно восстанавливается до диоксида азота. Взаимодействие концентрированной азотной кислоты с металлами представлено в таблице 9.
При использовании кислоты в недостатке и без перемешивания активные металлы восстанавливают её до азота, а металлы среднеё активности до монооксида углерода.
Таблица 9
Взаимодействие концентрированной азотной кислоты с металлами
HNO3 (конц.) (окислитель N+5 ) |
|||
Активные |
Средней активности |
Малоактивные |
|
реагируют |
реагируют, реагируют и пассивируются Al, Ti, Cr, Fe |
реагируют: Cu, Hg, Ag |
не реагируют: Au, Ru, Os, Rh, Ir, Pt |
Кислота восстанавливается, в основном, до NO2 |
|||
Взаимодействие металлов с растворами щелочей.
Щелочами металлы окисляться не могут. Это обусловлено тем, что щелочные металлы являются сильными восстановителями. Поэтому их ионы самые слабые окислители и в водных растворах окислительных свойств не проявляют. Однако в присутствии щелочей окисляющее действие воды проявляется в большей степени, чем в их отсутствие. Благодаря этому, в щелочных растворах металлы окисляются водой с образование гидроксидов и водорода. Если оксид и гидроксид относятся к амфотерным соединениям, то они будут растворяться в щелочном растворе. В результате пассивные в чистой воде металлы энергично взаимодействуют с растворами щелочей.
Таблица 10
Взаимодействие металлов с растворами щелочей
HO2 (окислитель Н+ ) + щелочь |
||
Активные |
Средней активности |
Малоактивные |
Реагирует только Ве |
Реагируют: Al, Zn, Sn, Pb |
Не реагируют |
Процесс растворения представляется в виде двух стадий: окисления металла водой и растворения гидроксида:
Zn + 2HOH = Zn(OH)2↓ + H2↑;
Zn(OH)2↓ + 2NaOH = Na2[Zn(OH)4].
Лекция 12. Гетерогенные окислительно-восстановительные реакции.
Двойной электрический слой. Возникновение скачков потенциалов на границе раздела фаз. Стандартные электродные окислительно-восстановительные потенциалы. Ряд напряжение металлов. Зависимость величины электродных потенциалов от концентрации растворов. Уравнение Нернста.
Двойной электрический слой. Возникновение скачков потенциалов на границе раздела фаз.
Рассмотрим систему из двух разнородных фаз. При их соприкосновении система приходит в неравновесное состояние. Согласно второму закону термодинамики система будет стремиться к равновесию. В результате возникает процесс, который сопровождается обменом заряженных частиц между фазами. Такой процесс приводит к тому, что по одну сторону от границы раздела появляется избыток заряда определенного знака, а по другую – его недостаток. Возникает двойной электрический слой (ДЭС). Он напоминает плоский конденсатор с заряженными обкладками. Значит, на границе раздела фаз электрический потенциал φ резко изменяется и наблюдается скачок потенциала ∆φ.
В общем случае могут иметь место следующие скачки потенциалов:
1. поверхностные потенциалы, возникающие на границе раздела вакуум-металл;
2. контактные потенциалы, возникающие на границе раздела двух разных металлов, то есть металл-металл;
3. электродные потенциалы, которые возникают на границе раздела металл – раствор его соли;
4. диффузионный потенциал, возникающий на границе раздела двух разных растворов электролита.
Контактный потенциал возникает на поверхности соприкосновения двух металлов. Он обусловлен разной концентрацией электронов проводимости в рассматриваемых фазах, определяется разностью работ выхода электрона, зависит от температуры и для некоторых пар металлов может достигать нескольких вольт. Абсолютную величину контактного потенциала определить невозможно. Поэтому используют его относительные значения, например контактный потенциал, относительно золота.
Диффузионный потенциал возникает на поверхности раздела двух растворов электролитов с одинаковым растворителем, но отличающиеся по виду электролита или по его концентрации. Такой потенциал возникает за счет различия абсолютных скоростей (подвижностей) ионов электролита. Например, в растворах нитрата серебра AgNO3 подвижность аниона NO3- выше, чем катиона Ag+. Диффузия растворенного вещества происходит в направлении убывания его концентрации. Вследствие этого граница раздела двух растворов AgNO3 заряжается отрицательно со стороны более разбавленного раствора и положительно со стороны раствора с большей концентрацией электролита. Возникает диффузионный ДЭС. По истечении определенного времени, скорости диффузии катионов Ag+ и анионов NO3- выравниваются. На границе раздела возникает равновесие, при котором ток отсутствует, а электролит диффундирует как единое целое в виде AgNO3. Установившуюся между растворами разность потенциалов называют равновесным диффузионным потенциалом φд. Измерить его абсолютное значение невозможно. На практике используют относительное значение.
Так как трудно учесть абсолютное значение диффузионного потенциала, то его стремятся максимально уменьшить. Для этого растворы электролитов разъединяют в пространстве и между ними помещают солевой мостик. Солевой мостик – это U-образная стеклянная трубка, внутри её находится раствор электролита, у которого подвижности ионов одинаковы, например, NaCl, NH4NO3. Электрическая проводимость на границах контакта растворов с солевым мостиком обеспечивается этими ионами, при этом возникают очень малые обратные по знаку диффузионные потенциалы, суммой которых пренебрегают.
Электродный потенциал φM/L возникает на границе металл – раствор электролита. При погружении металлической пластинники, с удаленной оксидной пленкой, в растворе электролита между металлом и раствором возникает ДЭС и скачок потенциала, называемый электродным потенциалом. Основная причина его возникновения – это движение ионов между поверхностью металла и раствором.
Следует отметить для этих явлений важную роль специфической адсорбции ионов и полярных молекул, а также выход электронного газа за границы кристаллической решетки металла.
Рассмотрим образование ДЭС при погружении металлической пластинки в воду или другой полярный растворитель. В этом случае происходят следующие процессы.
1. Катионы, расположенные в узлах кристаллической решетки металла, взаимодействуют на поверхности с полярными молекулами воды, которые ориентированы к катионам своими отрицательными полюсами. При сильном взаимодействии катионы отрываются от поверхности металла и переходят в жидкую фазу
М(т) → Мz+ (р) +Ze- (1).
Системой поглощается энергия, равная энергия связи катиона с кристаллической решеткой ЕМZ+. Образующийся избыток электронов заряжает поверхность металла отрицательно, а выходящие катионы заряжают граничащий с металлом слой воды положительно.
2. Катионы металла гидратируются полярными молекулами воды в объёме жидкой фазы
MZ+ (p) +nH2O → MZ+∙ nH2O (p) (2).
Системой выделяется энергия, равная энергии гидратации Ег. В соответствии с термодинамической системой знаков
ЕМZ+ > 0 и Ег < 0 (3).
Вышерассмотренные процессы 1 и 2 могут протекать одновременно (параллельно друг другу). В этом случае их описывают уравнением
М(т) + nH2O → MZ+∙ nH2O (p) + Ze- (4).
3. Концентрирование гидратированных катионов в граничном с поверхностью металла слое жидкости для компенсирования избыточного поверхностного заряда посредством электростатического взаимодействия. Таким образом, на границе металл – вода возникает обменный ДЭС и соответствующий ему скачок потенциала – электродный потенциал φM/L. С ростом данного потенциала φM/L все быстрее протекают обратные процессы, в результате которых происходит дегидратация ионов металла и их восстановление до атомов в соответствии с уравнением
MZ+∙ nH2O (p) + Ze- → М(т) + nH2O.
При определенном скачке потенциала возникает равновесие, описываемое уравнением
М(т) + nH2O ↔ MZ+∙ nH2O (p) + Ze- (5).
Данному равновесию отвечает равенство скоростей прямого и обратного процессов. В упрощенной форме ему соответствует выражение, в котором нет молекул воды. Такая форма записи рекомендована ИЮПАК и называется уравнением электродного процесса
MZ+ (p) + Ze- ↔ М(т) (6).
Электродный процесс, представленный в такой форме иногда называют потенциалопределяющим процессом.
При погружении металла в раствор его соли, который является электролитом, происходят сходные явления, но равновесие наступает при другом скачке потенциала. Для таких процессов характерно то, что
φM/L = φMZ+/M (7).
Равновесным электродным потенциалом φM/L = φMZ+/M называют скачок потенциала, установившийся между металлом и раствором электролита в условиях равновесия. Металл в растворе собственной соли может заряжаться как отрицательно (Al, Zn, Fe, Ni), так и положительно (Cu, Ag, Au).
Уравнение Нернста.
Уравнение было получено немецким физико-химиком В. Нернстом. Оно связывает электродный потенциал с природой металла, концентрацией его ионов в растворе и абсолютной температурой. Вывод уравнения основан на применении второго начала термодинамики к процессу (6). Для вывода уравнения рассмотрим металл, который представляет собой металлическую пластинку, опущенную в раствор своей соли. Такая система носит название металлический электрод.
Электрическая работа по переносу 1 моль катионов с поверхности металла в раствор или обратно равна произведению суммарного перенесенного заряда Z∙F на разность потенциалов φMZ+/M
Wэл = Z∙F ∙ φMZ+/M (8),
где Z – зарядовое число катиона или число электронов, принимающих участие в процессе; F- постоянная Фарадея, равная 96500 Кл/моль; φMZ+/M – электродный потенциал, В.
Согласно второму закону термодинамики, максимальная работа, совершаемая закрытой системой в изобарно-изотермическом процессе (то есть при Р, Т = const), равна убыли её энергии Гиббса
Wэл = -∆G (9).
Можно получить, используя уравнение изотермы химической реакции, что изменение энергии Гиббса в ходе процесса (6) равно
∆G = -RTlnKa0 + RTln(aM/aMZ+) (10),
где aM – относительная (отнесенная к стандартной) активность металла в кристалле;
aMZ+ - относительная активность ионов металла в растворе.
Из выражений (9) и (10) получаем
Wэл = -∆G = RTlnKa0 - RTln(aM/aMZ+) (11).
Приравнивая выражения для электрической работы (8) и (11), получаем после несложных преобразований уравнение Нернста для металлического электрода
φMZ+/M = (1/Z∙F)∙RTlnKa0 – (1/Z∙F)∙RTln(aM/aMZ+) (12).
Так как К0 – стандартная термодинамическая константа равновесия реакции, то при Т = const она является постоянной величиной. Поэтому для данного электрода первое слагаемое в выражении (12) является постоянной величиной. Его обозначают через
φ0М/MZ+ и называют стандартным электродным потенциалом.
Активность металла аМ в его кристалле для индивидуального вещества является стандартной активностью и равна 1, то есть
аМ = 1 (13).
Тогда получаем выражение для уравнения Нернста, используемое в практических расчетах
φMZ+/M = φ0MZ+/M + (RT/Z∙F)lnaMZ+ (14).
В разбавленных растворах электролитов коэффициенты активности ионов равны их концентрациям. Поэтому уравнение Нернста можно представить в следующем виде, если иcпользовать молярные концентрации ионов СМZ+
φMZ+/M = φ0MZ+/M + (RT/Z∙F)ln СМZ+ (15).
Таким образом, потенциал металлического электрода зависит от природы металла и от условий, в которых находится раствор. Зависимость электродного потенциала от природы характеризуется величиной φ0MZ+/M , которая представляет собой табличное значение стандартного потенциала. Данное значение обычно берут из справочников. Зависимость от температуры раствора и концентрации ионов в растворе определяется вторым слагаемым уравнения Нернста. Как видно из (15), потенциал металлического электрода увеличивается с ростом температуры и концентрации ионов металла в растворе.
Отметим, что иногда встречается выражение уравнения Нернста, имеющего вид
φMZ+/M = φ0MZ+/M + (0,059/Z)lgaMZ+ (16).
Данное уравнение получается при условии Т = 298 К; R = 8,31 Дж/(моль∙К); F = 96500 Кл/моль и замене натурального логарифма на десятичный.
В наиболее общем случае уравнение Нернста записывается для электродного процесса
Ox + Ze- ↔ Red (17),
где Ox – окисленная форма частиц, участвующих в реакции; Red – восстановленная форма частиц, участвующих в реакции. Уравнение Нернста для этого процесса записывается следующим образом
φOx/Red
= φ0Ox/Red
+
![]() ln (aOx/aRed)
(18).
ln (aOx/aRed)
(18).
Зависимость электродного потенциала от природы окислительно-восстановительной системы характеризуется величиной φ0Ox/Red, которую обычно находят из справочных таблиц, зависимость от температуры и активностей окисленной и восстановленной форм определяется вторым слагаемым из (18).
Потенциал окислительно-восстановительной системы увеличивается с ростом температуры и активности окисленной формы и уменьшается с ростом активности восстановленной формы.
Стандартные электродные окислительно-восстановительные потенциалы.
Абсолютное значение электродного потенциала металлического электрода φMZ+/M определить невозможно. Нельзя присоединить прибор к двойному электрическому слою и измерить данную величину. Поэтому используют для измерения метод сравнения, в котором измеряемый потенциал, определяют посредством сравнения с известным потенциалом. Выбирают электрод сравнения, потенциал которого принимают равным нулю и относительно него измеряют потенциалы всех других электродов. При выборе электрода сравнения необходимо учитывать наличие у него стабильности и воспроизводимости характеристик в широком диапазоне температур.
Таким условиям отвечает стандартный водородный электрод (рис. 1), у которого активность ионов водорода в растворе равна 1 моль/л и давление газообразного водорода над раствором составляет 101,3 кПа. В качестве твердой фазы в водородном электроде используют инертный металл – платину.
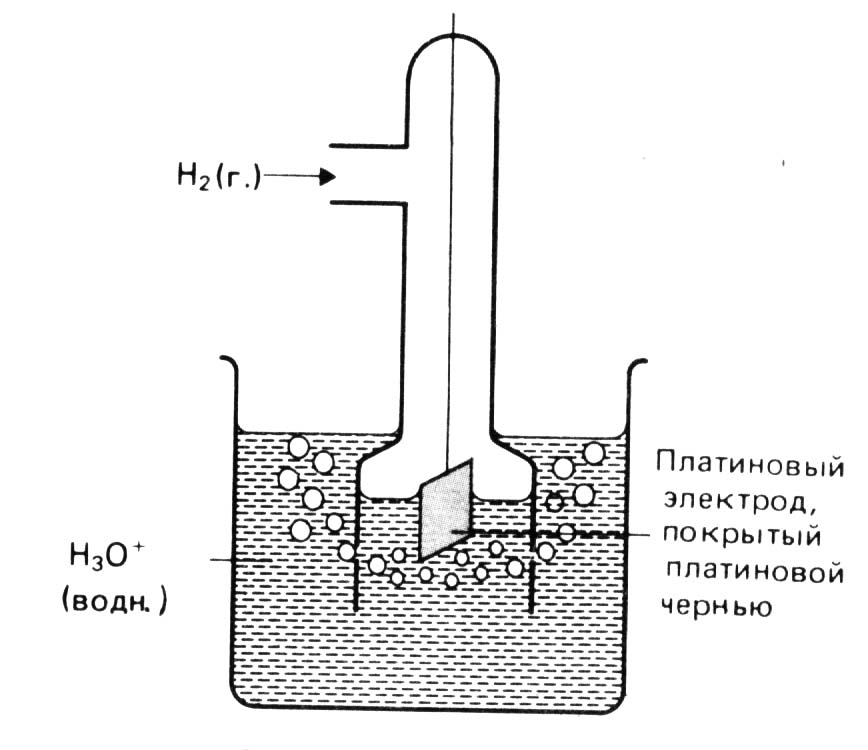
Рис. 1. Водородный электрод.
Конструктивно водородный электрод состоит из платиновой пластинки, покрытой платиновой чернью (которая представляет собой мелкозернистую платину), частично погруженной в раствор, содержащий ионы водорода. Такая платина инертна и обладает свойством адсорбировать водород. В качестве раствора используют нелетучие кислоты, обычно, такие как серная или хлорная кислоты. К пластинке подают газообразный водород под давлением 1 атм.
Сравнивая со стандартным водородным электродом, определяют стандартные потенциалы металлических электродов φ0MZ+/M . Полученные значения электродных потенциалов металлических электродов для разных веществ, выставляют в ряд (вертикальный или горизонтальный) в порядке возрастания значений. Таким образом, получают ряд стандартных электродных потенциалов или по-другому электрохимический ряд напряжений металлов.
Лекция 13. Химические источники тока.
Общее определение и понятие химического источника электрохимической энергии. Необратимые и обратимые гальванические элементы. Медно-цинковый гальванический элемент. Источники тока с электродами из различных металлов, концентрационные цепи, гальванические элементы с газовыми электродами. Аккумуляторы кислотные, щелочные, сухие аккумуляторные батареи. Топливные элементы.
Зависимость электродного потенциала от природы веществ учитывается величиной φ0. В связи с этим все электродные процессы принято располагать в ряд по величине их стандартных электродных потенциалов. Они для многих веществ измерены экспериментально и даны в справочниках.
Если расположить химические элементы в порядке относительной величины их стандартных электродных потенциалов, то получится ряд напряжений металлов или электрохимический ряд напряжений.
Общее определение и понятие химического источника электрохимической энергии. Гальванические элементы и химические источники тока (ХИТ). Необратимые и обратимые гальванические элементы.
Устройства, в которых осуществляется непосредственно преобразование энергии химической реакции в электрохимическую энергию называют химическими источниками электрической энергии или химическими источниками тока (ХИТ), или гальваническими элементами (ГЭ). Обычно гальваническими элементами называют такие ХИТ, в которых протекают практически необратимые реакции. Их нельзя перезаряжать, и они однократного действия.
ХИТ, в которых протекают обратимые (или почти обратимые) реакции, называют аккумуляторами.
Гальванический элемент – устройство, в котором создается электродвижущая сила (э.д.с.) в результате протекания химической реакции на его электродах, погруженных в раствор электролита. Гальванический элемент состоит из двух полуэлементов. В одном осуществляется окислительная полуреакция в другом восстановительная. Таким образом, действие гальванического элемента основано на протекании в нем окислительно-восстановительной реакции. Однако устройство гальванического элемента таково, что окислительно-восстановительная реакция пространственно разделена. Окисление протекает на одном электроде, обычно металлическом, а восстановление на другом. При таких конструктивных условиях электроны передаются от восстановителя к окислителю по внешней цепи. Этот направленный поток электронов – есть электрический ток. При протекании окисления на одном электроде и восстановления на другом будет постоянно генерироваться электроны во внешнюю цепь, если ее замкнуть.
Медно-цинковый гальванический элемент или гальванический элемент Даниэля – Якоби.
Классическим примером гальванического элемента является элемент Даниэля – Якоби или медно-цинковый гальванический элемент (рис. 2). Один из его полуэлементов состоит из цинкового электрода, погруженного в раствор сульфата цинка. Другой элемент состоит из медного электрода, опущенного в раствор сульфата меди. Оба раствора соприкасаются, но не перемешиваются друг с другом, за счет пористой мембраны между разными электролитами.
В левом полуэлемене происходит окисление цинка
![]() (1).
(1).
Так как на аноде всегда окисление, то цинковый электрод является анодом.
В правом полуэлементе происходит восстановление ионов меди
![]() (2).
(2).
Важно, что обе полуреакции протекают в месте соприкосновения цинка с раствором.
![]() (3).
(3).
Электроны непосредственно переходят от атомов цинка к ионам меди. Но так как в данной окислительно-восстановительной реакции, окислительная полуреакция пространственно отдалена от восстановительной, то электроны будут переходить от восстановителя к окислителю не через раствор, а по внешней цепи, по проводнику, например, металлическому.
Поэтому на катоде будет происходить восстановление ионов меди в соответствии с реакцией
![]() (4),
(4),
а на аноде окисление атомов цинка
![]() (5).
(5).
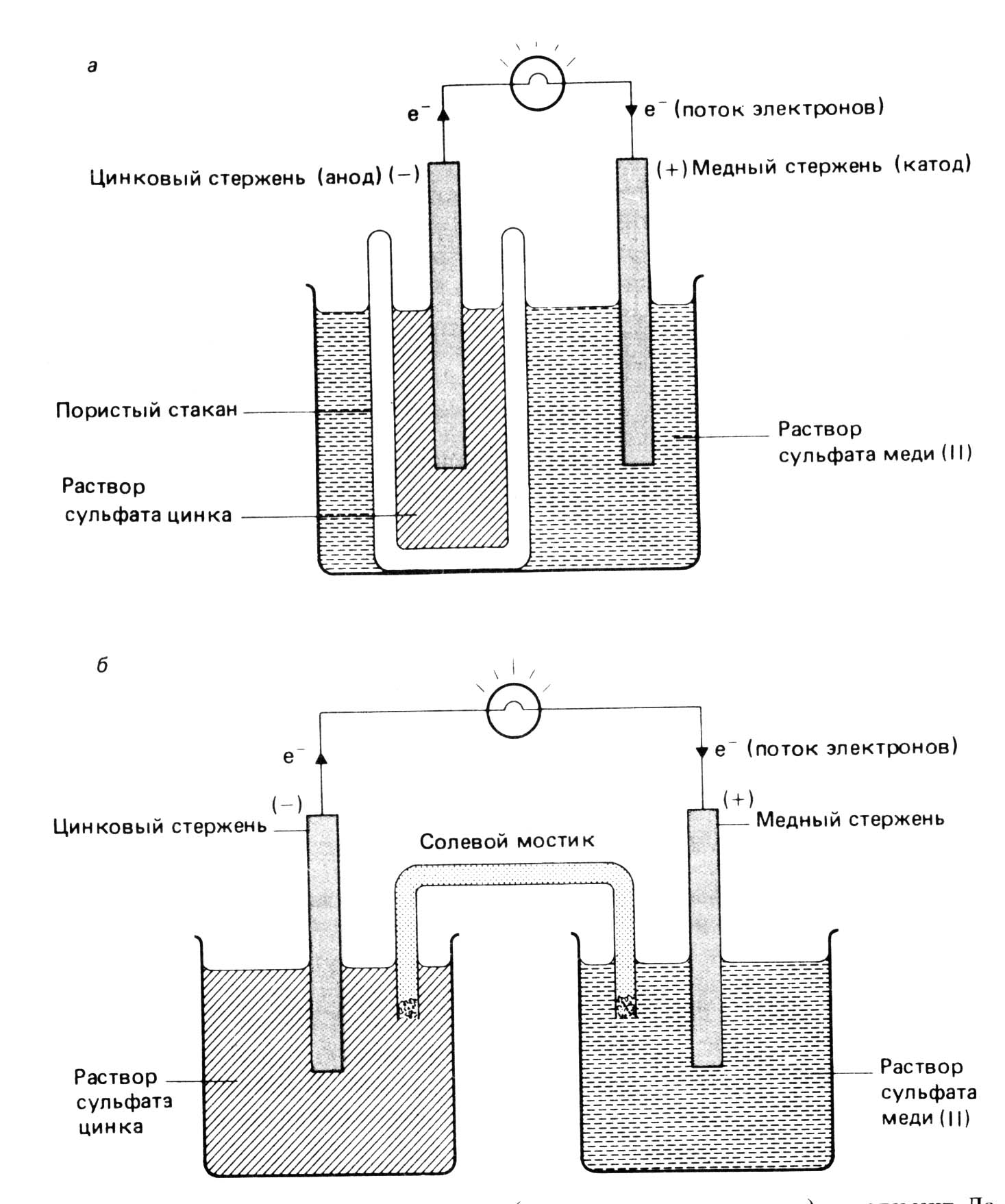
Рис. 2. Медно-цинковый гальванический элемент или элемент Даниэля-Якоби.
Таким образом, при работе гальванического элемента электроны от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в растворе наблюдается направленное движение ионов. Цинковый электрод является анодом, заряженным отрицательно, медный электрод является катодом, заряженным положительно. В любом гальваническом элементе на аноде происходит процесс окисления, на катоде – процесс восстановления.
Солевой мостик и типы полуэлементов.
Гальванические элементы, используемые в лабораториях, состоят из двух полуэлеменов, разделенных солевым мостиком. Солевой мостик представляет собой перевернутую U-образную трубку, в которой находится солевой раствор (рис.2). Обычно в качестве такого раствора берут водные растворы NH4NO3, KNO3, KCl. Трубка с концов закрыта ватой. В элементе Даниэля-Якоби роль солевого мостика выполняет пористый стакан.
В электрохимических системах имеют место разные схемы подключения электродов.
Знаки электродов противоположны в ХИТ знаком анода и катода в электролитической ячейке (рис. 3).
Электролитическая ячейка Электрохимическая ячейка,
(э.д.с. прикладывается к ячейке) химический источник тока
(э.д.с. вырабатывается источником)
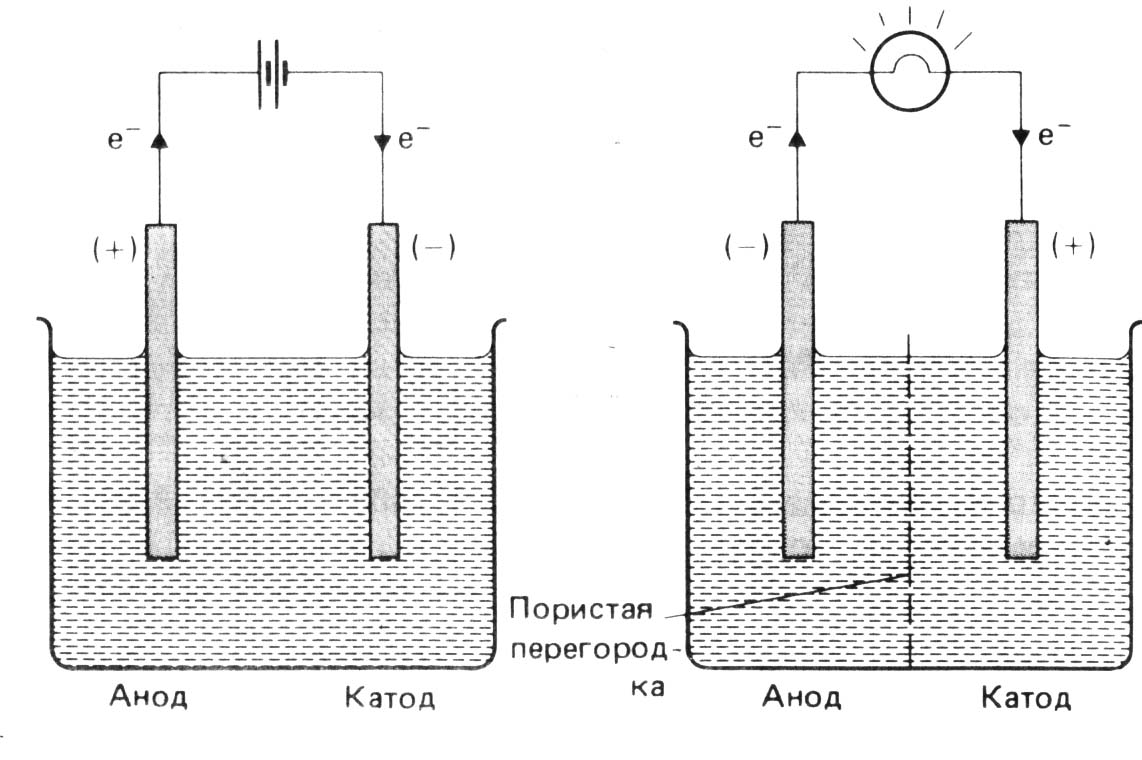
|
Электролитическая ячейка (э.д.с. прикладывается к ячейке) |
Электрохимическая ячейка – химического источника тока (э.д.с. вырабатывается источником) |
|
Анод Катод |
Анод Катод |
Знак |
+ – |
+ – |
Направление потока е- |
во внешней цепи из внешней цепи |
во внешней цепи из внешней цепи |
Полуреакция |
окисление восстановление |
окисление восстановление |
Рис. 3. Схемы подключения электродов.
Обычно используют особые записи химического источника тока и гальванического элемента. Для гальванического элемента, показанного на рис. 1 можно записать
![]() (6).
(6).
При такой записи используются следующие обозначения. Одна вертикальная черта │ означает поверхность раздела фаз металл-раствор. Две вертикальных черты ║ обозначают мембрану, пористую перегородку, пористый стакан или солевой мостик. Принято указывать в левой части анод (отрицательный электрод), то есть электрод, на котором происходит окисление, в правой части катод (положительный электрод) – электрод на котором происходит восстановление.
Типы полуэлементов.
Полуэлементы называют окислительно-восстановительными электродами, иногда окислительно-восстановительными парами. Наиболее распространенными являются следующие три полуэлемента: металл- ион металла, неметалл – ион, ион – ион.
Примером полуэлементов типа металл – ион металла являются электроды цинк – ион цинка и медь – ион меди (II). Примером полуэлемента неметалл – ион является водородный электрод. В таком полуэлементе между адсорбированным на твердой поверхности слоем молекул водорода и ионами гидроксония в растворе устанавливается равновесие:
 (7).
(7).
Схема водородного электрода

Полуэлемент типа ион – ион состоит из инертного электрода (например платины), погруженного в раствор, который содержит ионы одного и того же металла в двух разных состояниях окисления. Примером такого типа полуэлементов является система Fe3+ - Fe2+.
В этом полуэлементе устанавливается равновесие
![]() (8).
(8).
Схема полуэлемента запишется в виде:

ЭДС гальванических элементов.
Электрический ток, протекающий во внешней цепи гальванического элемента, может производить полученную работу. Работа электрического тока выражается произведением количества, прошедшего по цепи электричества на напряжение
W=FU,
W – полученная работа; U – напряжение между полюсами гальванического элемента; F=96485 Кл/моль ≈ 96500 Кл/моль – количество электричества, прошедшее по цепи при окислении одной молярной масс эквивалентов ионов Ме1 и одновременном восстановлении одной молярной массы эквивалентов ионов Ме2.
Эта работа зависит от силы тока, также как и напряжение. В случае обратимого протекания реакции (ОВР), то есть при бесконечно маленькой скорости, напряжение будет максимальным, и работа тоже (рассеяние тепла от тока будет маленьким).
Максимальное значение напряжения гальванического элемента, соответствующее обратимому протеканию реакции, называется электродвижущей силой гальванического элемента и обозначается E.
В общем случае при растворении (или выделении) 1 моль вещества, ионы которого имеют заряд n, максимальная полученная работа:
Wмакс =nFE.
Известно, что при Т=const, P=const
Wmax= –∆G,
где ∆G – изменение энергии Гиббса.
Поэтому можно записать
∆G= –nFE (9),
где Е - ЭДС.
Если соблюдаются стандартные условия, то ЭДС гальванического элемента называется его стандартным ЭДС, которое обозначается через Е0. Для него справедливо
∆G0= –nFE0 (10).
Учитывая, что стандартное изменение энергии Гиббса реакции связано с константой равновесия КС выражением вида
∆G0= –RTlnKC (11),
то имеем полезную для практических работ формулу
RTlnKC=nFE0 (12).
Данная формула позволяет измерением E0 (ЭДС) определить стандартную энергию Гиббса G0 и константу равновесия окислительно-восстановительных реакций.
Принято ЭДС гальванического элемента представлять как разность двух электродных потенциалов φ, каждый из которых отвечает полуреакции, протекающей на одном из электродом
Е=φк – φа (13),
где φк – потенциал катода, φа – потенциал анода.
Так как для электродных потенциалов имеет место уравнение Нернста
![]() ,
,
то в силу (13), уравнение Нернста для ЭДС имеет следующий вид
![]() (14).
(14).
Сухие гальванические элементы.
Сухие гальванические элементы применяют в качестве источников питания для бытовой и радиоаппаратуры, переносных электрических фонарей. Все они имеют один и тот же принцип работы и различаются лишь химической природой электродов. Анодным электродом могут быть активные металлы Zn, Mg, Li, катодами – оксиды марганца, серебра, меди, хлориды свинца.
Среди сухих гальванических элементов самым распространенным является марганцево-цинковый элемент. Его условная запись имеет вид
(-) Zn │NH4Cl│C, MnO2 (+) (15).
В данном элементе анодом является цинковый электрод, катод изготовлен из смеси диоксида марганца с графитом. Смешивание диоксида марганца с графитом дает увеличение электрической проводимости. Электролитом является паста, состоящая из раствора хлорида аммония и загустителя - смеси муки с крахмалом.
На аноде и катоде рассматриваемого гальванического элемента, протекают следующие электродные реакции
(-) А: Zn → Zn2+ + 2e- (16)
(+) K: 2MnO2 + 2H2O + 2e- → MnO(OH) + 2OH (17).
При анодном окислении цинка образуется пленка труднорастворимого гидроксида
Zn2+ + 2OH- → Zn(OH)2 (18),
которая препятствует дальнейшему протеканию процесса на аноде. Поэтому для растворения гидроксида цинка применяют хлорид аммония, и в этом случае анодный процесс протекает по уравнению
2Zn + 4NH4Cl + 4OH- → [Zn(NH3)4]Cl2 + ZnCl2 + 4H2O + 4e- (19).
Суммарное уравнение токообразующей реакции имеет вид
2Zn + 4MnO2 + 4NH4Cl → 4MnO(OH) + ZnCl2 + [Zn(NH3)4]Cl2 (20).
Если заменить цинк магнием, имеющим меньшее значение стандартного электродного потенциала, то можно повысить напряжение сухого гальванического элемента. Также можно увеличить напряжение гальванического элемента, если использовать щелочной электролит, например, раствор KOH.
На основе сухих гальванических элементов выпускают батареи напряжением от 3 до 100 В, емкостью от 0,5 до 30 А∙час.
Недостатками сухих гальванических элементов является однократность использования и саморазрядка, понижающая напряжение и емкость.
Электрохимические аккумуляторы.
Аккумуляторами называют устройства, в которых происходит поэтапное преобразование электрической энергии в химическую, а также химической в электрическую. Они представляют собой агрегаты многоразового действия, сочетая в себе гальванический элемент и электролизер.
Процесс накопления химической энергии под действием вешнего постоянного тока называют зарядкой аккумулятора, а процесс превращения в электрическую энергию – зарядкой. При зарядке аккумулятор работает как электролизер, а при разрядке как гальванический элемент.
Рассмотрим свинцовые аккумуляторы, которые получили наибольшее распространение. Из свинца с примесью сурьмы отливают пластины ячеистой структуры. Их собирают в батареи и помещают в корпус из полипропилена. Предварительно в ячейки запрессовывают смесь оксида свинца (II) с глицерином, которая затвердевает в виде глицерата свинца. Свинцовые аккумуляторы называют также кислотными, так как электролитом в них является раствор серной кислоты. Оксид свинца (II) PbO при взаимодействии с H2SO4 превращается в сульфат свинца PbSO4, который при зарядке восстанавливается до свинца Pb на катоде и окисляется до оксида свинца (IV) PbO2 на аноде.
При разрядке аккумулятор работает как гальванический элемент. На его электродах протекают процессы
(-) А: Pb → Pb2+ + 2e- (21)
(+) K: PbO2 + 4H+ +2e- → Pb2+ + 2H2O (22).
Образующиеся катионы Pb2+ в среднекислотной среде связываются в малорастворимый сульфат свинца PbSO4, который оседает на поверхности электродов. С учетом этого электродные реакции имеют вид
(-) A: Pb(т) + SO42- (p) → PbSO4 (т) + 2е- (23)
(+) K: PbO2(т) + SO42- (р) + 4Н+(р) +2е- → 2PbSO4(т) + 2H2O (24).
Суммарная токообразующая реакция описывается уравнением
Pb(т) + PbO2(т) +2H2SO4(p) → 2PbSO4(т) +2H2O(p) (25).
Для расчета ЭДС аккумулятора используют выражение, которое получается из уравнения Нернста
Е
= 2,041 +
![]() lg{[a2(SO42-)
∙ a4(H+)]/
a2(H2O)}
(26),
lg{[a2(SO42-)
∙ a4(H+)]/
a2(H2O)}
(26),
где a(SO42-) – активность (концентрация) ионов SO42-, а(Н+) – активность ионов водорода;
a(H2O) активность молекул воды.
Из уравнения (26) видно, что с ростом активности (концентрации) H2SO4, увеличивается ЭДС, но при концентрации кислоты более 40 %, резко уменьшается электропроводность раствора и увеличивается растворимость свинца. Оптимальными являются 32 – 39 %-ные растворы H2SO4.
Достоинством свинцовых аккумуляторов является высокий кпд, достигающий 80 %, высокая ЭДС, устойчивость в работе. К недостаткам следует отнести малый срок службы (2 – 5 лет), токсичность свинца, выделение водорода при зарядке.
Кроме кислотных используются щелочные аккумуляторы, такие как никель-кадмиевые и никель-железные. Они более долговечны, срок службы достигает 10 лет. В этих аккумуляторах в качестве электролита используют раствор гидроксида калия KOH. Уравнение электродных процессов при разряде никель-кадмиевого аккумулятора имеют вид
(-) А: Cd(т) +2OH-(p) → Cd(OH)2(т) +2е- (27)
(+) K: 2NiO(OH)(т) + 2Н2О(р) +2е- → 2Ni(OH)2(т) +2ОН-(р) (28).
Суммарный токобразующий процесс имеет вид
Cd(т) + 2NiO(OH)(т) + 2Н2О(р) → Cd(OH)2(т) + 2Ni(OH)2(т) (29).
Топливные элементы.
Топливные элементы – это устройства непрерывного действия, в которых энергия сгорания топлива непосредственно превращается в электрическую энергию. Они относятся к первичным источникам тока. Окисление топлива происходит на поверхности электродов, материалом которого является графит, либо платина, серебро, никель. В качестве топлива (восстановителя) используется водород, гидразин, уголь, оксид углерода, различные углеводороды. Окислителем в топливных элементах обычно является кислород или воздух.
Для примера рассмотрим водородно-кислородный топливный элемент с щелочным электролитом. Электролитом является 30-40 %-ный раствор КОН.
Принцип работы такого топливного элемента основан на реакции окисления водорода
Н2 +0,5О2 → Н2О (30).
При этом химическая энергия окисления водорода превращается в электрическую. Катод и анод изготовлены из угля и металла платиновой группы. Данный металл является катализатором и имеет пористую структуру. К катоду подводится кислород или воздух, который восстанавливается до гидроксид-ионов. К аноду подается водород, окисляющийся до воды. Уравнения электродных процессов имеют вид
(-) A: 2H2 + 4OH- → 4H2O + 4e- (31)
(+) K: O2 + 2H2O +4e- → 4OH- (32).
Суммарная токобразующая реакция имеет вид
2Н2 + О2 → 2Н2О (33).
Обычное значение ЭДС топливных элементов составляет 1,0 – 1,5 В.
Лекция 14. Электролиз.
Химические процессы при электролизе. Последовательность разрядки ионов на электродах. Электролиз с нерастворимыми и растворимыми анодами. Электролиз расплавов. Количественные законы электролиза. Практическое значение электролиза.
