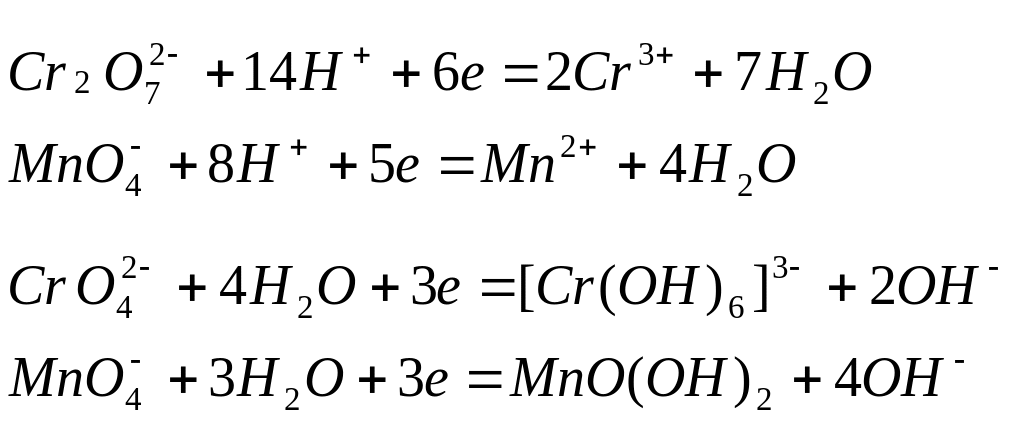- •Курс лекций по дисциплине «Химия»
- •Омск- 2006 г. Оглавление
- •Периодическое изменение свойств атомов химических элементов
- •Общие представления о химической связи.
- •Характеристики химической связи.
- •Природа химической связи.
- •Типы связей.
- •Метод валентных связей
- •Понятие о методе молекулярных орбиталей
- •Первый закон термодинамики
- •Первое начало термодинамики
- •Энтальпия. Закон Гесса.
- •Тепловые эффекты химических реакций
- •Скорость химической реакции
- •Закон действующих масс.
- •Энергия активации химической реакции
- •Зависимость скорости реакции от катализатора
- •Фундаментальные постоянные
- •П.1. Наименование неорганических веществ
- •Общие понятия об электролизе.
- •Ионная теория электролиза.
- •Электролиз расплавов
- •Количественные законы электролиза.
- •Практическое значение электролиза.
Энергия активации химической реакции
Химическое превращение происходит только, когда возникают условия для перераспределения электронной плотности столкнувшихся частиц. Этот процесс протекает во времени и требует затрат энергии. Рассмотрим взаимодействие газообразных веществ А2 и В2:
А2 (г)+ В2 (г) = 2АВ (г) (13).
Путь реакции можно охарактеризовать тремя последовательными состояниями системы:
А В А……В A - B
│ + │ → : : → + (14).
А В А…....В A - B
начальное состояние переходное конечное состояние
(исходные реагенты) состояние (продукты реакции)
(активированный
комплекс)
В переходном состоянии происходит перегруппировка атомов, сопровождающаяся перераспределением электронной плотности. Энергию, необходимую для перехода веществ в состояние активированного комплекса, называют энергией активации Гиббса.
Она определяется соотношением
G = H – TS
Поэтому аналогично запишем энергию активации Гиббса
∆G≠ = ∆H≠ - T∆S≠ (15),
где ∆H≠ - энтальпия активации реакции; Т – температура; ∆S≠ - энтропия активации реакции.
Образование активированного комплекса требует затраты энергии. Вероятность того, что при столкновении частиц образуется активированный комплекс и произойдет реакция, зависит от энергии сталкивающихся частиц. Реагируют только те из молекул, энергия которых для этого достаточна. Такие молекулы называются активными. Энергия, необходимую для перехода веществ в состояние активированного комплекса, называется энтальпией активации ∆H≠.
Важным условием осуществления химической реакции является энтропия активации ∆S≠. Она зависит от числа и ориентации молекул в момент столкновения.
Энергетические изменения в реагирующей системе можно представить на диаграмме, которая изображена на рис.
Разность энергий Гиббса начального и конечного состояний равна энергии Гиббса химической реакции ∆G. Согласно схеме, приведенной на рис. 2 в химическое взаимодействие вступают лишь те частицы, которые обладают необходимой энергией активации Гиббса ∆G≠.
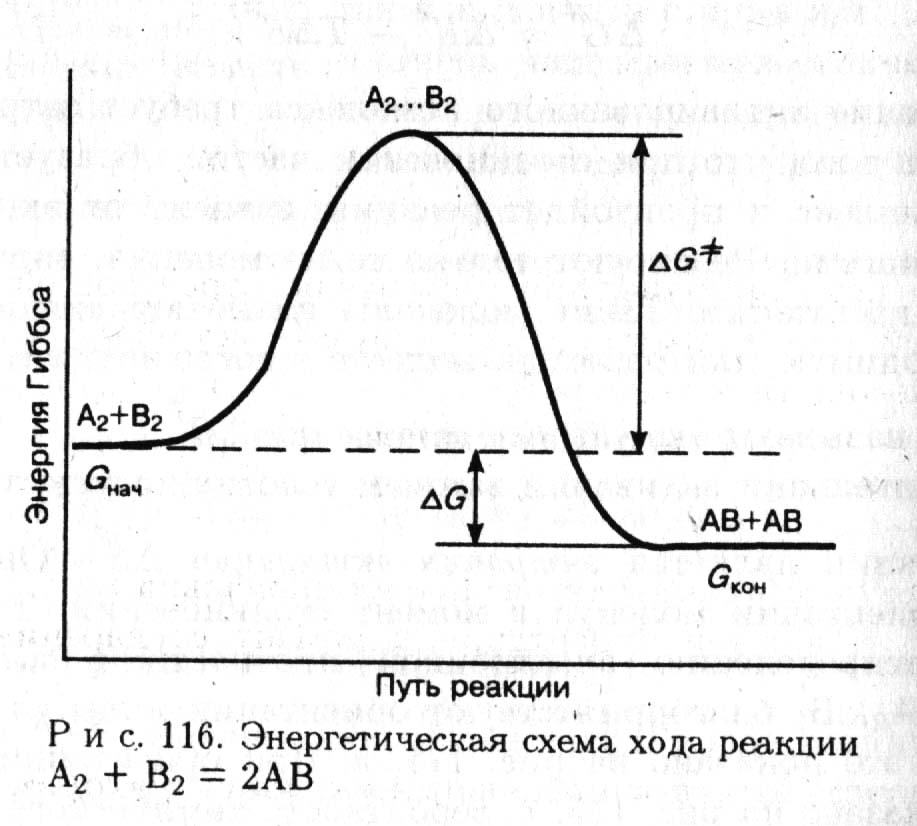
Рис. 2. Энергетическая схема хода реакции.
Зависимость скорости реакции от катализатора
В присутствии катализатора происходит изменение скорости химической реакции. Скорость в присутствии одних катализаторов увеличивается, в присутствии других замедляется.
Катализатор – вещество, участвующее в реакции и изменяющее её скорость, но остающееся неизменным после того, как химическая реакция заканчивается. Катализатор, замедляющий химическую реакцию, называют ингибитором. Биологические катализаторы белковой природы называют ферментами.
Механизм действия катализаторов связан с тем, что они образуют промежуточные соединения с исходными веществами и тем самым изменяют путь реакции, причем новый путь реакции характеризуется меньшей высотой энергетического барьера, то есть меньшей энергией активации по сравнению с некатализируемой реакцией (рис. 3).
Зависимость скорости реакции от катализатора

Рис.3. Механизм действия катализатора.
Лекция 7. Химическое равновесие.
Обратимые и необратимые реакции. Химическое равновесие. Константа химического равновесия. Принцип Ле-Шателье.
Обратимые и необратимые реакции. Химическое равновесие.
Все химические реакции разделяют на две группы: обратимые и необратимые. Когда при химическом взаимодействии хотя бы одно из веществ расходуется полностью, реакция считается необратимой. Она протекает до конца. К необратимым относят реакции между веществами, в результате которых образуются осадки, газы, и малодиссоциирующие вещества.
Обратимые реакции протекают не до конца. В них ни одно из реагирующих веществ не расходуется полностью. Необратимая реакция может протекать только в одном направлении. Обратимая реакция может протекать как в прямом, так и в обратном направлении.
Примером необратимой реакции является взаимодействие цинка с концентрированной азотной кислотой
Zn + 4HNO3 → Zn(NO3)2 + 2NO2↑ + 2H2O (1).
Данная реакция не может протекать в обратном направлении. Примером обратимой реакции является синтез аммиака
N2 +3H2 ↔ 2NH3 (2).
Реакция может
протекать как в прямом так и в обратном
направлении. Реакцию, протекающую слева
направо, называют прямой,
а протекающей справа налево – обратной.
Если в системе
скорость прямой реакции
![]() пр
равна скорости обратной реакции
пр
равна скорости обратной реакции
![]() обр,
то такое состояние называется
химическим равновесием.
На рис. 1
показано изменение скоростей прямой
(
пр)
и обратной (
обр,
то такое состояние называется
химическим равновесием.
На рис. 1
показано изменение скоростей прямой
(
пр)
и обратной (![]() обр)
реакции. В случае реакции (2) химическое
равновесие устанавливается между
азотом, водородом и аммиаком. Химическое
равновесие – это динамическое равновесие.
обр)
реакции. В случае реакции (2) химическое
равновесие устанавливается между
азотом, водородом и аммиаком. Химическое
равновесие – это динамическое равновесие.

Рис. 1. Химическое равновесие: равенство скоростей прямой и обратной реакций.
Таким образом, кинетическим условием химического равновесия является равенство скоростей прямой и обратной реакции:
пр= обр (3).
Константа равновесия.
Количественной характеристикой химического равновесия является константа химического равновесия. Величина, равная отношению произведения равновесных концентраций продуктов реакций к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов, называется константой равновесия химической реакции (обозначается через Кс). Для реакции
аА + вВ = сС + dD (4)
константа равновесия записывается в виде выражения
Kc
=
![]() (5)
(5)
где [ ] – равновесные концентрации.
Для реакции
Н2 (г) + I2 (г) = 2НI (г) (6)
константа равновесия равна
Кс
=
![]() (7).
(7).
Согласно закону действующих масс
пр = К1 С(Н2) ∙ С(I2)
обр = К2С2 (НI),
где С(Н2), С(I2) – концентрации водорода и иода в текущий момент времени.
При равновесии
пр= обр
С(Н2) = [Н2]
С(I2) = [ I2]
С(НI) = [НI].
Используя данные равенства, получаем
К1[Н2] ·[ I2] = К2[НI]2
или
![]() =
.
=
.
Таким образом, отношение констант скорости прямой и обратной реакции – есть константа равновесия, то есть
К1/К2 = Кс (8).
Поэтому константа равновесия Кс - есть постоянная величина, показывающая то соотношение между концентрациями продуктов реакции (числитель) и их веществ (знаменатель), которые устанавливаются при равновесии и при условии постоянства температуры. Численное значение Кс характеризует выход данной реакции. Выход реакции называется отношение количества получаемого вещества к тому его количеству, которое получилось бы при протекании реакции до конца. Если К > 1, то выход реакции велик, реакция смещена сильно вправо.
Уравнение константы равновесия (5) показывает, что в условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собой. Изменение концентрации любого из веществ – участников реакции, влечёт за собой изменения концентраций всех остальных веществ.
Константа равновесия так же, как и константы скоростей К1 и К2, зависят от природы реагентов, температуры и не зависит от исходных концентраций в системе. От присутствия катализатора константа равновесия Кс не зависит, так как катализатор изменяет энергию активации и прямой и обратной реакции на одну и ту же величину, но на их отношение К1/К2 он не оказывает влияния.
Концентрации газообразных веществ в (5) могут быть заменены равновесными парциальными давлениями этих веществ
Кр
=
![]() (9).
(9).
Если обратимая реакция протекает в гетерогенной системе, то Кр равна отношению равновесных парциальных давлений газообразных веществ и не зависит от количества веществ, находящихся в конденсированной фазе (твердой или жидкой).
Константа равновесия реакции связана со стандартным изменением энергии Гиббса выражением
∆Go = - RT lnКс (10)
или
Кс = ехр(-∆Go/RT) (11).
Данные выражения позволяют, зная ∆Go, вычислить Кс и наоборот по известному значению константы равновесия вычислить изменение энергии Гиббса.
Смещение химического равновесия. Принцип Ле-Шателье
Смещение химического равновесия может быть осуществлено как в сторону обратной реакции (влево), так и в сторону прямой реакции (вправо). На смещение химического равновесия влияют следующие факторы:
- изменение концентрации какого-либо из веществ, участвующих в реакции;
- изменение температуры;
- изменение давления.
Направление смещения химического равновесия определяется принципом Ле-Шателье. Он формулируется следующим образом:
Если на систему, находящуюся в равновесии, оказать внешнее воздействие, то равновесие реакции смещается в том направлении, которое ослабляет эффект внешнего воздействия.
По принципу Ле-Шателье, при изменении концентрации одного из участников реакции, равновесие сместиться в сторону, компенсирующую данное изменение. При повышении концентрации одного из исходных реагентов равновесие смещается в сторону прямой реакции (вправо), а при повышении концентрации одного из продуктов – в сторону обратной реакции (влево).
Если в обратимой реакции участвует хотя бы одно газообразное вещество, то смещение равновесия может быть вызвано изменением давления. При повышении давления (при постоянной температуре) происходит сжатие газа и повышение его концентрации. Поэтому равновесие смещается в направлении понижения концентрации газообразного компонента. Для реакции
А(г) + 2В(г) = С + D(г).
повышение давления приводит к смещению равновесия в сторону понижения концентрации газа, то есть в сторону образования газообразного продукта. При понижении давления реакция смещается в сторону повышения концентрации исходных газообразных реагентов.
Согласно принципу Ле-Шателье повышение температуры вызывает смещение равновесия в направлении того из процессов, течение которого сопровождается поглощением теплоты, а понижение температуры действует в противоположном направлении.
Так при повышении температуры равновесие экзотермической реакции (реакции, идущей с выделением теплоты, ∆Нто < 0) смещается в сторону обратной реакции, поскольку прямая реакция идёт с выделением тепла.
В случае эндотермической реакции (реакции, идущей с поглощением тепла,
∆Нто > 0), при повышении температуры равновесие смещается в сторону прямой реакции.
Изучение химического равновесия имеет большое значение. Определяя положение равновесия для различных температур и давлений, можно выбрать наиболее благоприятные условия проведения химического процесса. Подобрать такие условия осуществления химического равновесия, которые обеспечивают наибольший выход продуктов реакции при максимальной скорости его образования.
Лекция 8. Растворы
Типы растворов, термодинамика растворения. Растворимость. Растворение газов в жидкостях. Закон Генри. Пересыщенные растворы. Закон Рауля. Коллигативные свойства растворов. Дисперсные системы и коллоидные растворы.
Типы растворов, термодинамика растворения
Растворы имеют важное практическое значение в жизни и практической деятельности человека. Так, процессы усвоения пищи связаны с переводом питательных веществ в раствор. Растворами являются все физиологические жидкости, например, такие как кровь, лимфа. В основе многих производств лежат химические процессы, связанные с использование или производством растворов. Например, молочные продукты, творог, сметана, кефир, соки, напитки.
Молекулярным или истинным раствором называется гомогенная система, состоящая из двух и более компонентов. От молекулярных растворов следует отличать коллоидные растворы: суспензии, эмульсии, аэрозоли. Коллоидные от молекулярных растворов отличаются тем, что они представляют собой многокомпонентные гетерогенные системы. Примерами молекулярных растворов являются водный раствор хлористого натрия, воздух, сплав серебра с золотом. Уже из приведенных примеров видно, что типы растворов могут быть разные.
Растворы могут находиться в трех агрегатных состояниях: газообразном, жидком, твёрдом. Поэтому различают жидкие растворы, газовые растворы, твердые растворы. Раствор состоит из растворенного вещества и растворителя. Растворителем считают тот компонент, который находится в том же агрегатном состоянии, что и сам раствор. Если все компоненты находятся в одинаковом состоянии, то растворителем считается тот компонент, который находится в большем количестве. Очень большое распространение имеют водные растворы, в которых растворителем является вода, например: водный раствор соляной кислоты, водный раствор спирта.
Жидкие растворы обладают элементами кристаллической структуры. В них имеется ближний порядок, то есть каждая частица раствора окружена определенным числом других частиц, находящихся от данной на строго определенном расстоянии. Для более удаленных частиц этот порядок нарушается. Растворы, как и все жидкости, не обладают дальним порядком, который наблюдается в кристаллах.
Растворы занимают промежуточное положение между химическими соединениями и механическими смесями. Однородность раствора делает их очень сходными с химическими соединениями. Выделение теплоты при растворении некоторых веществ тоже указывает на химическое взаимодействие между растворителем и растворяемым веществом. Отличие растворов от химических соединений состоит в том, что состав раствора может изменяться в широких пределах. Кроме того, в свойствах растворах можно обнаружить многие свойства его отдельных компонентов, что не наблюдается у химических соединений. Непостоянство состава раствора приближает их к механическим смесям, но от последних они резко отличаются своей однородностью.
Раствор, находящийся в равновесии с растворяющимся веществом, называется насыщенным раствором. В таких растворах при заданной температуре не может раствориться большее количество растворенного вещества. Насыщенный раствор находится в динамическом равновесии с нерастворимой частью растворяемого вещества. Например, если поместить в воду избыточное количество хлорида натрия, образуется насыщенный раствор, в котором твердый хлорид натрия находится в динамическом равновесии с растворенным хлоридом натрия
NaCl
(тв.)
![]() NaCl(водн.).
NaCl(водн.).
Большинство кристаллов растворяется в жидкостях с поглощением теплоты, однако при растворении таких веществ, как гидроксид натрия NaOH, карбонат калия K2CO3, сульфат меди CuSO4 происходит заметное увеличение температуры раствора. Выделяется теплота, но в меньших количествах, при растворении некоторых жидкостей и всех газов.
Количество теплоты, которое поглощается или выделяется при растворении одного моль вещества, называется теплотой растворения этого вещества. При растворении кристаллов происходит их разрушение, что требует затрат энергии, поэтому растворение должно сопровождаться поглощением теплоты. Если наблюдается обратный эффект, то это говорит о том, что помимо растворения происходит взаимодействие между растворителем и растворенным веществом, в результате которого выделяется энергии больше, чем её расходуется на разрушение кристаллической решетки.
При растворении кристаллического вещества воде происходит сближение его частиц с дипольными молекулами воды, потенциальная энергия уменьшается, и теплота выделяется, то есть растворение сопровождается сжатием, которое рассматривается как уплотнение молекул растворителя вокруг каждой частицы растворяемого вещества. При этом частицы химически связываются с молекулами растворителя, образуя соединение, которое называется сольватом.
Совокупность молекул растворителя, окружающих частицу растворенного вещества, называется сольватной оболочкой. Взаимодействие молекул растворителя с частицами растворенного вещества называется сольватацией.
Если растворителем является вода, то сольватация называется гидратацией, а сольватную оболочку называют гидратной. Соединения молекул растворенного вещества с молекулами воды называются гидратами.
Гидраты, образующиеся в результате донорно-акцепорного взаимодействия, представляют собой частный случай комплексных соединений. Предположение о существовании в водных растворах гидратов было высказано и обосновано в 80-х годах 19 века Д.И. Менделеевым. Он считал, что растворение – это не только физический процесс, но и химический, что вещества, растворяющиеся в воде, образуют с ней соединения.
Гидраты, как правило, нестойкие соединения, во многих случаях разлагающиеся уже при выпаривании растворов. Но иногда гидраты так прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов. Вещества, в кристаллы которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода – кристаллизационной.
Растворимость.
Растворимостью называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества служит его содержание в насыщенном растворе при определенных условиях. Численно растворимость выражается теми же способами, что и состав. Например, процентное отношение массы растворенного вещества к массе насыщенного раствора, или количество растворенного вещества, содержащегося в 1 литре насыщенного раствора. Иногда для характеристики растворимости используют коэффициент растворимости. Коэффициентом растворимости называется число единиц массы безводного вещества, насыщающего при данных условиях 100 единиц массы растворителя.
Растворимость различных веществ в оде изменяется в широких пределах. Если в
100 г воды растворяется более 10 г вещества, то такое вещество считается хорошо растворимым. Если растворяется менее 1 г вещества, то его считают малорастворимым и, наконец, практически нерастворимым, если в раствор переходит менее 0,01 г вещества.
Обычно вещества, состоящие из полярных молекул, и вещества с ионным типом связи лучше растворяются в полярных растворителях (вода, спирты, жидкий аммиак), а неполярные вещества – в неполярных растворителях (бензол, сероуглерод). Это подтверждает эмпирическое правило «подобное растворяется в подобном».
Растворимость зависит от температуры. Для некоторых веществ такая зависимость имеет слабый характер. Например, растворимость нитратов калия, свинца, серебра (KNO3, Pb(NO3)2, AgNO3) в воде резко увеличивается с повышением температуры. Растворимость хлорида натрия (NaCl) в воде лишь незначительно изменяется по мере повышения температуры.
При растворении твердых тел в воде объём системы обычно изменяется незначительно. Поэтому растворимость твердых тел в воде практически не зависит от давления.
Жидкости могут растворяться друг в друге. Некоторые из них, например, спирт – вода, неограниченно растворимы, то есть смешиваются друг с другом в любых пропорциях. Есть жидкости, которые взаимно растворимы лишь до определенного предела, их называют частично смешивающимися. Если взболтать диэтиловый эфир с водой, то образуются два слоя: верхний представляет собой насыщенный раствор воды в эфире, а нижний – насыщенный раствор эфира в воде. Для таких систем с повышением температуры взаимная растворимость жидкостей увеличивается до тех пор, пока не будет достигнута температура, при которой обе жидкости смешиваются в любых пропорциях. Температура, при которой ограниченная взаимная растворимость жидкостей переходит в неограниченную, называется критической температурой растворения. Так, при температуре ниже 66,4 0С фенол ограниченно растворим в воде, а вода ограниченно растворима в феноле. Для системы вода – фенол температура 66,4 0С является критической температурой растворения, так как начиная с этой температуры и выше, обе жидкости неограниченно растворимы друг в друге.
Ограниченно растворимыми жидкостями являются следующие системы: нитробензол – н-гексан, триэтиламин – вода, никотин – вода.
Взаимное растворение жидкостей обычно не сопровождается значительными изменениями объёма, поэтому мало зависит от давления. Лишь при очень высоких давлениях порядка тысяч атмосфер взаимная растворимость жидкостей существенно возрастает.
Встречаются жидкости, которые полностью нерастворимы друг в друге, их называют несмешивающимися жидкостями. Если обе жидкости нерастворимы одна в другой, то при смешивании в любых пропорциях образуется два отдельных слоя. Примерами таких жидкостей являются следующие: ртуть – вода, дисульфид углерода – вода, хлорбензол – вода, фениламин – вода.
Если в систему, состоящую из двух несмешивающихся жидкостей, ввести третье вещство, способное растворяться в каждой из этих жидкостей, то растворенное вещество будет расперделяться между обеими жидкостями, пропорционально своей растворимости в каждой их них. Для таких систем выполняется закон распределения согласно которому:
вещество, способное растворяться в двух несмешивающихся растворителях, распределяется между ними так, что отношение его концентраций в этих растворителях при постоянной температуре остается постоянным, независимо от общего количества растворенного вещества
К(В) = с1В/с2В,
где с1В и с2В – концентрации растворенного вещества в первом и втором растворителях, К(В) – константа распределения вещества В между двумя несмешивающимися жидкостями.
Например, константа распределения йода между хлороформом и водой равна 130. Если к воде, содержащей растворенный йод, добавить несмешивающийся с нею хлороформ, взболтать эту систему и дать её отстояться, то после установления равновесия концентрация йода в хлороформе будет в 130 раз выше, чем в воде, независимо от общего количества растворенного йода. Таким образом, с помощью хлороформа можно извлечь из воды преобладающую часть растворенного в ней йода. Такой способ извлечения растворенного вещества из раствора с помощью второго растворителя, несмешивающегося с первым, называется экстракцией.
Закон распределения имеет ряд важных применений. Наиболее известные – это жидкофазная хроматография и экстракция.
Две несмешивающиеся жидкости иногда используют как селективные растворители для компонентов какой-либо смеси. Такую смесь сначала встряхивают с двумя несмешивающимися жидкостями, а затем отделяют одну жидкость от другой. Каждый слой по несколько раз подвергают экстракции с другим растворителем.
Например, данный способ используется для выделения солей урана из продуктов ядерного деления. Уранильную соль UO2(NO3)2 отделяют от NaCl с помощью бутанола и воды по методике противоточной экстракции. Известно, что уранильная соль лучше растворима в бутаноле, а хлористый натрий в воде. Один из растворителей пропускают над твердой смесью, находящейся в колонке. Затем над смесью в противоположном направлении пропускается другой растворитель. Для получения полного разделения этот процесс повторяют несколько раз.
Способы выражения концентрации растворов
Многие химические реакции протекают в растворах. Растворы – это гомогенные (состоящие из одной фазы) многокомпонентные смеси переменного состава. Растворы могут быть газообразными, жидкими и твердыми. Среди соединений, образующих раствор, условно выделяют растворенные вещества и растворитель. Растворителем принято считать компонент, который в чистом виде существует в том же агрегатном состоянии, что и образовавшийся раствор, или компонент, содержание которого в растворе выше содержания остальных компонентов, называемых растворенными веществами. Наибольшее практическое значение имеют жидкие растворы, в частности водные, в которых растворителем является вода.
Для выражения состава раствора и содержания растворенного вещества применяют различные способы.
1. Массовая
доля компонента
ωi
– отношение массы i-го
компонента mi
к массе раствора
![]()
![]() (11),
(11),
где ωi – безразмерная величина, принимающая значения от 0 до 1 или от 0 до 100 % (в последнем случае говорят о процентной концентрации).
2. Молярная
(мольная) доля
компонента Xi
– отношение числа молей i-го
компонента ni
к сумме молей
![]() всех
компонентов, образующих раствор,
безразмерная величина
всех
компонентов, образующих раствор,
безразмерная величина
![]() (12).
(12).
3. Моляльная концентрация, или моляльность, Сm – число молей n растворенного вещества, приходящихся на 1 кг растворителя, моль/кг:
![]() (13).
(13).
где m – масса растворенного вещества, г; М – молярная масса растворенного вещества, г/моль; mS –масса растворителя, кг.
4. Молярная концентрация, или молярность, С – число молей n растворенного вещества в 1 л раствора, моль/л, или сокращенно М:
![]() (14),
(14),
где V – объем раствора, л; m – масса растворенного вещества, г; М – молярная масса растворенного вещества, г/моль.
5. Молярная концентрация химического эквивалента, или нормальная концентрация, или нормальность, Сэкв – число молей химического эквивалента nэкв растворенного вещества в 1 л раствора, моль экв/л, или сокращенно н.:
![]() (15),
(15),
где Мэкв – молярная масса химического эквивалента растворенного вещества, г/моль экв; zэкв – число эквивалентности растворенного вещества; V – объем раствора, л; m – масса растворенного вещества, г; М – молярная масса растворенного вещества, г/моль.
6. Массовая концентрация, Смасс – масса растворенного вещества m в 1 л раствора, г/л:
![]() (16),
(16),
где V – объем раствора, л.
Можно применять и другие способы выражения состава раствора. Например, в справочниках растворимость данного вещества, т.е. состав насыщенного раствора, выражают как отношение массы растворенного вещества к массе растворителя.
При проведении химических реакций часто требуется использовать растворы определенной концентрации. Для приготовления раствора заданной концентрации взвешивают необходимую массу (отмеряют необходимый объем) чистых компонентов раствора. Также можно использовать более концентрированные растворы известной концентрации, в частности, фиксаналы – растворы, помещенные в герметичные ампулы заводского производства, содержащие строго определенное (обычно 0,1 моль) количество химического соединения.
При расчете массы (объема) компонентов раствора учитывают соотношения между различными способами выражения его состава, например, представленные в таблице 1 соотношения концентраций бинарного раствора, то есть раствора, состоящего из двух компонентов – растворителя и растворенного вещества.
Таблица 1
Соотношения между различными способам выражения состава бинарного раствора
Величина |
ω |
С |
Сэкв |
Сm |
Cмасс |
ω
С
Сэкв
Сm
Cмасс |
—
|
—
|
—
|
—
|
— |
Примечание: ρ – плотность раствора данного состава, г/л.
Растворение газов в жидкостях. Закон Генри.
Растворение газов воде представляет собой экзотермический процесс. Поэтому растворимость газов с повышением температуры уменьшается. При растворении газа в жидкости устанавливается равновесие
Газ + Жидкость ↔ Насыщенный раствор (1).
При этом объём системы существенно уменьшается. Следовательно, повышение давления должно приводить к смещению равновесия вправо, то есть к увеличению растворимости газа.
Генри сформулировал данную закономерность в более общем виде:
парциальное давление пара растворенного вещества над раствором пропорционально молярной доле растворенного вещества в растворе.
Данное утверждение называется законом Генри, математическая формула которого имеет вид:
P = kX (2),
где Р – давление, k – константа Генри, Х – мольная доля растворенного вещества.
Из закона Генри вытекает следствие:
объём газа, растворяющегося при постоянной температуре в данном объёме жидкости, не зависит от его парциального давления.
Газы подчиняются закону Генри при невысоких давлениях и в случае отсутствия химического взаимодействия между молекулами газа и молекулами растворителя.
Закон Генри играет важную роль в промышленности. При промышленном получении водорода с помощью процесса Боша для удаления диоксида углерода из водорода газообразную смесь этих газов пропускают под высоким давлением через воду. При давлении порядка 50 атм диоксид углерода хорошо растворяется в воде и почти полностью удаляется из водорода.
Другим примером является кессоннова болезнь. Это болезненное состояние возникает у водолазов, когда они слишком быстро поднимаются с глубины, где находились под повышенным давлением, на поверхность, где нормальное атмосферное давление. При подъёме и уменьшении давления происходит одновременное уменьшение растворимости азота в крови. Это приводит к выделению пузырьков азота в кровеносной системе, что вызывает сильные болевые ощущения. Более того, пузырьки азота препятствуют кровообращению в мелких кровеносных сосудах мозга и других частях тела. Во избежание кессонновой болезни водолазам приходится медленно подниматься с глубины на поверхность.
Пересыщенные растворы.
Растворимость большинства веществ уменьшается с понижением температуры. Поэтому при охлаждении горячих насыщенных растворов избыток растворенного вещества выделяется. Однако, если производить охлаждение осторожно и медленно, то выделения растворенного вещества из раствора не будет. В этом случае получится раствор, содержащий значительно больше растворенного вещества, чем его требуется для насыщения при данной температуре. Такие растворы называются пересыщенными. Такие растворы в спокойном состоянии могут оставаться годами без изменения. Но если в раствор бросить кристаллик того вещества, которое в нем растворено, то сразу же вокруг него начинают расти другие кристаллы и через короткое время весь избыток растворенного вещества выкристаллизовывается. Кристаллизация иногда начинается от простого сотрясения раствора. Очень легко образуют пересыщенные растворы глауберова соль (Na2SO4∙10H2O), тиосульфат натрия (Na2S2O3∙5H2O).
Закон Рауля. Коллигативные свойства растворов.
Коллигативными свойствами растворов называются такие их свойства, которые зависят только от концентрации частиц растворенного вещества, но не от его химического состава. Наиболее часто встречаются следующие четыре коллигативных свойства растворов:
1) понижение давления пара;
2) повышение температуры кипения;
3) понижение температуры замерзания;
4) осмотическое давление.
Все эти четыре свойства относятся к растворам, содержащим нелетучие растворимые вещества, то есть такие растворимые вещества, давление пара которых пренебрежимо мало.
При данной температуре давление насыщенного пара над жидкостью – есть величина постоянная. При растворении какого-либо вещества в данной жидкости давление насыщенного пара этой жидкости над раствором понижается. Давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре. Разность этих давлений получила название понижение пара над раствором.
В 1887 г. французский физико-химик Рауль установил закон, связывающий понижение давления пара над разбавленными растворами неэлектролитов с увеличением концентрации растворенного вещества. Он получил название закона Рауля:
относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества
( Р0 – Р)/Р0 = Х (3).
Следствием понижения давления насыщенного пара растворителя над раствором является повышение его температуры кипения по сравнению с чистым растворителем и понижение температуры его замерзания.
Всякая жидкость начинает кипеть при той же температуре, при которой давление её насыщенного пара достигает величины внешнего давления. Вода при давлении 101 кПА начинает кипеть при температуре 100 0С потому, что давление насыщенного пара равно 101 кПА. Поскольку при данной температуре давление насыщенного водяного пара над раствором будет ниже, чем над чистым растворителем, то при 100 0С раствор не закипает. Температура кипения водного раствора больше 100 0С, причем тем больше, чем выше концентрация раствора.
При замерзании жидкостей кристаллизация начинается при той температуре, при которой давление насыщенного пара над жидкой фазой становится равным давлению насыщенного пара над твердой фазой. Вода замерзает при 00С потому, что при этой температуре давление насыщенного пара воды над жидкостью и над льдом одинаково и равно 0,61 кПА.
Для разбавленных растворов повышение температуры кипения и понижение температуры замерзания не зависит от природы растворенного вещества и прямо пропорционально количеству вещества n:
∆Ткип = Кэ ∙ n (4),
где Кэ – эбуллиоскопическая постоянная, равная
Кэ = RT2/(1000∙λисп ) (5),
∆Тзам = Кк∙ n,
где Кк – криоскопическая постоянная, равная
Кк = RT2/(1000∙λплав ) (6),
где λисп, λплав – удельные теплоты испарения и плавления растворителя соответственно, Т – температура испарения и кипения растворителя.
Осмос – это самопроизвольный переход растворителя через полупроницаемую мембрану из разбавленного раствора или чистого растворителя в концентрированный раствор. Мембрана, пропускающая частицы растворителя, но не пропускающая частицы растворенного вещества, называется полупроницаемой мембраной. Примером такой мембраны является бычий пузырь. Полупроницаемая мембрана пропускает частицы растворителя в обоих направлениях. Но с той стороны мембраны, где концентрация раствора выше, концентрация растворителя ниже. Поэтому происходит результирующий переход растворителя в концентрированный раствор. Это приводит к установлению разности давлений по обе стороны мембраны, которое называется осмотическим давлением.
Осмотическое давление является коллигативным свойством, так как оно зависит только от концентрации растворенных частиц и не зависит от их химического состава. Для осмотического давления выполняется уравнение Вант-Гоффа.
π = cRT (7),
где π – осмотическое давление, с – концентрация раствора, Т – температура, R – газовая постоянная. Уравнение Вант-Гоффа является приближенным и справедливо только для разбавленных растворов.
Осмотическое давление играет важную роль в биологических системах. В организме животных некоторые клетки, например, эритроциты, содержат солевой раствор. Данные клетки окружены плазматической мембраной. В водной среде эритроциты подвергаются осмосу, набухают и лопаются. Однако, если они попадают в более концентрированный раствор соли, клетки сморщиваются.
Если давление, приложенное к концентрированному раствору, превышает осмотическое, то растворитель переходит из концентрированного раствора через мембрану в разбавленный раствор. Этот процесс называется обратный осмос. Его используют в промышленности для получения питьевой воды из морской.
Дисперсные системы и коллоидные растворы.
Ранее рассмотренные растворы, являются истинными или молекулярными растворами. Данные растворы представляют собой гомогенную смесь, состоящую из двух и более компонентов. Частицы из которых состоит раствор – это атомы, молекулы, ионы. Их размеры не превышают 5∙10-9 м.
Но есть растворы, в которых частицы растворенного вещества имеют микроскопические размеры порядка 0,1 - 0,2 мм и их видно невооруженным глазом, например, водный раствор сахара, растворенного не до конца. В этом случае раствор представляет гетерогенную систему. Он состоит из двух фаз - твердой и жидкой. Такие немолекулярные растворы очень распространены в природе и имеют общее название – дисперсные системы. Дисперсные системы состоят из прерывной фазы, называемой дисперсной фазой, и непрерывной фазы, называемой дисперсионной средой.
Примером дисперсной системы является суспензия. Суспензией (взвесью) называется гетерогенная смесь двух компонентов. Она состоит из более крупных частиц одного компонента, взвешенных в среде другого компонента. По истечении времени частицы суспензии осаждаются на дно. Взвешенные частицы имеют размеры порядка 10-6 м.
Дисперсные системы классифицируются по размеру дисперсных частиц. Такая классификация приведена в таблице 1.
Таблица 1
Классификация дисперсных систем по размерам
Система |
Раздробленность вещества |
Размер частиц, м |
Грубодисперсная |
Макроскопическая Микроскопическая |
10-2 – 10-4 10-4 – 10-7 |
Коллоидный раствор или ультрамикрогетерогенная система |
Коллоидная |
10-7 – 10-9 |
Молекулярные и ионные растворы |
Молекулярная и ионная |
10-9 – 10-10 |
Частным случаем дисперсной системы являются коллоидные растворы. Коллоидные растворы занимают промежуточное положение между молекулярными растворами и суспензиями. Коллоидные растворы отличаются от суспензии размерами диспергированных частиц. Коллоидные частицы имеют диаметр от 10-9 до 5∙10-7 м. Они не осаждаются по истечении большого промежутка времени, например, чернила. Примером коллоидного раствора является дым, фруктовое желе. Дым – это коллоидная дисперсия твердых частиц в воздухе. Дисперсная фаза дыма – твердые частицы. Непрерывная фаза – воздух. Разновидности коллоидных растворов приведены в таблице 2.
Таблица 2
Разновидности коллоидных растворов
Название коллоидного раствора |
Дисперсная фаза (раздробленная фаза) |
Дисперсионная среда (непрерывная фаза) |
Примеры |
Аэрозоль |
Жидкая |
Газообразная |
Туман, облака, дымка, распыленные краски. |
Аэрозоль |
Твердая |
Газообразная |
Дым, пыль |
Пена |
Газообразная |
Жидкая |
Взбитые сливки, мыльная пена |
Золь |
Твердая |
Жидкая |
Краски, взвесь гидроксида магния |
Твердый золь |
Твердая |
Твердая |
Сплавы |
Твердая пена |
Газообразная |
Твердая |
Полиуретан |
Эмульсия |
Жидкая |
Жидкая |
Молоко, майонез |
Гель |
Жидкая |
Твердая |
Желе, желатин |
Лекция 9. Растворы электролитов.
Электролиты. Теория электролитической диссоциации Аррениуса. Степень электролитической диссоциации. Особенности растворов электролитов. Степень и константа диссоциации. Слабые электролиты. Активность и коэффициент активности. Ионное произведение воды. Водородный показатель. Произведение растворимости. Гидролиз солей. Различные случаи гидролиза. Степень и константа гидролиза.
Электролиты.
Известно, что одни вещества проводят электрический ток, а другие не проводят. Вещества, которые распадаются на ионы и проводят электрический ток, называются электролитами. Вещества, которые в тех же условиях на ионы не распадаются и ток не проводят, называются неэлектролитами.
Электролит проводит электрический ток в результате того, что направленное перемещение его ионов создает поток электрических зарядов. Таким образом, пропускание электрического тока через электролит сопровождается переносом вещества.
Электролитами являются кислоты, основания и соли, находящиеся в расплавленном состоянии или в водном растворе.
Способность электролитов проводить электрический ток называется электролитической проводимостью. Она отличается от электронной проводимости металлов или других проводников электрического тока. В веществах с электронной проводимостью поток заряда обусловлен движением электронов. Поэтому пропускание электрического тока через проводники с электронной проводимостью не сопровождается переносом вещества.
Электролиты – это проводники второго рода. В растворе или расплаве они распадаются на ионы, благодаря чему и протекает электрический ток.
Распад электролитов на ионы при растворении их в воде называется электролитической диссоциацией.
Теория электролитической диссоциации Аррениуса.
Для объяснения особенностей водных растворов электролитов шведским химиком С. Аррениусом в 1887 г. была предложена теория электролитической диссоциации. Основные положения теории следующие:
1. Электролиты при растворении в воде распадаются на ионы – положительные и отрицательные. Ионы находятся в более устойчивых электронных состояниях, чем атомы. Среди таких ионов встречаются простые, например, Na+, Mg2+, Al3+ и сложные, состоящие из нескольких атомов, например, NO3-, SO42-, PO43-. В растворе ионы беспорядочно передвигаются в различных направлениях.
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные – к аноду. Первые называются катионами, а вторые анионами.
3. Диссоциация – обратимый процесс. Одновременно с распадом молекул на ионы протекает обратный процесс – соединения ионов в молекулу.
Поэтому в уравнениях электролитической диссоциации стоит не знак равенства, а знак обратимости ↔. Например, уравнение диссоциации молекулы электролита КА на катион К+ и анион А- записывается в виде
КА
![]() К+
+ А-
(1).
К+
+ А-
(1).
Теория электролитической диссоциации полностью согласуется с атомно-молекулярным учением и теорией строения атома.
Степень диссоциации электролитов
Под степенью диссоциации электролита понимается отношение числа диссоциированных на ионы молекул n к общему числу молекул растворенного электролита N, то есть
![]() (2).
(2).
В зависимости от степени диссоциации различают слабые и сильные электролиты. Сильные электролиты при больших концентрациях диссоциированы более чем на 1/2. Степень диссоциации слабых электролитов очень мала по сравнению с 1. Сильные электролиты – это большинство нейтральных солей, сильные кислоты (НСl, HClO4, H2SO4), сильные основания (NaOH, KOH). Слабые электролиты – это большинство органических кислот, неорганические слабые кислоты и слабые основания, некоторые нейтральные соли CdCl2, Fe(CH3COO)3. Особенно слабыми электролитами являются вода, сероводород, синильная и борная кислоты.
Между сильными и слабыми электролитами существует переходная группа, которую образуют соли тяжелых металлов, а также некоторые сильные органические кислоты: лимонная, щавелевая, муравьиная.
Степень диссоциации зависит от природы электролита и растворителя, а также от концентрации электролита. С уменьшением концентрации степень диссоциации увеличивается, а при сильном разведении раствора, а→1, и различия между сильно и слабодиссоциирующими электролитами сглаживаются.
Степень диссоциации зависит и от диэлектрической проницаемости растворителя ε. Чем больше диэлектрическая проницаемость, тем сильнее диссоциирует электролит. В воде электролитическая диссоциация может быть сильной, а в ацетоне и в особенности бензоле – слабой. Диэлектрическая проницаемость ε воды, ацетона и бензола соответственно равна 80, 21 и 2,3. Эта закономерность, установленная Нернстом и Томсоном в 1893 г., объясняется тем, что, согласно закону Кулона, сила притяжения между разноименно заряженными ионами обратно пропорциональна диэлектрической проницаемости ε.
Особенности растворов электролитов.
Поскольку при диссоциации число частиц в растворе увеличивается, растворы электролитов обладают аномальными коллигативными свойствами.
Уравнения, описывающие коллигативные свойства неэлектролитов, можно применить и для описания свойств идеальных растворов электролитов, если ввести поправочный изотонический коэффициент i Вант-Гоффа. Например,
π = icRT (3)
или
∆Тзам = iКкm (4).
Изотонический коэффициент i связан со степенью диссоциации
i
= 1 +
(![]() - 1)
(5),
- 1)
(5),
где - количество ионов, образующихся при диссоциации одной молекулы. Коэффициент i для различных солей различен. С разбавлением раствора он растет, приближаясь к целым числам 2, 3, 4. Для солей аналогичного состава эти числа одинаковы. Например, для всех солей, образованных одновалентными металлами и одноосновными кислотами при достаточном разбавлении их растворов изотонический коэффициент приближается к 2, для солей образованных двухвалентными металлами и одноосновными кислотами к 3.
Слабые электролиты. Константа диссоциации
В растворах слабых электролитов процесс диссоциации протекает обратимо и, следовательно, к нему может быть применен закон действующих масс. Так, для процесса диссоциации уксусной кислоты можно записать
![]() (6).
(6).
Поэтому константа равновесия КС будет равна:
 (7).
Константу равновесия для процесса
диссоциации называют константой
диссоциации КD.
Как и любая константа равновесия,
константа диссоциации зависит от природы
диссоциирующего вещества. С увеличением
температуры КD
обычно
уменьшается.
(7).
Константу равновесия для процесса
диссоциации называют константой
диссоциации КD.
Как и любая константа равновесия,
константа диссоциации зависит от природы
диссоциирующего вещества. С увеличением
температуры КD
обычно
уменьшается.
В соответствии с принципом Ле-Шателье температурная зависимость КD указывает на то, что процесс диссоциации является экзотермическим, то есть энергия гидратации ионов выше энергии внутримолекулярных связей.
Константа диссоциации указывает на прочность молекул слабых электролитов в данном растворе. Чем меньше константа диссоциации в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы.
Активность и коэффициент активности.
Свойства реальных
растворов описываются уравнениями, в
которых вместо концентраций вводится
активность. Активность
иона аi
выражается
в виде произведения концентрации иона
сi
на его коэффициент активности
![]() i
:
i
:
аi = i сi (8).
Экспериментально
определить активности катиона а+
и аниона а-
невозможно, так как они не существуют
по разделности. Поэтому вводится понятие
средней ионной активности а![]() .
Для электролита, образующего n+
катионов и n-
анионов
.
Для электролита, образующего n+
катионов и n-
анионов
a± = (a+n+ ∙a-n-)1/n (9),
где n = n+ + n-.
Аналогично определяется средний ионный коэффициент активности γ±
γ± = (γ+n+ ∙γ-n-)1/n (10).
Ионное произведение.
Электропроводность воды объясняется тем, что вода в очень малой степени диссоциирует, образуя ионы водорода и гидроксид-ионны:
![]()
Этот процесс равновесен и, как любой равновесный процесс, его можно охарактеризовать константой равновесия, которая является константой диссоциации:

При комнатной температуре на ионы распадается лишь одна из 108 молекул воды.
Концентрацию молекул воды можно рассчитать, разделив массу 1л воды на массу 1 моля:
![]()
В разбавленных растворах концентрация воды изменяется очень мало и ее можно считать постоянной, тогда
![]()
Так как
![]() – константа, то вносят в КD
и обозначают КW:
– константа, то вносят в КD
и обозначают КW:
![]() (11).
(11).
Эта величина называется ионным произведением воды и представляет собой постоянную величину при данной температуре.
В чистой воде при комнатной температуре концентрация ионов водорода и гидроксид-ионов равны между собой и равны 10–7моль/л. Следовательно:
![]()
Константа равновесия КW зависит от температуры и не зависит от концентрации катионов Н+ и анионов ОН–.
Если в воду добавить кислоту, то концентрация катионов водорода увеличится, равновесие сместится влево, а концентрация гидроксид-ионов уменьшится так, что ионное произведение воды останется неизменным.
Таким образом, в водных растворах, при постоянной температуре, концентрация катионов водорода и гидроксид-ионов связаны между собой. При расчетах для водных растворов сильных электролитов используют не концентрации, а активности:
![]()
Водородный показатель
Для характеристики кислотности (щелочности) среды введен специальный параметр – водородный показатель или рН. Водородным показателем или рН называют взятый с обратным знаком десятичный логарифм концентрации водородных ионов в растворе:
![]() (12).
(12).
Водородный показатель определяет характер реакции раствора. Например, при 295К она нейтральна и рН=7 (концентрация ионов водорода равна [Н+]=10–7моль/л). При рН<7 (концентрация ионов водорода [Н+] >10–7моль/л) реакция раствора кислая, при рН>7 (концентрация ионов водорода [Н+] <10–7моль/л) – щелочная. С изменением температуры величина ионного произведения воды КW изменяется.
Величина рН может служить критерием силы кислоты или основания. В ряду кислот будет сильной та, у которой при одинаковой молярной концентрации активность ионов Н+ выше (рН ниже). Для оснований подобная зависимость носит обратный характер.
Произведение растворимости.
Большинство веществ малорастворимо в воде, поэтому очень часто имеют дело с системами, в которых в состоянии равновесия находится осадок и насыщенный раствор электролита. Это равновесие носит динамический характер, вследствие чего скорость процесса растворения должна совпадать со скоростью его кристаллизации. При растворении электролита в воде, например, соли, в раствор переходят не молекулы, а ионы. Поэтому равновесие в насыщенном растворе устанавливается между твердой солью и перешедшими в раствор ионами.
Равновесие в насыщенном растворе электролита АmBn можно представить так:
![]()
Прямой процесс - это растворение осадка, а обратный процесс – это кристаллизация осадка из насыщенного раствора.
Выражение константы равновесия для этого процесса имеет вид
![]()
Концентрация
твердой соли
![]() является постоянной
величиной и поэтому её можно ввести в
константу равновесия
Кр.
Таким образом, получаем
является постоянной
величиной и поэтому её можно ввести в
константу равновесия
Кр.
Таким образом, получаем
Кр
=
![]() .
.
В насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Данная величина количественно характеризует способность электролита растворяться. Данную величину называют произведением растворимости
ПР = (13).
Следует иметь в виду, что произведение растворимости, вычисленное без учета коэффициента активности, является постоянной величиной только для малорастворимых электролитов и при условии, что концентрации других ионов, находящихся в растворе, малы.
Произведение растворимости зависит от природы растворенного вещества и растворителя, а также от температуры и не зависит от активности ионов малорастворимого электролита в растворе.
Произведение растворимости для большинства электролитов рассчитано и содержится в таблицах. Зная произведение растворимости, можно вычислить, выпадает ли в данных условиях вещество в осадок. Условием образования осадка малорастворимого электролита является превышение произведения активностей ионов этого электролита в растворе над табличной величиной произведения растворимости.
Если активность или концентрация одного из ионов малорастворимого электролита увеличится, то равновесие сместится, и, соответственно, активность или концентрация другого иона уменьшится.
Гидролиз солей. Различные случаи гидролиза. Степень и константа гидролиза.
Гидролиз соли – это обменное взаимодействие ионов соли с молекулами воды, приводящее к увеличению кислотности или щелочности раствора и образованию слабодиссоциируемых соединений.
Различают четыре случая взаимодействия соли и воды.
1. Соли, образуемые сильной кислотой и слабым основанием.
Соли этого типа при растворении в воде образуют кислый раствор. Примером может служить хлорид аммония NH4Cl. Уравнение реакции гидролиза данной соли имеет вид
NH4Cl + H2O NH4OH + HCl .
В ионной форме уравнение реакции гидролиза имеет вид
NH4+ + H2O NH4OH + H+.
Вследствие связывания ионов ОН- ионами аммония в слабодиссоциирующие молекулы NH4OH, в растворе появляется избыток водородных ионов и раствор становится кислым.
2. Соль образована слабой кислотой и сильным основанием.
Соли этого типа при растворении в воде образуют щелочной раствор. При гидролизе соли, образованной слабой кислотой и сильным основанием, образуется слабая кислота и избыток ионов гидроксила ОН-. Примером может служить гидролиз цианида калия, уравнение реакции имеет вид
KCN + H2O HCN + KOH
или в ионной форме
CN- + H2O HCN + OH-.
3. Соли, образуемые слабыми кислотами и слабыми основаниями. Данные соли почти полностью гидролизуются. Реакция гидролиза таких солей практически необратима. В качестве примера возьмем ацетат аммония CH3COONH4. Уравнение реакции гидролиза данной соли имеет вид
CH3COONH4 + H2O CH3COOH + NH4OH
или в ионной форме
CH3COO- + HN4+ + H2O CH3COOH + NH4OH.
При растворении в воде ион аммония реагирует как кислота, а ацетат-ион как основание. Поэтому водный раствор данной соли может быть слабокислым, слабощелочным или нейтральным в зависимости от концентрации ионов Н+, ОН-, образуемых в результате реакции катионов и анионов соли с водой. Это зависит от соотношения между константами диссоциации катиона и аниона.
4. Соль образована сильным основанием и сильной кислотой. К этой группе относятся такие соли как KCl, NaCl, NaNO3. Подобные соли гидролизу не подвергаются и растворы их остаются нейтральными. Например,
NaCl + H2O NaOH + HCl.
Таким образом, можно утверждать, что в рассмотренных случаях гидролизу подвергаются не всё количество, находящейся в растворе соли, а только часть её. При гидролизе устанавливается равновесием между солью и образующими её кислотой и основанием. Доля вещества, подвергающаяся гидролизу, называется степенью гидролиза. Степень гидролиза зависит от константы равновесия, температуры и концентрации соли.
Рассмотрим общее уравнение гидролиза:
MA + H2O HA+MOH (14),
где НА – кислота, МОН – основание, МА – соль.
Этому равновесию соответствует константа
![]() (15).
(15).
Так как [Н2О]=const, то можно ввести другую константу, равную КС ∙[H2O]. Если её обозначить через KГ, то
KГ = КС ∙[H2O].
Из выражения (15) следует, что
![]() (16).
(16).
Она называется константой гидролиза соли, KГ характеризует способность соли подвергаться гидролизу. Чем больше KГ , тем в большей степени протекает гидролиз.
Можно показать, что для случая соли, образованной слабой кислотой и сильным основанием
![]() (17).
(17).
Из данного выражения можно сделать следующий вывод:
константа гидролиза KГ тем больше, чем меньше константа кислотности кислоты KК, то есть, чем слабее кислота, тем в большей степени подвергается гидролизу ее соли.
Для соли, образованной слабым основанием и сильной кислотой
![]() (18),
(18),
где KО – константа основности основания.
Из данного выражения можно сделать вывод:
чем слабее основание, тем в большей степени подвергается гидролизу, образованные им соли.
Для солей, образованных слабой кислотой и слабым основанием:
![]() (19),
(19),
где КК, КО – константы гидролиза кислоты и основания.
Рассмотрим гидролиз солей образованных слабой многоосновной кислотой или слабым основанием многоосновного металла. Гидролиз таких солей происходит ступенчато.
Например, гидролиз карбоната натрия
1 ступень гидролиза:

Образовавшаяся кислая соль подвергается дальше гидролизу (2 ступень гидролиза).

Константа гидролиза
по первой ступени
![]() связана со второй константой диссоциации
кислоты, а константа гидролиза по 2-й
ступени
связана со второй константой диссоциации
кислоты, а константа гидролиза по 2-й
ступени
![]() – с первой константой диссоциации
кислоты:
– с первой константой диссоциации
кислоты:
![]()
![]() .
.
Так как
![]() >
>![]() ,
то
>
.
,
то
>
.
Из-за этого гидролиз по первой ступени всегда протекает в большей степени, чем по второй.
Гидролиз солей, образованных слабым основанием многовалентного металла, рассмотрим на примере гидролиза хлорида меди (II). Уравнение гидролиза данной соли имеет вид
1-я ступень 
2-я ступень (протекает в очень малой степени).
![]()
Как видно из (19),
особенно глубоко протекает гидролиз
солей, образованных слабой кислотой и
слабым основанием. Реакция растворов
солей, образованных слабой кислотой и
слабым основанием, зависит от состояния
констант протолиза кислоты и основания.
Если
![]() >
>![]() ,
то раствор будет иметь слабокислую
реакцию, если
>
,
то раствор будет иметь слабощелочную
реакцию.
,
то раствор будет иметь слабокислую
реакцию, если
>
,
то раствор будет иметь слабощелочную
реакцию.
Лекция 10. Окислительно-восстановительные реакции.
Общие понятия и определения. Классификация окислительно-восстановительных реакций. Влияние природы и концентрации реагентов, среды и других условий на глубину и направление протекания окислительно-восстановительных процессов. Составление уравнений окислительно-восстановительных реакций.
Общие понятия и определения окислительно-восстановительных реакций.
Все многообразие химических реакций можно свести к двум типам. Если в результате реакции степени окисления элементов не изменяются, то такие реакции называют обменными, в противном случае – окислительно-восстановительными реакциями.
Протекание химических реакций обусловлено обменом частицами между реагирующими веществами. Например, в реакции нейтрализации происходит обмен между катионами и анионами кислоты и основания, в результате образуется слабый электролит – вода:
![]()
Часто обмен сопровождается переходом электронов от одной частица к другой. Так, при вытеснении цинком меди в растворе сульфата меди (II)
![]()
электроны от атомов цинка переходят к ионам меди:

или
![]() .
.
Процесс потери электронов частицей называют окислением, а процесс приобретения электронов – восстановлением. Окисление и восстановление протекают одновременно, поэтому взаимодействия, сопровождающиеся переходом электронов от одних частиц к другим, называют окислительно-восстановительными реакциями.
Передача электронов может быть и неполной. Например, в реакции
![]()
вместо малополярных связей С—Н появляются сильнополярные связи Н—Сl. Для удобства написания окислительно-восстановительных реакций используют понятие степени окисления, характеризующее состояние элемента в химическом соединении и его поведении в реакциях.
Степень окисления – величина, численно равная формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому данного соединения.
Используя понятие степени окисления, можно дать более общее определение процессов окисления и восстановления. Окислительно-восстановительными называют химические реакции, которые сопровождаются изменением степеней окисления элементов участвующих в реакции веществ. При восстановлении степень окисления элемента уменьшается, при окислении – увеличивается. Вещество, в состав которого входит элемент, понижающий степень окисления, называют окислителем; вещество, в состав которого входит элемент, повышающий степень окисления, называют восстановителем.
Степень окисления элемента в соединении определяют в соответствии со следующими правилами:
степень окисления элемента в простом веществе равна нулю;
алгебраическая сумма всех степеней окисления атомов в молекуле равна нулю;
алгебраическая сумма всех степеней окисления атомов в сложном ионе, а также степень окисления элемента в простом одноатомном ионе равна заряду иона;
отрицательную степень окисления проявляют в соединении атомы элемента, имеющего наибольшую электроотрицательность;
максимально возможная (положительная) степень окисления элемента соответствует номеру группы, в которой расположен элемент в Периодической системе Д.И. Менделеева.
Степень окисления
атомов элементов в соединении записывают
над символом данного элемента, указывая
вначале знак степень окисления, а затем
ее численное значение, например
![]() .
.
Ряд элементов в соединениях проявляет постоянную степень окисления, что используют при определении степеней окисления других элементов:
фтор, имеющий наивысшую среди элементов электроотрицательность, имеет степень окисления -1;
водород проявляет степень окисления +1, кроме гидридов металлов (-1);
металлы IA подгруппы имеют степень окисления +1;
металлы IIA подгруппы, а также цинк и кадмий имеют степень окисления +2;
степень окисления алюминия +3;
степень окисления кислорода равна -2, за исключением соединений, в которых кислород присутствует в виде молекулярных ионов:
 - пероксидного аниона,
- пероксидного аниона,
 - озонидного аниона, а также фторидов
кислорода ОxF2.
- озонидного аниона, а также фторидов
кислорода ОxF2.
Окислительно-восстановительные
свойства атомов различных элементов
проявляются в зависимости от многих
факторов, важнейшие из которых –
электронное строение элемента, его
степень окисления в веществе, характер
свойств других участников реакции.
Соединения, в состав которых входят
атомы элементов с максимальной
(положительной) степенью окисления,
например,
![]() могут только восстанавливаться, выступая
в качестве окислителей. Соединения,
содержащие элементы с минимальной
степенью окисления, например,
могут только восстанавливаться, выступая
в качестве окислителей. Соединения,
содержащие элементы с минимальной
степенью окисления, например,
![]() могут
только окисляться и выступать в качестве
восстановителей.
могут
только окисляться и выступать в качестве
восстановителей.
Вещества, содержащие
элементы с промежуточными степенями
окисления, например,
![]() обладают
окислительно-восстановительной
двойственностью.
В зависимости от партнера по реакции
такие вещества способны и принимать
(при взаимодействии с более сильными
восстановителями), и отдавать (при
взаимодействии с более сильными
окислителями) электроны.
обладают
окислительно-восстановительной
двойственностью.
В зависимости от партнера по реакции
такие вещества способны и принимать
(при взаимодействии с более сильными
восстановителями), и отдавать (при
взаимодействии с более сильными
окислителями) электроны.
Состав продуктов восстановления и окисления также зависит от многих факторов, в том числе среды, в которой протекает химическая реакция, концентрации реагентов, активности партнера по окислительно-восстановительному процессу.
Чтобы записать уравнение окислительно-восстановительной реакции, необходимо знать, как изменяются степени окисления элементов и в какие другие переходят окислитель и восстановитель. Рассмотрим краткие характеристики наиболее часто употребляющихся окислителей и восстановителей.
Важнейшие окислители. Среди простых веществ окислительные свойства характеры для типичных неметаллов: фтора F2, хлора Cl2, брома Br2, йода I2, кислорода О2.
Галогены, восстанавливаясь, приобретают степень окисления -1, причем от фтора к йоду их окислительные свойства ослабевают (F2 имеет ограниченное применение вследствие высокой агрессивности):

Кислород, восстанавливаясь, приобретает степень окисления -2:

К наиболее важным окислителям среди кислородосодержащих кислот и их солей относятся азотная кислота HNO3 и ее соли, концентрированная серная кислота Н2SO4, кислородосодержащие кислоты галогенов ННаlOx и их соли, перманганат калия КМnО4 и дихромат калия К2Сr2O7.
Азотная кислота проявляет окислительные свойства за счет азота в степени окисления +5. При этом возможно образование различных продуктов восстановления:

Глубина восстановления азота зависит от концентрации кислоты, а также от активности восстановителя, определяемой его окислительно-восстановительным потенциалом:

Рис.1. Глубина восстановления азота в зависимости от концентрации кислоты.
Например, окисление цинка (активный металл) азотной кислотой сопровождается образованием различных продуктов восстановления, ни про концентрации HNO3 примерно 2 % (масс.) преимущественно образуется NH4NO3:
![]()
при концентрации HNO3 приблизительно 5 % (масс.) – N2O:
![]()
при концентрации HNO3 около 30 % (масс.) – NO:
![]()
а при концентрации HNO3 примерно 60 % (масс.) преимущественно образуется – NO2:
![]()
Окислительная активность азотной кислоты усиливается с ростом концентрации, поэтому концентрированная HNO3 окисляет не только активные, но и мало активные металлы, такие как медь и серебро, образуя преимущественно оксид азота (IV):

а также и неметаллы, такие как сера и фосфор, окисляя их до кислот, соответствующих высшим степеням окисления:
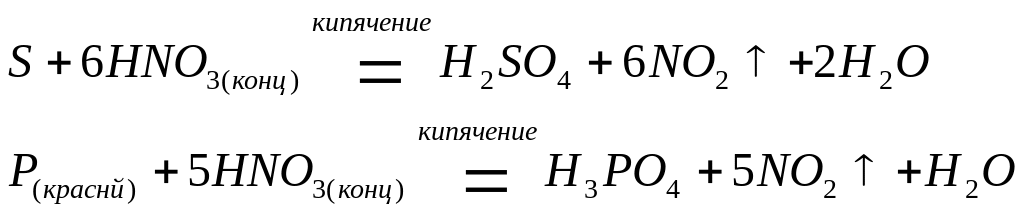
Соли азотной кислоты (нитраты) могут восстанавливаться в кислотной, а при взаимодействии с активными металлами и в щелочной средах, а также в расплавах:

Царская водка – смесь концентрированной и азотной кислот, смешанных в соотношении 1:3 по объему. Название этой смеси связано с тем, что она растворяет даже такие благородные металлы, как золото и платина:
![]()
Протекание этой реакции обусловлено тем, что царская водка выделяет нитрозилхлорид NOCl и свободный хлор Cl2:
![]()
под действием которых металлы переходят в хлориды.
Серная кислота проявляет окислительные свойства в концентрированном растворе за счет серы в степени окисления +6:

Состав продуктов восстановления определяется главным образом активностью восстановителя и концентрацией кислоты:

Рис.2. Восстановительная активность серы в зависимости от
концентрации кислоты.
Так, взаимодействие концентрированной Н2SO4 с малоактивными металлами, некоторыми неметаллами и их соединениями приводит к образованию оксида серы (IV):

Активные металлы восстанавливают концентрированную серную кислоту до серы или сероводорода:
![]()
при этом одновременно образуются Н2S, S и SO2 в различных соотношениях. Однако и в этом случае основным продуктом восстановления Н2SO4 является SO2 , так как выделяющиеся S и Н2S могут окисляться концентрированной серной кислотой:

Кислородосодержащие кислоты галогенов и их соли (см. табл. П.1.1) часто используют как окислители, хотя многие из них проявляют двойственный характер. Как правило, продукты восстановления этих соединений – хлориды и бромиды (степень окисления -1), а также йод (степень окисления 0);
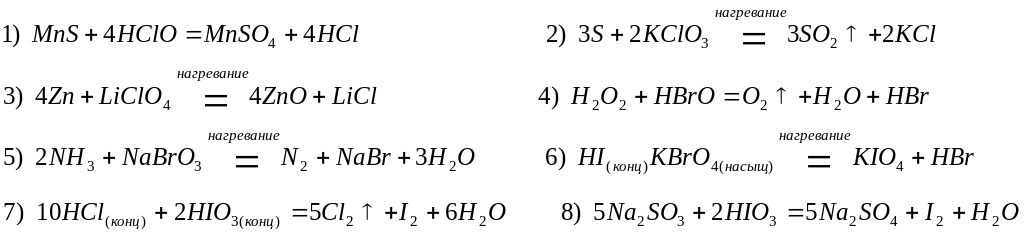
Однако и в этом случае состав продуктов восстановления зависит от условий протекания реакции, концентрации окислителя и активности восстановителя:

Перманганат
калия
проявляет окислительные свойства за
счет марганца в степени окисления +7. В
зависимости от среды, в которой протекает
реакция, он восстанавливается до разных
продуктов: в кислотной среде – до солей
марганца (II),
в нейтральной – до оксида марганца (IV)
в гидратной форме MnO(O)2,
в щелочной – до манганат-иона
![]()
кислотная среда

нейтральная среда

щелочная среда

Дихромат калия, в состав молекулы которого входит хром в степени окисления +6, является сильным окислителем при спекании и в кислотном растворе

проявляет окислительные свойства и в нейтральной среде
![]()
В щелочной среде равновесие между хромат- и дихромат-ионами
![]()
смещено в сторону
образования
![]() ,
поэтому в щелочной среде окислителем
является хромат
калия К2СrO4:
,
поэтому в щелочной среде окислителем
является хромат
калия К2СrO4:
![]()
однако К2СrO4 более слабый окислитель по сравнения с К2Сr2O7.
Среди ионов окислительные свойства проявляют ион водорода Н+ и ионы металлов в высшей степени окисления. Ион водорода Н+ выступает как окислитель при взаимодействии активных металлов с разбавленными растворами кислот (за исключением НNO3)
![]()
Ионы металлов в относительно высокой степени окисления, такие как Fe3+, Сu2+, Нg2+, восстанавливаясь, превращаясь в ионы более низкой степени окисления
![]()
или выделяются из растворов их солей в виде металлов
![]()
Важнейшие восстановители. К типичным восстановителям среди простых веществ относятся активные металлы, такие как щелочные и щелочно-земельные металлы, цинк, алюминий, железо и другие, а также некоторые неметаллы (водород, углерод, фосфор, кремний).
Металлы в кислотной среде окисляются до положительно заряженных ионов:
![]()
В щелочной среде окисляются металлы, проявляющие амфотерные свойства; при этом образуются отрицательно заряженные анионы или гидроксокомпаненты:

Неметаллы, окисляясь, образуют оксиды или соответствующие кислоты:

Восстановительными функциями обладают бескислородные анионы, например Cl-, Вr-, I-, S2-, Н- и катионы металлов в высшей степени окисления.
В ряду галогенид-ионов, которые, окисляясь, обычно образуют галогены:

восстановительные свойства усиливаются от Cl- к I-.
Гидриды металлов проявляют восстановительные свойства за счет окисления связанного с водородом (степень окисления -1) до свободного водорода:
![]()
Катионами металлов в низшей степени окисления, таким как Sn2+, Fe2+, Cu+, Hg22+ и другим, при взаимодействии с окислителями свойственно повышение степени окисления:

Окислительно-восстановительная двойственность. Среди простых веществ Окислительно-восстановительная двойственность характерна для элементов VIIA,VIA и VA подгрупп, которые могут как повышать, так и понижать свою степень окисления.
Часто используемые как окислители галогены под действием более сильных окислителей проявляют восстановительные свойства (за исключением фтора). Их окислительные способности уменьшаются, а восстановительные свойства увеличиваются от Cl2 к I2:

Рис.3. Окислительно-восстановительная способность галогенов.
Эту особенность иллюстрирует реакция окисление йода хлором в водном растворе:
![]()
В состав кислородосодержащих соединений, проявляющих двойственность поведения в окислительно-восстановительных реакциях, также входят элементы в промежуточной степени окисления. Кислородосодержащие кислоты галогенов и их соли, в состав молекул которых входит галоген в промежуточной степени окисления, могут быть как окислителями
![]()
так и восстановителями
![]()
Пероксид водорода, содержащий кислород в степени окисления -1, в присутствии типичных восстановителей проявляет окислительные свойства, так как степень окисления кислорода может понижаться до -2:
![]()
Последнюю реакцию используют при реставрации картин старых мастеров, краски которых, содержащие свинцовые белила, чернеют из-за взаимодействия с сероводородом воздуха.
При взаимодействии с сильными окислителями степень окисления кислорода, входящего в состав пероксида водорода, повышается до 0, Н2О2 проявляет свойства восстановителя:
![]()
Азотистая кислота и нитриты, в состав которых входит азот в степени окисления +3, а также могут выступать как в роли окислителей
![]()
так и в роли восстановителей
![]()
Классификация. Различают четыре типа окислительно-восстановительных реакций.
1. Если окислитель и восстановитель разные вещества, то такие реакции относятся к межмолекулярным. Примерами служат все рассмотренные реакции ранее.
2. При термическом разложении сложных соединений, в состав которых входят окислитель и восстановитель в виде атомов разных элементов, происходят окислительно-восстановительные реакции, называемые внутримолекулярными:
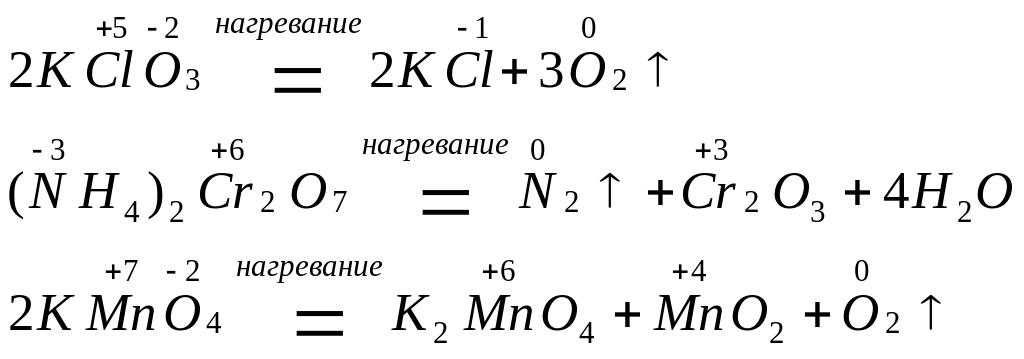
3. Реакции диспропорционирования (дисмутации или, согласно устаревшей терминологии, самоокисления - самовосстановления) могут происходить, если соединения, содержащие элементы в промежуточных степенях окисления, попадают в условия, где они оказываются неустойчивыми (например, при повышенной температуре). Степень окисления этого элемента и повышается, и понижается:

4. Реакции контрпропорционирования (конмутации) – это процессы взаимодействия окислителя и восстановителя, в состав которых входит один и тот же элемент с разными степенями окисления. В результате продуктом окисления и восстановления является вещество с промежуточной степенью окисления атомов данного элемента:

Существуют также реакции смешанного типа. Например, к внутримолекулярной реакции контрпропорционирования относится реакция разложения нитрата аммония
![]()
Составление уравнений.
Уравнения окислительно-восстановительных реакций составляют, основываясь на принципах равенства числа одних и тех же атомов до и после реакции, а также учитывая равенство числа электронов, отдаваемых восстановителем, и числа электронов, принимаемых окислителем, т.е. электронейтральность молекул. Реакцию представляют в виде системы двух полуреакций – окисления и восстановления, суммирование которых с учетом указанных принципов приводит к составлению общего уравнения процесса.
Для составления уравнений окислительно-восстановительных реакций наиболее часто используют метод электронно-ионных полуреакций и метод электронного баланса.
Метод электронно-ионных полуреакций применяют при составлении уравнений реакции, протекающих в водном растворе, а также реакции с участием веществ, степень окисления элементов которых трудно определить (например, KNCS, CH3CH2OH).
Согласно этому методу, выделяют следующие главные этапы составления уравнения реакций.
а) записывают общую молекулярную схему процесса с указанием восстановителя, окислителя и среды, в которой протекает реакция (кислотная, нейтральная или щелочная). Например
![]()
б) учитывая диссоциацию электролитов в водном растворе, данную схему представляют в виде молекулярно-ионного взаимодействия. Ионы, степени окисления атомов которых не изменяются, в схеме не указывают, за исключением ионов среды (Н+, ОН-):
![]()
в) определяют степени окисления восстановителя и окислителя, а также продуктов их взаимодействия:
окисление восстановителя восстановление окислителя
![]()
![]()
(Данный этап не является обязательным и его можно опустить, если определение степеней окислителя затруднительно. Скобки при записи аниона обычно не используются, но в данном случае необходимы, чтобы избежать путаницы при определении степени окисления элемента и заряда аниона).
г) записывают материальный баланс полуреакции окисления и восстановления:
окисление восстановителя восстановление окислителя
![]()
![]()
д) суммируют полуреакции, учитывая принцип равенства отданных и принятых электронов:
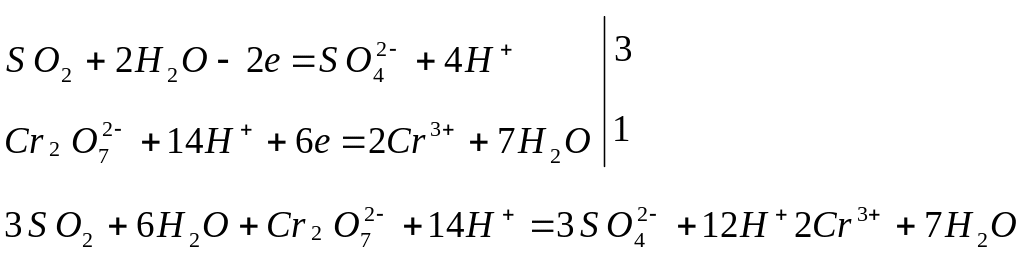
и, сокращая одноименные частицы, получают общее ионно-молекулярное уравнение
![]()
е) добавляют ионы, не участвовавшие в процессе окисления – восстановления, уравнивают их количество слева и справа, и записывают молекулярное уравнение реакции
![]()
Наибольшие трудности возникают при составлении материального баланса полуреакций окисления и восстановления, когда изменяется число атомов кислорода, входящих в состав частиц окислителя и восстановителя. Следует учитывать, что в водных растворах связывание или присоединение кислорода происходит с участием молекул воды и ионов среды.
В процессе окисления на один атом кислорода, присоединяющийся к частице восстановителя, в кислотной и нейтральной средах расходуется одна молекула воды и образуются два иона Н+; в щелочной среде расходуются два гидроксид-иона ОН- и образуется одна молекула воды (табл.1.1).
Для связывания одного атома кислорода окислителя в кислотной среде в процессе восстановления расходуются два иона Н+ и образуется одна молекула воды; в нейтральной и щелочной средах расходуется одна молекула Н2О образуются два иона ОН- (табл.1, 2).
Таблица 1
Присоединение атомов кислорода к восстановителю в процессе окисления
Среда |
Частицы, участвующие в присоединении одного атома кислорода |
Образующиеся частицы |
Примеры полуреакций окисления |
Кислотная, нейтральная
Щелочная |
Н2О
2ОН- |
2Н+
Н2О
|
|
Таблица 2
Связывание атомов кислорода окислителя в процессе восстановления
Среда |
Частицы, участвующие в связывании одного атома кислорода |
Образующиеся частицы |
Примеры полуреакций восстановителя |
Кислотная
Нейтральная, щелочная |
2Н+
Н2О
|
Н2О
2ОН-
|
|
Достоинства метода электронно-ионных полуреакций заключается в том, что при составлении уравнений окислительно-восстановительных реакций учитываются реальные состояния частиц в растворе и роль среды в протекании процессов, нет необходимости использования формального понятия степени окисления.
Метод электронного баланса, основанный на учете изменения степени окисления и принципе электронейтральности молекулы, является универсальным. Его обычно используют для составления уравнений окислительно-восстановительных реакций, протекающих между газами, твердыми веществами и в расплавах.
Последовательность операций, согласно методу, такая:
1) записывают формулы реагентов и продуктов реакции в молекулярном виде:
![]()
2) определяют степени окисления атомов, меняющих ее в процессе реакции:
![]()
3) по изменению степеней окисления устанавливают число электронов, отдаваемых восстановителем, и число электронов, принимаемых окислителем, и составляют электронный баланс с учетом принципа равенства числа отдаваемых и принимаемых электронов:

4) множители электронного баланса записывают в уравнение окислительно-восстановительной реакции как основные стехиометрические коэффициенты:
![]()
5) подбирают стехиометрические коэффициенты остальных участников реакции:
![]()
При составлении уравнений следует учитывать, что окислитель (или восстановитель) может расходоваться не только в основной окислительно-восстановительной реакции, но и при связывании образующихся продуктов реакции, то есть выступать в роли среды и солеобразователя.
Примером, когда роль среды играет окислитель, служит реакция окисления металла в азотной кислоте, составленная методом электронно-ионных полуреакций:
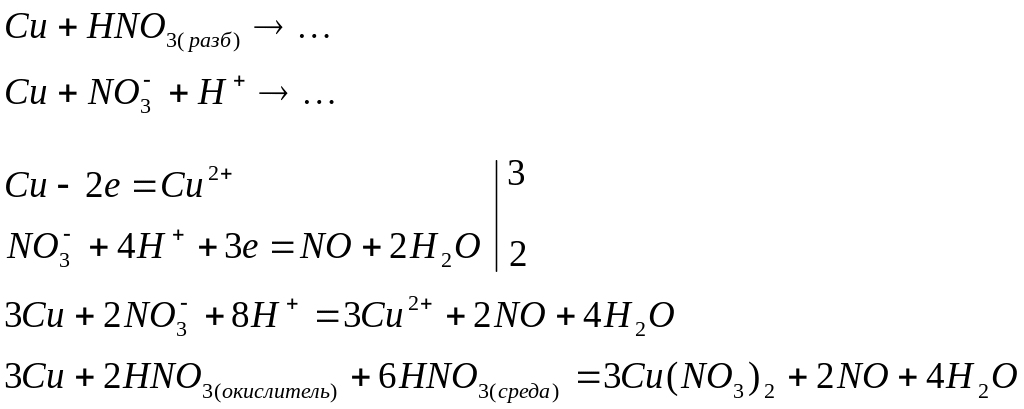
или
![]()
Примером, когда восстановитель является средой, в которой протекает реакция, служит реакция окисления соляной кислоты дихроматом калия, составленная методом электронного баланса:

или
![]()
При расчете количественных, массовых и объемных соотношений участников окислительно-восстановительных реакций используют основные стехиометрические законы химии и, в частности, закон эквивалентов. Для определения направления и полноты протекания окислительно-восстановительных процессов используют значения термодинамических параметров данных систем, а при протекании реакций в водных растворах – значения соответствующих электродных потенциалов.
ПРИЛОЖЕНИЯ