
- •Химическая термодинамика процессов
- •Общие положения
- •Возрастание неупорядоченности в самопроизвольных процессах
- •Второе начало термодинамики
- •Расчет количества теплоты для газопаровоздушной смеси
- •Расчет стандартной изобарной теплоемкости реакции горения при заданной температуре
- •Расчет изменения стандартной энтропии реакции горения в зависимости от температуры
Химическая термодинамика процессов
Применительно к химическим и физико-химическим явлениям на пожаре с помощью химической термодинамики можно производить следующие термодинамические расчеты:
определить тепловой эффект реакции горения;
определить направление протекания самопроизвольной химической реакции при фиксированных условиях;
оценить влияние термодинамических факторов (температуры, давления, концентрации веществ) на возможность и направленность его протекания процесса. Рассмотрим основные положения химической термодинамики.
Общие положения
Термодинамика – это раздел физики, изучающий явления передачи и превращения энергии при всевозможных процессах. Частью термодинамики является химическая термодинамика, изучающая передачу и превращение энергии при химических процессах.
В термодинамике центральным объектом рассмотрения является система.
Системой называют любой материальный объект, занимающий определенную область пространства, имеющий реальные или условные границы и взятый для решения каких-либо теоретических или практических вопросов (например: очаг пожара).
При выборе системы есть одно ограничение: система должна состоять из большого числа структурных единиц (атомов, молекул, ионов).
Часть термодинамической системы с присущими ей химическим составом и строением называется фазой. Система, состоящая из одной фазы, называется гомогенной (смесь метана с воздухом), из двух и более фаз – гетерогенной (твердое или жидкое горючее вещество и воздух).
Все, что находится за границами выбранной системы, представляет собой окружающую среду. Система и окружающая среда находится во взаимодействии:
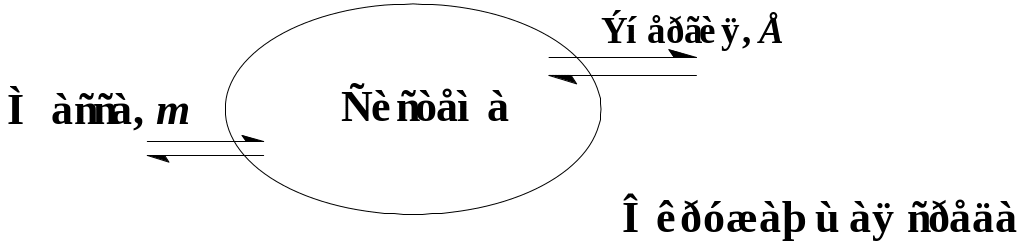
С точки зрения термодинамики, разновидностями систем являются системы:
-открытые (обмениваются с окружающей средой и веществом, и энергией), пожар является примером открытой системы;
- закрытые (обмениваются с окружающей средой энергией);
- изолированные (отсутствует всякий обмен с окружающей средой).
Система или находится в определенном состоянии, или в ней идет некоторый процесс, и состояние непрерывно изменяется.
Состоянием системы называется совокупность условий существования и состава системы.
Состояние системы характеризуется параметрами:
-температурой;
-давлением;
-объемом;
-концентрацией вещества.
Стандартным состоянием индивидуального вещества считается устойчивая форма вещества при температуре 298,15К (25°С) и давлении 101,3 кПа.
Стандартным состоянием смеси газов считается смесь при заданной температуре (часто 298,15К) и парциальном давлении каждого газа 101,3 кПа (1 атм).
От параметров состояния зависят различные физические свойства системы, которые называются функциями состояния.
При изучении энергетики химичек их реакций возникает вопрос о запасе энергии системы, который изменяется при выделении и поглощении энергии. Этот запас энергии называется – внутренней энергией (U), зависит от параметров состояния и поэтому является функцией состояния.
В термодинамике интерес представляет не сама внутренняя энергия, а её изменение (∆U), которое можно определить на основе термохимических измерений.
Перейдем к рассмотрению процессов.
Процессом называется переход системы из одного состояния в другое.
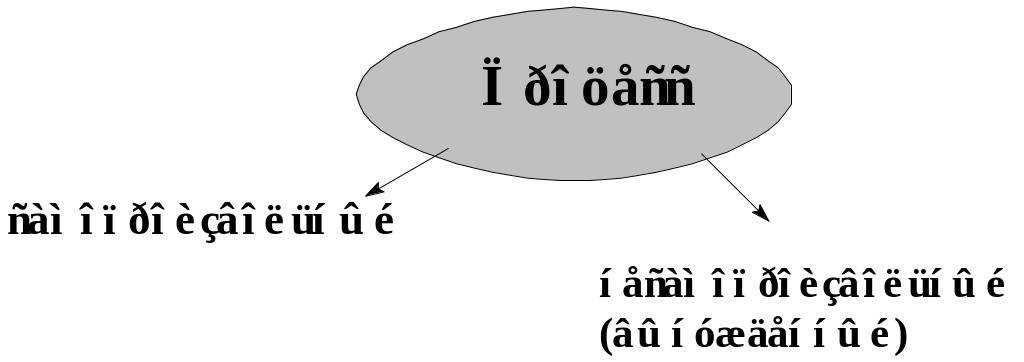
Самопроизвольный процесс — процесс, протекающий без внешнего воздействия на систему.
Несамопроизвольный (вынужденный) — процесс, протекающий при воздействии на систему, связан с затратой энергии.
Теоретическое и практическое изучение процессов упрощается при постоянстве условий:
-процесс, протекающий при постоянном давлении (р = const), называется изобарным,
-процесс, протекающий при постоянном объеме (V = const) – изохорным,
-процесс, протекающий при постоянной температуре (T = const) – изотермическим,
-процесс, протекающий без передачи теплоты (Q=0) с окружающей средой – адиабатическим.
-процесс, протекающий при постоянном давлении (р = const) и постоянной температуре (T = const) изобарным —изотермическим,
-процесс, протекающий при постоянном объеме (V = const) ) и постоянной температуре (T = const) изохорно —изотермическим.
Теплота – неупорядоченная форма передачи энергии в результате контакта непрерывно движущихся микрочастиц.
Условием передачи энергии в форме теплоты является разность температур. Когда тепло переходит из области более высоких температур, в область более низких температур.
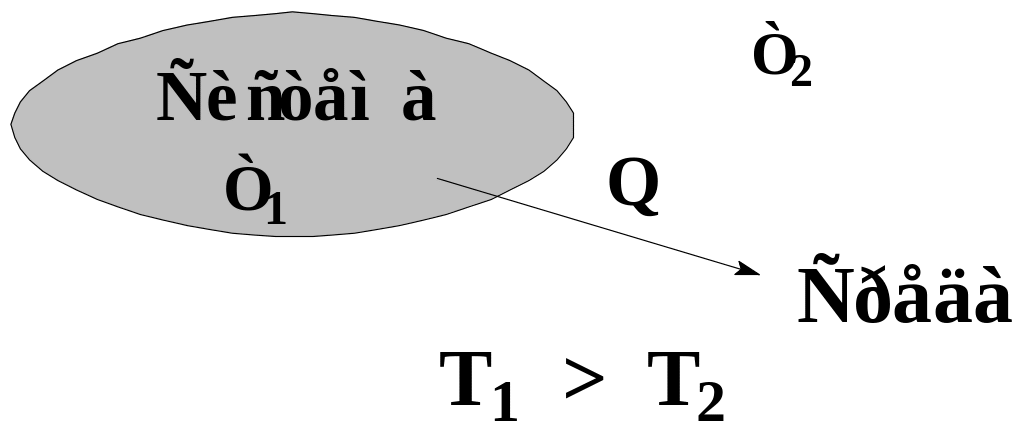
Рис. 1. Условие перехода теплоты
Работа — упорядоченная форма передачи энергии, связанная с преодолением внешнего сопротивления.
В качестве форм передачи энергии и теплота, и работа могут считаться как положительными, так и отрицательными.

Рис. Принятые знаки теплоты и работы
Важнейшими понятиями термодинамики являются необратимые и обратимые процессы.
Необратимый процесс - идет самопроизвольно без преодоления внешнего сопротивления или с преодолением некоторого сопротивления, неспособного остановить процесс.
Обратимый процесс – идет в условиях, бесконечно близких к состоянию равновесия.
Первое начало термодинамики
Понятием «начало» принято обозначать важнейшие законы, на которых основана термодинамика. Первое начало термодинамики представляет собой непосредственное следствие закона сохранения энергии. В 1842 г. Ю.Р. Майер теоретическим путем вычислил механический эквивалент теплоты. Формулировка первого начала термодинамики:
В любом процессе изменение внутренней энергии U системы равно сумме количества переданной теплоты и совершенной работы.
∆U= Q - W
В правой части уравнения вместо суммы, разность теплоты и работы по причине принятой для них системы знаков.
Если система выделяет теплоту Q<0 и одновременно свершает работу над окружающей средой W>0, то убыль внутренней энергии
∆U<0 будет обусловлена как отдачей теплоты, так и свершением работы.
В процессе при постоянном давлении меняется объем (особенно значительно при участии газов) и становится неизбежной работа расширения (сжатия) W= pх∆V
Обозначим через W' полезную работу. Разделим работу на два слагаемых:
∆U= Q - W' - pх∆V
∆U+ pх∆V = Q - W'
Сумма слева рассматривают функцию состояния - энтальпию (Н) Н≡U+ pхV;
∆Н=∆U+ pх∆V
∆Н= Q - W'
В необратимом изобарно-изотермическом процессе полезная работа не совершается, тогда:
∆Н= Q (∆Н= Qр)
Данное уравнение означает, что при отсутствии полезной работы теплота процесса является функцией состояния.
Энтальпия — функция состояния, изменение которой равно теплоте необратимого изобарно-изотермического процесса.
∆Н<0 процесс экзотермический;
∆Н>0 процесс эндотермический.
В необратимом изохорном процессе не совершается не только полезная работа, но и работа расширения.
Для сравнения тепловых эффектов различных реакций и для расчетов применяются стандартные значения термодинамических функций, обозначаемых символом °.
Стандартная теплота реакции ∆rН° - это теплота одного оборота реакции при определенных условиях (Т=298,15 К (25°С)).
Оборот реакции -это превращение, в котором количества веществ численно равны стехиометрическим коэффициентам.
Термохимическое уравнение можно записать в следующем виде:
СаО(кр) + СО2(г) = СаСО3(кр) ∆rН°= -177 кДж
В 1840 г. петербургский академик Г.И. Гесс (1802-1850) открыл закон постоянства количества теплоты, называемый законом Гесса.
Теплота химической реакции равна сумме теплот любого ряда последовательных реакций с теми же исходными веществами и конечными продуктами.
Сущность закона Гесса состоит в том, что теплота процесс определяется только начальным и конечным состоянием системы, и невозможно изменить энергию (например, получить дополнительную энергию) изменением пути процесса. Сумма теплот для всех этих путей одинакова.
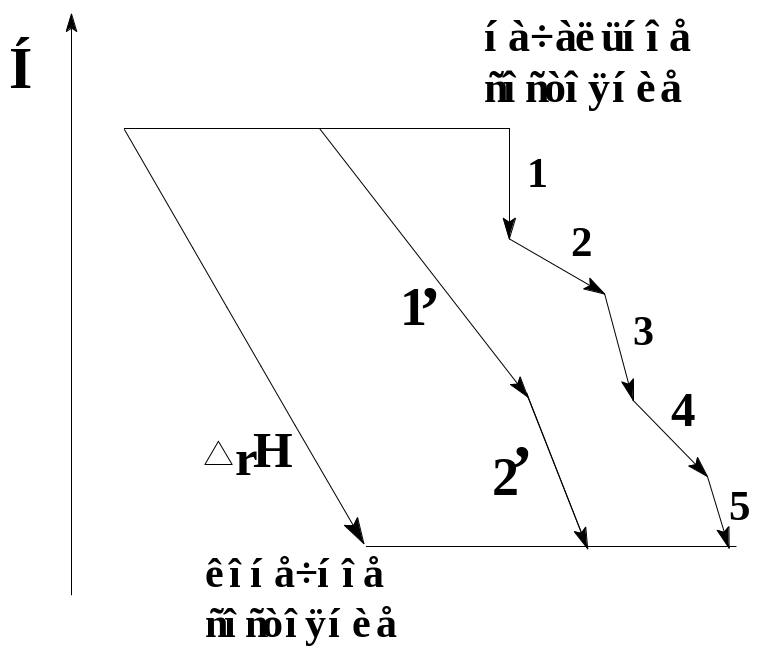
Рис. Сущность закона Гесса
∆rН°=∆1Н°+∆2Н°=Σ∆iН°
Теплота любой химической реакции может быть рассчитана на основе закона Гесса с применением табличных данных по теплотам образования или теплотам сгорания веществ, участвующих в реакции.
Стандартная теплота образования ∆fН°, кДж/ моль, численно равна изменению энтальпии при образовании 1 моль сложного вещества из простых веществ.
** Стандартная теплота образования ∆fН° простых веществ принимается равной нулю.
Стандартная теплота сгорания ∆сН°, кДж/ моль, численно равна изменению энтальпии при сгорании 1 моль вещества в кислороде.


На практике термодинамические расчеты не сводятся к вычислению стандартных теплот реакций. Важно бывает знать, сколько теплоты выделится или будет затрачено при превращении определенной массы вещества или сколько надо взять вещества для получения определенного энергетического эффекта.
![]()
теплота ∆rН° соответствует ν моль реагента;
теплота ∆rН соответствует n моль реагента;
