
- •Классификация ферросплавных процессов Классификация и назначение ферросплавов
- •Общие требования к качеству ферросплавов
- •Способы получения ферросплавов Классификация способов получения ферросплавов по виду используемого агрегата
- •Непрерывные и периодические процессы.
- •Бесшлаковые и шлаковые процессы
- •Флюсовые и бесфлюсовые процессы
- •Физико-химические основы получения ферросплавов
- •Влияние температуры на изобарные потенциалы образования оксидов
- •Кинетика процессов
- •Шлаки ферросплавного производства
- •Конструкция ферросплавных печей
- •Кожух и футеровка печи
- •Электроды
- •Определение мощности трансформатора
- •Подготовка шихтовых материалов
- •Углеродистые восстановители, применяемые в производстве ферросплавов
Кинетика процессов
Как было отмечено выше, термодинамика (значение термодинамического потенциала ΔG° и константы равновесия К) устанавливает только возможность самопроизвольного протекания реакции и определяет положение равновесия в системе, но не дает никаких сведений о времени, необходимом для достижения этого равновесия. Вместе с тем, практические результаты данного процесса зависят от скорости протекания его, которая в конечном счете определяет производительность печи, расход электроэнергии на плавку и т.п.
Вопросами определения скоростей реакций занимается химическая кинетика.
Известно, что некоторые реакции протекают, практически мгновенно, достигая равновесия за исключительно короткое время. Другие реакции, хотя термодинамически и возможны, не протекают с заметной скоростью или протекает, но медленно. Это указывает на то, что молекулы определенных веществ, вступающих в реакцию обладают химической инертностью.
Скорость гомогенной реакции аА + bB = cC + dD зависит от природы реагирующих веществ, их концентраций, температуры и других условий и выражается изменением концентрации кого-либо из реагентов в единицу времени. На основании закона действия масс скорость прямого и обратного процесса может быть определена из следующего выражения:
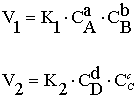
где V1 и V2 - скорость прямого и обратного процесса;
СA, CB, СС, CD - концентрации соответствующих веществ;
К1, К2 - константы скорости.
Константа К равна скорости, когда концентрация реагирующих веществ =1. Когда скорости прямого и обратного процесса равны друг другу V1=V2, тогда в системе наступает равновесие и константа равновесия может быть определена из уравнения:
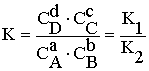
Следует заметить, что наблюдаемая зависимость скорости процесса от концентрации не всегда соответствует той, которая получается из выражения закона действующих масс. Это объясняется тем, что в реальных процессах механизм реакции может быть более сложным, чем это представляется из стехиометрических уравнений, а реакции протекают в несколько последовательных стадий.
При установившемся режиме процесса скорости на всех стадиях делаются равными и определяются скоростью лимитирующего (самого медленного) звена и поэтому скорость суммарного превращения, которое мы наблюдаем, также равна скорости лимитирующего звена.
Кнабл. = Климит. звена
Для процессов, протекающих в системе (печи, сталеплавильной ванне и т.п.), очень важно выявить лимитирующее звено и подбором соответствующих условий максимально ускорить его.
Из выражения для скорости реакции следует, что чем выше концентрации веществ, тем больше вероятность встречи (соударений) молекул друг с другом, тем больше вероятность реакции.
Однако опыт показывает, что соударений молекул еще недостаточно для того, чтобы произошла реакция. Только молекулы, обладающие в момент соударения некоторой энергией активации, представляющей тот избыток энергии, которым должны обладать молекулы по сравнению со средней энергией молекул, будут вступать в реакцию.
Скорость химической реакции быстро возрастает с температурой. Зависимость константы скорости реакции и, следовательно, самой скорости определяется уравнением Аррениуса:
![]()
где К - константа скорости реакции;
Ко - постоянная величина (предэкспоненциальный множитель или фактор частоты);
Е - энергия (теплота) активации;
R - газовая постоянная;
Т- абсолютная температура.
Это уравнение предполагает, что реакция происходит между молекулами, находящимися в активном состоянии, и для перевода таких молекул из обычного состояния затрачивается энергия активации Е.
Исследования показали, что для протекания реакций важны не только концентрация и энергия молекул, но также их координация, т.е. как молекулы ориентированы в пространстве в момент столкновения. Оказывается, что реакция возможна тогда, когда молекулы столкнутся активными участками. Столкновение неактивными участками обычно не приводит к реакции.
Логарифмируя уравнение Аррениуса, получаем:
![]()
Второй член этого уравнения мало изменяется с температурой, поэтому скорость реакции определяется, главным образом, величиной первого члена уравнения, т.е. энергией активации;
Установлено, что в области низких температур быстрее протекают реакции с меньшей энергией активации, т.к. E/RT мало. Наоборот, в области высоких температур идут реакций с большим значением энергии активации.
Известно, что скорость целого ряда реакций при увеличении температуры только на 10° увеличивается вдвое и даже втрое.
Таким образом, для того, чтобы реакция произошла, необходимо, чтобы:
1. Произошло столкновение молекул.
2. Молекулы обладали необходимой для реакции энергией
(энергия активации),
3. Молекулы в момент столкновения были определенным образом ориентированы в пространстве.
Необходимо отметить, что скорость реакции в сильной степени зависит от условий подвода реагирующих веществ к зоне реакции и отвода получающихся продуктов от нее. Чем быстрее подводятся реагирующие вещества, тем скорее будет идти процесс (при высоких скоростях реакций). Если доставка и удаление участников реакции недостаточна для данных скоростей реакции, то в зоне ее протекания система будет приближаться к равновесию и скорость реакции упадет до нуля.
Количество подводимых к зоне реакции и отводимых от нее продуктов в большой мере зависит от вязкости и жидкоподвижности сред, через которые подводятся и отводятся вещества (расплав шихты, шлак, металл, шихта), а также, от величины поверхности соприкосновения сред, через которые транспортируются участники реакции. Например, при протекании реакций на поверхности соприкосновения металл-шлак имеет огромное значение поверхность зеркала ванны и т.п.
