
- •Классификация ферросплавных процессов Классификация и назначение ферросплавов
- •Общие требования к качеству ферросплавов
- •Способы получения ферросплавов Классификация способов получения ферросплавов по виду используемого агрегата
- •Непрерывные и периодические процессы.
- •Бесшлаковые и шлаковые процессы
- •Флюсовые и бесфлюсовые процессы
- •Физико-химические основы получения ферросплавов
- •Влияние температуры на изобарные потенциалы образования оксидов
- •Кинетика процессов
- •Шлаки ферросплавного производства
- •Конструкция ферросплавных печей
- •Кожух и футеровка печи
- •Электроды
- •Определение мощности трансформатора
- •Подготовка шихтовых материалов
- •Углеродистые восстановители, применяемые в производстве ферросплавов
Влияние температуры на изобарные потенциалы образования оксидов
При низких температурах реакции взаимодействия элементов с кислородом протекают с образованием твердых или жидких оксидов. С повышением температуры прочность конденсированных (твердых или жидких) оксидов уменьшается и значение изобарного потенциала образования этих оксидов ΔGoт увеличивается, т. е. отрицательное значение изобарного потенциала уменьшается. Совершенно иначе влияет температура на изобарный потенциал образования окиси углерода. При образовании окиси углерода происходит увеличение количества газообразных веществ, поэтому степень неупорядоченности в системе увеличивается, а энтропия возрастает. Изменение энтропии является положительным (ΔS>0). Чем выше температура, тем больше величина энтропийного члена (ТΔS). Таким образом, увеличение температуры приводит к уменьшению отрицательного значения изобарного потенциала образования твердых (или жидких) оксидов и к увеличению этой величины для окиси углерода. Такое действие температуры оказывает большое влияние на ход углетермических реакций восстановления оксидов.
При достаточно высокой температуре величина энтропийного члена становится равной величине теплового эффекта. При этом изобарный потенциал реакции становится равным нулю, а при более высокой температуре он становится отрицательным. Такая температура является низшей температурой, при которой возможно протекание реакции. Она может быть определена по следующему уравнению:
T = ΔH / ΔS
В среднем изменение энтропии при восстановлении оксидов углеродом равно 175 Дж/(моль·К). Приближенную оценку температуры, при которой возможно восстановление оксида, можно получить, поделив тепловой эффект реакции на 175:
T = ΔH / 175
Вычисленные по этому уравнению температуры, при которых возможно восстановление различных оксидов углеродом, приведены в табл.
Таблица Расчет наименьшей температуры восстановления различных оксидов углеродом.
Уравнение реакции восстановления |
ΔH°,кДж/моль· 10-3 |
ΔS°,кДж/(моль·K) |
Температура |
|
К |
°С |
|||
FeO + С = Fe + СО |
120 |
134,3 |
893 |
620 |
1/2SiO2 + C = 1/2Si + CO |
330,4 |
182,7 |
1810 |
1537 |
1/3Cr2O3 + C = 1/3Cr + CO |
251,8 |
168,5 |
1490 |
1217 |
1/2TiO2 + C = 1/2Ti + CO |
337,3 |
171,4 |
1970 |
1697 |
1/2MoO2 + C= 1/2Mo + CO |
168,7 |
166,8 |
1010 |
737 |
1/2WO2 + C = 1/2Si + CO |
173,3 |
171,4 |
1010 |
737 |
ZrO2 + С = 1/2Zr + CO |
417,6 |
176,4 |
2360 |
2087 |
MnO + С = Mn + CO |
288 |
173,5 |
1660 |
1387 |
NiO + С = Ni + CO |
136,5 |
198,4 |
723 |
450 |
1/3V2 O3 + С = 2/3V + CO |
282,8 |
160,1 |
770 |
1497 |
1/3Al2O3 + С = 2/3Аl + СО |
439,8 |
191 |
2305 |
2032 |
При выборе восстановителя необходимо решать следующие вопросы:
1. Возможность восстановления данного (ведущего) элемента из его оксида.
2. Степень извлечения восстанавливаемого элемента из руды в металл (какой может быть достигнут конечный результат в извлечении).
3. Какова может быть достигнута максимальная скорость восстановления данного элемента из руды.
На первые два вопроса нам может дать ответ термодинамика расчетным путем без проведения специальных исследований, а на третий - кинетика, которая требует знания механизма процесса и требует проведения экспериментов.
Определение возможности восстановления элемента из оксида
Рассмотрим, какие необходимы условия для протекания реакции восстановления оксида МеО восстановителем Me .
2МеО + 2Me' = 2Ме + 2Ме'O (I)
Эта реакция возможна при условии, когда химическое сродство восстановителя (Ме') к кислороду больше сродства к кислороду восстанавливаемого элемента.
Величина сродства элемента к кислороду может быть определена на основании стандартного изобарного термодинамического потенциала (ΔGo).
Как известно, любая реакция восстановления протекает одновременно с реакцией окисления. Поэтому реакцию (I) можно представить в виде следующих двух реакций:
2Ме + O2 = 2МеО (-ΔG01) (2)
2Ме' + O2 = 2Me'О (-ΔG02) (3)
Очевидно, что реакция (I) может идти самопроизвольно только в том случае, когда абсолютное значение (ΔG01) будет меньше абсолютного значения (ΔG02).
Реакцию (I) можно представить как сумму последовательно протекающих превращений - диссоциации MeO и окисления Me'
2МеО = 2Ме + O2 + ΔG1°
2Me' + O2 = 2Mе'O - ΔGo2
2MeO + 2Me' = 2Me + 2Me'O; ΔG03
где ΔG03 = - ΔGo2 + ΔGo1 (1)
Очевидно, что возможность самопроизвольного протекания реакции (1) будет иметь место тогда, когда ΔGo3 будет отрицательной величиной.
Значения ΔGo для любой температуры могут быть определены из выражения
ΔGoт = ΔНoт – Т ΔSoт
Для сокращения работы по определению ΔGºследует пользоваться таблицами значений ΔGº, приведенных в справочной литературе для различных оксидов при температурах 1500-2000К, что соответствует в среднем температурам выплавки ферросплавов.
Как известно, химические реакции не протекают до полного исчезновения исходных веществ и достигают равновесия при определенных соотношениях концентраций исходных веществ и продуктов.
Для изучаемого процесса важно знать, как далеко может быть сдвинуто равновесие в сторону восстановления ведущего элемента, т.к. этим определяется эффективность данного процесса (производительность, расход электроэнергии и т.д.).
Для ответа на этот вопрос необходимо прежде всего определить величину константы равновесия и рассмотреть влияние на положение равновесия различных факторов.
Для рассматриваемой реакции
MeO + Me' = Me + Ме'O
константа
равновесия может быть выражена в
активностях, мольных долях и весовых
концентрациях:![]()
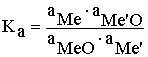 (а –
активность соответствующего вещества)
(а –
активность соответствующего вещества)
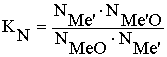 (N – мольная
доля)
(N – мольная
доля)
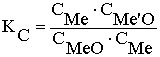 (С
– весовая концентрация вещества)
(С
– весовая концентрация вещества)
Константа равновесия, выраженная через активности, зависит только от температуры и является константой для любых реальных систем. Константы равновесия, выраженные через мольные доли или весовые концентрации, без введения коэффициентов активности, справедливы только для сильно разбавленных растворов, подчиняющихся законам идеальных систем. При применении КN и KC к реальным системам в них должны быть внесены поправки в виде коэффициентов активности:
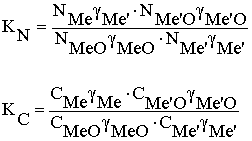
Без введения этих поправок КN и КC не являются константами а представляют собой только характеристики равновесия, так как величина их зависит не только от температуры, но и от концентраций веществ.
Для суждения о том, насколько далеко может быть сдвинуто равновесие той иди другой реакции в сторону восстановления данного элемента, можно воспользоваться существующей зависимостью между константой равновесия и термодинамическим потенциалом:
![]()
Ниже приводится пример определения величины К на основании этого уравнения.
MnOтв + Cгр = [Mn] + CO
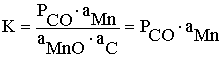
Из справочника находим ΔGo = 68700 – 40,57T, тогда
![]()
и при 1600оС (1973 К) lgK=1,37, откуда K = 23,5. Эта цифра указывает, что при восстановлении марганца равновесие при 1600°С будет сдвинуто далеко вправо и, следовательно, выход марганца будет достаточно высоким.
На положение равновесия реакции восстановления и степени извлечения ведущего элемента из руды оказывают большое влияние оказывают следующие факторы:
1. Снижение активности одного из получаемых продуктов путем добавки флюсов. Наглядным примером служит сравнение извлечения хрома при бесфлюсовом и флюсовом силикотермическом способе получения феррохрома.
При бесфлюсовом способе равновесие реакции
2Сг2О3 + 3 Si = 4Сг + 3SiO2
достигается при очень низком извлечении хрома шихты, порядка 40-50 %.
В случае добавки в шихту извести (флюса) характер процесса меняется:
2Сг2О3 + 3Si + 3СаО = 4Cr + 5(СаО · SiO2)
при наличии СаО в системе активность SiO2 сильно снижается и равновесие реакции восстановления хрома сдвигается далеко вправо, в результате извлечение хрома при флюсовом способе достигает 83-86 %.
2. Выведение одного из продуктов реакции из зоны реакции. Одним из наиболее широко применяемых методов этого рода является применение железа, играющего роль растворителя (осадителя) для восстанавливаемого ведущего элемента. Например, при получении ферросилиция в шихту вводят железную стружку, в результате, восстановленный кремний растворяется в железе (которое плавится раньше всего) и осаждается на подину печи. Растворяя кремний, железо выводит из зоны реакции восстановленный кремний и тем самым все время нарушает равновесие реакции восстановления. В результате этого достигается высокое извлечение кремния из шихты, около 92 %.
В некоторых специальных технологических процессах для выведения газообразного продукта СО при рафинировочных процессах пользуются вакуумом. Например, при рафинировании жидкого феррохрома в вакуумной индукционной печи идет процесс обезуглероживания за счет растворенного в металле кислорода:
С+О = СОгаз
Создавая вакуум до 10-2 мм рт.ст. и удаляя непрерывно образующуюся СО, можно понизить содержание углерода в феррохроме от 0,10 до 0,02-0,03.
Применение вакуума дает возможность вести далеко идущие процессы обезуглероживания, чего нельзя достичь при условии атмосферного давления.
3. Мощным параметром повышения выхода ведущего элемента из шихты является температура.
Повышение температуры всегда увеличивает выход восстанавливаемого металла при эндотермических процессах и может понизить в ряде случаев при экзотермических процессах. Необходимо заметить, что чрезмерное повышение температуры в печи ведет к разрушению футеровки и потерям восстанавливаемого металла через испарение. Поэтому для каждого процесса должна устанавливаться оптимальная температура, при которой получаются наилучшие технико-экономические показатели.
